Professional Documents
Culture Documents
Unidad 2. Bioenergetica Reacciones de Oxido-Reduccion
Uploaded by
Gar AraOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Unidad 2. Bioenergetica Reacciones de Oxido-Reduccion
Uploaded by
Gar AraCopyright:
Available Formats
2.
5 Reacciones de Oxido-Reduccin
Las reacciones de transferencia electrnica metablica son de suma importancia,
estas reacciones son de oxido-reduccin e intervienen, la perdida de electrones de
una especia qumica, que es as oxidada, y la ganancia por otra es reducida. La
ruta del flujo de electrones en el metabolismo pasa desde diversos intermediarios
metablicos a transportadores electrnicos en reacciones catalizadas por
enzimas. Estos transportadores ceden electrones a aceptores, con afinidad por
estos mas elevada cuando esto sucede se libera energa. Las clulas contienen
una serie de transductores de energa molecular que transforma la energa del
flujo electrnico en trabajo til.
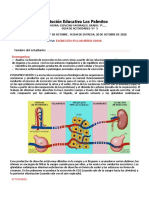
Flujo de electrones para realizar trabajo biolgico.
La conversin de flujo electrnico en trabajo biolgico requiere transductores
moleculares, anlogos a los motores electrnicos, que convierten el flujo de
electrones a travs de circuitos macroscpicos en movimiento mecnico. La
analoga entre un circuito que conecta una batera con un motor electrnico y los
circuitos electrnicos submicroscpicos de las clulas se describe a continuacin.
En el circuito fig. a, la fuente de electrones es una batera que contiene dos
especies qumicas que difieren de afinidad hacia los electrones. Los cables
elctricos proporcionan la ruta para el flujo de electrnico desde la especie
qumica, en un polo de la batera, a travs del motor, a la especie qumica en el
otro polo de la batera. Debido a que las dos especies qumicas difieren en su
afinidad hacia los electrones, estos fluyen espontneamente a travs del circuito,
impulsados por una fuerza proporcional a la diferencia en afinidad electrnica, la
fuerza electromotriz, la cual puede realizar trabajo si hay un transductor de energa
adecuado, como un motor, en el circuito. El motor se puede acoplar a diferentes
ingenios mecnicos para realizar el trabajo.
En el circuito biolgico fig. b, la fuente de electrones es un compuesto
relativamente reducido, como la glucosa. A medida que la glucosa se oxida
enzimticamente, se liberan electrones que fluyen espontneamente a travs de
una serie de transportadores electrnicos intermediarios a otra especie qumica
con una afinidad elevada por electrones, como el O 2. El flujo electrnico es
espontneo y exergnico, porque el O 2 tiene afinidad por los electrones mayor que
la que tienen los intermedios que ceden electrones. La fuerza electromotriz que
resulta proporciona energa a los transductores moleculares que realizan trabajo
biolgico. En la mitocondria, por ejemplo los transductores ligados a la membrana
acoplan el flujo electrnico a la produccin de pH transmembrana, con lo que se
consigue trabajo osmtico y elctrico, lo que nos da una energa potencial.
Tambin estos transductores utilizan la energa potencial o protn motriz para
realizar trabajo qumico: se sintetiza ATP a partir de ADP y Pi, a medida que los
protones fluyen espontneamente a travs de la membrana.
Descripcin de las reacciones de oxidacin-reduccin.
Se considera la oxido-reduccin de forma separada, por ejemplo la oxidacin del
ion ferroso por el ion cprico:
Se puede describir en funcin de dos medias reacciones:
La molcula dadora de electrones es una reaccin de oxidacin-reduccin se
denomina agente reductor, la molcula aceptora de electrones es el agente
oxidante.
En las oxidaciones biolgicas intervienen la deshidrogenacin.
El carbono aparece en las clulas vivas en cinco estados de oxidacin diferentes.
En los compuestos mas reducidos los tomos de carbono son ricos en electrones
e hidrogeno, mientras que en los compuestos mas oxidados un tomo de carbono
esta unido a ms oxigeno y menos hidrogeno. En la oxidacin del etano al etanol,
el compuesto no pierde hidrogeno pero si lo pierde uno de los tomos de carbono;
por supuesto el hidrogeno del grupo OH no esta unido directamente al carbono.
En la serie de compuesto se muestran la oxidacin de un tomo de carbono es
sinnimo de su deshidrogenacin. Cuando un tomo de carbono comparte un par
electrnico con otro tomo como el oxigeno, lo comparten de manera desigual,
siendo favorecidos en este aspecto el tomo mas electronegativo (oxigeno). La
oxidacin tiene el efecto de eliminar electrones del tomo de carbono.
Los electrones se transfieren de una molcula a otra de cuatro formas diferentes:
1. Se pueden transferir directamente como electrones. As el par redox Fe 2+/Fe3+
puede transferir un electrn al par redox Cu +/Cu2+:
2. Los electrones se pueden transferir en forma de tomos de hidrogeno, ya que
un tomo de hidrogeno consiste en un protn (H +) y un electrn (e-), en donde
AH2 acta como un dador de hidrogeno (o electrn). AH 2 y A conjuntamente
constituyen un par redox conjugado que puede reducir otro compuesto B por
transferencia de tomos de hidrogeno:
3. Los electrones se pueden transferir de un dador electrnico a un aceptor en
forma de ion hidruro (:H +), que incluye dos electrones tal como sucede con las
deshidrogenasas ligadas a NAD descritas mas adelante.
4. Tambin tienen lugar la transferencia de electrones cuando hay una
combinacin directa de un reductor orgnico con oxigeno, para dar un producto
en el que el oxigeno esta incorporado de manera covalente, tal como sucede
en la oxidacin de un hidrocarburo a alcohol:
En esta reaccin el hidrocarburo es el dador electrnico y el tomo de oxigeno es
el aceptor electrnico.
Los cuatro tipos de transferencia electrnica se dan en la clula.
Los potenciales de reduccin son una medida de la afinidad hacia los
electrones.
Cuando en una solucin se encuentran dos pares redox conjugados, se puede
producir espontneamente la transferencia electrnica desde el dador electrnico
de un par aceptor del otro. La tendencia a que tal reaccin ocurra depende de la
afinidad relativa del aceptor electrnica de cada par redox por electrones, el
potencial de reduccin estndar (Eo) es una medida de esa afinidad.
Hace algunos aos Walther Nernst dedujo la ecuacin que relaciona el potencial
de reduccin estndar (Eo) con el potencial de reduccin (E) a cualquier
concentracin de especies oxidadas o reducidas en el electrodo:
En donde R y T tienen su significado habitual (tabla 13-1), n es el nmero de
electrones transferidos y
es la constante de Faraday, 96.48 kJ/V mol a (298 K,
25 C), esta expresin se simplifica a:
Los potenciales de reduccion estandar permiten el calculo de la variacion de
energia libre de Gibbs.
La energia que se obtiene para realizar trabajo por este flujo espontaneode
electrones (la variacion de energia libre para esta reaccion de oxidacionreduccion) es proporcional a E:
Aqu n representa el numero de electrones transferidos en la reaccion. Con esta
ecuacion es posible calcular la variacion de energia libre para cualquier reaccion
de oxidacion reduccion a partir de los valores de Eo (encontrado en una tabla de
potenciales de reduccion) y la concentracion de las especies que intervienen en la
reaccion.
Bibliografa referente a los temas de la Unidad 2.
Albert L., Lehninger, PRINCIPIOS DE BIOQUIMICA, segunda edicin 1995,
Editorial Omega, SA, Capitulo 13 pp. 364-399 Principios de bioenergtica
You might also like
- Titulación potenciométrica de haluros usando Ag+ para determinar KCl y KIDocument7 pagesTitulación potenciométrica de haluros usando Ag+ para determinar KCl y KICamilo DiazNo ratings yet
- Práctica 10 y 11 DETERMINACIÓN DE LA ACTIVIDAD (SDH) Y CITOCROMAS - Amador y AbrizDocument8 pagesPráctica 10 y 11 DETERMINACIÓN DE LA ACTIVIDAD (SDH) Y CITOCROMAS - Amador y AbrizIridian ArNo ratings yet
- Práctica 2 GENÉTICADocument3 pagesPráctica 2 GENÉTICAmiguel angelNo ratings yet
- ReporteDocument6 pagesReportejazdany santanaNo ratings yet
- PRACTICA L. 10. FotosíntesisDocument6 pagesPRACTICA L. 10. FotosíntesisFernando R QquelccaNo ratings yet
- La AcetanilidaDocument5 pagesLa Acetanilidadilmer salcedo0% (1)
- Ley de Beer y Construcción de La Curva de Rigbom para El Indicador VBCDocument6 pagesLey de Beer y Construcción de La Curva de Rigbom para El Indicador VBCfgranoblesNo ratings yet
- Fisicoquímica Práctica 5Document6 pagesFisicoquímica Práctica 5AngelesTorresNo ratings yet
- Reacciones AnapleroticasDocument17 pagesReacciones AnapleroticasMaria RivasNo ratings yet
- Unidad # 6 Potenciometria DirectaDocument25 pagesUnidad # 6 Potenciometria DirectaDarkcacherNo ratings yet
- Fraccionamiento de tejidos y caracterización de biomoléculasDocument5 pagesFraccionamiento de tejidos y caracterización de biomoléculasMychys DyazzNo ratings yet
- Informe 0, Bioquímica.Document6 pagesInforme 0, Bioquímica.Fernanda RodriguezNo ratings yet
- Practica de Laboratorio No. 6 (Final)Document15 pagesPractica de Laboratorio No. 6 (Final)Luis Alejandro hoyos AbaunzaNo ratings yet
- Energía y equilibrio bioquímicoDocument3 pagesEnergía y equilibrio bioquímicoduvier dukeNo ratings yet
- Practica #IV Identificación, Cuantificación Del Grupo de Las XantinasDocument19 pagesPractica #IV Identificación, Cuantificación Del Grupo de Las XantinasRoberto Esponda VelásquezNo ratings yet
- Rutas metabólicas Shigella spp y E. coliDocument7 pagesRutas metabólicas Shigella spp y E. coliAlejandra GualdronNo ratings yet
- Curvas-titulacion-aminoacidosDocument3 pagesCurvas-titulacion-aminoacidosNava Dominguez DanielaNo ratings yet
- Clase 5Document47 pagesClase 5Malú Sandy Contreras RodríguezNo ratings yet
- Informe Determinación Espectrofotométrica de Hierro en Un Alimento Por Adición de EstándaresDocument4 pagesInforme Determinación Espectrofotométrica de Hierro en Un Alimento Por Adición de EstándaresCamilo DussanNo ratings yet
- Ácido EsteáricoDocument3 pagesÁcido EsteáricosdfdvdfNo ratings yet
- Practica 1 Bioquimica MetabolicaDocument5 pagesPractica 1 Bioquimica MetabolicaYunhuel PerezNo ratings yet
- CurvasDocument2 pagesCurvasMiguel Valencia TorresNo ratings yet
- Curvas de Titulacion de Especies PolifuncionalesDocument24 pagesCurvas de Titulacion de Especies PolifuncionalesDoc KhemNo ratings yet
- Identificacion de Muestra Problema Por Medio de Espectroscopia IrDocument6 pagesIdentificacion de Muestra Problema Por Medio de Espectroscopia IrAbel de Jesús RiveraNo ratings yet
- Reporte 5 - Espectrofotometria UV-VisDocument11 pagesReporte 5 - Espectrofotometria UV-VisBraine BorgesNo ratings yet
- Prueba de TollensDocument3 pagesPrueba de Tollenscristian lopezNo ratings yet
- Cromatografía Ascendente de AminoácidosDocument5 pagesCromatografía Ascendente de AminoácidosLiz SalazarNo ratings yet
- AlbuminaDocument4 pagesAlbuminaFernandoMora0% (1)
- Toxicidad del Arseniato: Menos ATPDocument2 pagesToxicidad del Arseniato: Menos ATPLuis RivasNo ratings yet
- Partición de AmoxicilinaDocument5 pagesPartición de AmoxicilinaCristian LamaizonNo ratings yet
- Laboratorio BioquímicaDocument30 pagesLaboratorio BioquímicaGladys Alba Baquero VizcainoNo ratings yet
- Cuestionario EnzimasDocument7 pagesCuestionario EnzimasJames ChNo ratings yet
- Valoraciones Precipitación ComplejosDocument29 pagesValoraciones Precipitación ComplejosGustavo BarrazaNo ratings yet
- Parte 3 - SUSTITUCIÓN ELECTROFÍLICA AROMÁTICADocument8 pagesParte 3 - SUSTITUCIÓN ELECTROFÍLICA AROMÁTICAVarov50% (2)
- BiomoleculasDocument3 pagesBiomoleculasDaniela IbarraNo ratings yet
- Detector Termoionico de Llama AlcalinaDocument3 pagesDetector Termoionico de Llama AlcalinaMarco AdrianNo ratings yet
- 2 - Separacion de Una Mezcla de Aminoacidos Por Cromatografia Por Intercambio Ionico ADocument7 pages2 - Separacion de Una Mezcla de Aminoacidos Por Cromatografia Por Intercambio Ionico ALuis Romero100% (4)
- Microscopio y Tincion Simple FIMDocument19 pagesMicroscopio y Tincion Simple FIMGabriela HuazoNo ratings yet
- Aminoácidos y péptidos: estructura, clasificación y propiedadesDocument14 pagesAminoácidos y péptidos: estructura, clasificación y propiedadesFrancisco Alejandro Torres GarciaNo ratings yet
- Informe de Laboratorio II (Analisis Organico Cualitativo RMN)Document7 pagesInforme de Laboratorio II (Analisis Organico Cualitativo RMN)Julian Camilo Leon MartinezNo ratings yet
- Bombeo de Protones en Levaduras y Sus Procesos InhibitoriosDocument8 pagesBombeo de Protones en Levaduras y Sus Procesos InhibitoriosDavid Colorado VegaNo ratings yet
- Determinación de La Cinética Enzimática de La Fosfatasa Ácida y Factores FísicoDocument6 pagesDeterminación de La Cinética Enzimática de La Fosfatasa Ácida y Factores FísicoJennifer MacaNo ratings yet
- La Enzima Fosfofructuquinasa en Higado de AlpacaDocument5 pagesLa Enzima Fosfofructuquinasa en Higado de AlpacaEdita TorresNo ratings yet
- Cristales líquidos benzoato colesteriloDocument4 pagesCristales líquidos benzoato colesteriloPoncho MalagónNo ratings yet
- Pre 3 FQ2Document8 pagesPre 3 FQ2Lesli RamirezNo ratings yet
- Taller Poblacion BacterianaDocument3 pagesTaller Poblacion BacterianaLAURA DANIELA BUSTOS ZAMBRANONo ratings yet
- EJERCICIOS BIOENERGETICADocument2 pagesEJERCICIOS BIOENERGETICAMrd DavidNo ratings yet
- Seminario Práctica 1 FisiologíaDocument17 pagesSeminario Práctica 1 FisiologíaReyna PriscilaNo ratings yet
- Química Orgánica - Acidos carboxílicos y derivadosDocument31 pagesQuímica Orgánica - Acidos carboxílicos y derivadosPedro Gerardo Trejo Flores50% (2)
- Cuestionario Previo Curvas Calibracion 35407Document1 pageCuestionario Previo Curvas Calibracion 35407Abdiel QuiyuchNo ratings yet
- Clase 1 2019IIDocument59 pagesClase 1 2019IIKatty Julieth Rangel GutierrezNo ratings yet
- Sesión 21. EstequiometríaDocument2 pagesSesión 21. EstequiometríaLorena García AvelinoNo ratings yet
- Previo 4Document4 pagesPrevio 4Marco GonzalezNo ratings yet
- Analitica EjerciciosDocument4 pagesAnalitica EjerciciosJuan GutierrezNo ratings yet
- Fundamentos para Manejo Del PotenciometroDocument10 pagesFundamentos para Manejo Del PotenciometroMisael Serrano HernandezNo ratings yet
- Catalisis Como Pilar Fundamental en Quimica VerdeDocument13 pagesCatalisis Como Pilar Fundamental en Quimica Verdeleonard1613LSNo ratings yet
- Validación de hierro en aguaDocument5 pagesValidación de hierro en aguaJhoam S CorreaNo ratings yet
- Practica 12 de ProceosDocument11 pagesPractica 12 de ProceosJose Antonio Martinez MorenoNo ratings yet
- Cálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaFrom EverandCálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaRating: 5 out of 5 stars5/5 (1)
- Reacciones de Oxido ReducciónDocument9 pagesReacciones de Oxido ReducciónÁngel BravoNo ratings yet
- Unidad 3. Metodos de Administracion de La EnergiaDocument28 pagesUnidad 3. Metodos de Administracion de La EnergiaGar AraNo ratings yet
- Estructuras de Lewis GuiaDocument6 pagesEstructuras de Lewis Guiaprofe_astrid_alvarezNo ratings yet
- Actividad 2.Document4 pagesActividad 2.Gar AraNo ratings yet
- Actividad 3 Ramirez 8 E11Document7 pagesActividad 3 Ramirez 8 E11Gar AraNo ratings yet
- Plan - Mejora - Continua - Tesoem - 2019-2 - Versión - 2Document11 pagesPlan - Mejora - Continua - Tesoem - 2019-2 - Versión - 2Gar AraNo ratings yet
- Actividad 3 Medina 8e11Document2 pagesActividad 3 Medina 8e11Gar AraNo ratings yet
- Temas Selectos BioprocesosDocument9 pagesTemas Selectos BioprocesosGar AraNo ratings yet
- Unidad 3. Enlaces QuimicosDocument38 pagesUnidad 3. Enlaces QuimicosGar AraNo ratings yet
- 1.7 Metodos de Separacion de MezclasDocument6 pages1.7 Metodos de Separacion de MezclasGar AraNo ratings yet
- Actividad 2.Document4 pagesActividad 2.Gar AraNo ratings yet
- Unidad 1. La AtmosferaDocument72 pagesUnidad 1. La AtmosferaGar AraNo ratings yet
- Aplicación de La Química en La Vida CotidianaDocument13 pagesAplicación de La Química en La Vida CotidianaGar AraNo ratings yet
- Practica 1. Reacciones de CarbohidratosDocument10 pagesPractica 1. Reacciones de CarbohidratosGar AraNo ratings yet
- Actividad4 Santiago8e11sysDocument6 pagesActividad4 Santiago8e11sysGar AraNo ratings yet
- Unidad 2. Bioenergetica Reacciones AcopladasDocument2 pagesUnidad 2. Bioenergetica Reacciones AcopladasGar AraNo ratings yet
- Bioquímica manualDocument95 pagesBioquímica manualGar AraNo ratings yet
- Problemario Cinetica EnzimaticaDocument2 pagesProblemario Cinetica EnzimaticaGar AraNo ratings yet
- METAB-INTRO-ENZIMAS-REACCIONESDocument23 pagesMETAB-INTRO-ENZIMAS-REACCIONESGar AraNo ratings yet
- Nomenclatura Química Orgánica-2012Document14 pagesNomenclatura Química Orgánica-2012Daniela TerrazasNo ratings yet
- Química vida cotidianaDocument13 pagesQuímica vida cotidianaGar AraNo ratings yet
- Unidad 4. Evaluacion de La ExposicionDocument24 pagesUnidad 4. Evaluacion de La ExposicionGar AraNo ratings yet
- Unidad 5. Equilibrio QuimicoDocument17 pagesUnidad 5. Equilibrio QuimicoGar AraNo ratings yet
- Unidad 1. Introduccion A La MicrobiologiaDocument37 pagesUnidad 1. Introduccion A La MicrobiologiaGar AraNo ratings yet
- Unidad 4. EstequiometriaDocument29 pagesUnidad 4. EstequiometriaGar Ara100% (1)
- Evaluacion de RiesgoDocument6 pagesEvaluacion de RiesgoGar AraNo ratings yet
- Conferencia de Cambio ClimaticoDocument28 pagesConferencia de Cambio ClimaticoGar AraNo ratings yet
- Conferencia de Cambio ClimaticoDocument28 pagesConferencia de Cambio ClimaticoGar AraNo ratings yet
- NMX Aa 042 Scfi 2015 PDFDocument29 pagesNMX Aa 042 Scfi 2015 PDFLuis MuñozNo ratings yet
- Unidad 4. Evaluacion de La ExposicionDocument25 pagesUnidad 4. Evaluacion de La ExposicionGar AraNo ratings yet
- Unidad 2. FarmacocineticaDocument29 pagesUnidad 2. FarmacocineticaGar AraNo ratings yet
- Manual Ud 3. Evaluación NutricionalDocument11 pagesManual Ud 3. Evaluación NutricionalPachi BertaNo ratings yet
- Ciclo de Krebs NuevoDocument33 pagesCiclo de Krebs NuevoJoel PMNo ratings yet
- 7 EnzimasDocument75 pages7 EnzimasMaritza Michelle Hernández Camacho100% (1)
- Definicion Tecnologias EmergentesDocument6 pagesDefinicion Tecnologias EmergentesAlexander Lopez Villanueva100% (1)
- Respiración Aerobia y AnaerobiaDocument19 pagesRespiración Aerobia y AnaerobiaEnrique0% (2)
- Solicitudes 2015Document23 pagesSolicitudes 2015Peter ParkerNo ratings yet
- Sustancias HumicasDocument6 pagesSustancias HumicasAntonio HigueraNo ratings yet
- La CélulaDocument27 pagesLa Célulamon3letNo ratings yet
- Acidos NucleicosDocument17 pagesAcidos NucleicosIsaac GómezNo ratings yet
- Ayurveda DoshasDocument87 pagesAyurveda DoshasShantBir Singh83% (6)
- El Citocromo P450Document12 pagesEl Citocromo P450Aspasia de MiletusNo ratings yet
- EXPO Respiración AerobicaDocument18 pagesEXPO Respiración AerobicaVANIA ALEXA COTRINA ESTEVESNo ratings yet
- 09Document146 pages09api-3779707No ratings yet
- GUÍA N°17 Biología 1° Medio Profesora Sussy SaavedraDocument2 pagesGUÍA N°17 Biología 1° Medio Profesora Sussy SaavedraMaria Paola RodríguezNo ratings yet
- El Alcohol y Sus ConsecuenciasDocument22 pagesEl Alcohol y Sus ConsecuenciasDelamanchaFilmsNo ratings yet
- Fisiología VegetalDocument804 pagesFisiología VegetalMercedes Martínez Villagómez100% (2)
- BIOCONCRETODocument12 pagesBIOCONCRETOIsrael mmNo ratings yet
- Nutrición DiferencialDocument160 pagesNutrición Diferencialjhoni caur100% (7)
- Mapa Conceptual Respiracion Aerobia y AnaerobiaDocument1 pageMapa Conceptual Respiracion Aerobia y AnaerobiaThor Moreno67% (3)
- Módulo V - Valoración Del Estado Nutricional Del DeportistaDocument31 pagesMódulo V - Valoración Del Estado Nutricional Del DeportistaAldair Barreto100% (2)
- Tarea 3Document5 pagesTarea 3VICKYNo ratings yet
- Taller Aguacate Guarne 20190831 SELECTO PDFDocument44 pagesTaller Aguacate Guarne 20190831 SELECTO PDFGiovani MoraNo ratings yet
- Informe Laboratorio 1 - BioquímicaDocument13 pagesInforme Laboratorio 1 - BioquímicaMaría JoséNo ratings yet
- HIDRATOS DE CARBONO - Función Durante El Ejercicio - © 2003 Edgar Lopategui CorsinoDocument15 pagesHIDRATOS DE CARBONO - Función Durante El Ejercicio - © 2003 Edgar Lopategui CorsinoElkin Uhia ToncelNo ratings yet
- Glucolisis y GluconeogenesisDocument6 pagesGlucolisis y GluconeogenesisMaria Jose Lopeez0% (1)
- Sistema NESDocument5 pagesSistema NESsandra30No ratings yet
- Semiologia Higado Vias BiliaresDocument82 pagesSemiologia Higado Vias BiliaresAlexis Barrientos Quichua100% (1)
- Guía de Estudio EXCRECIÓN 7° 2020 PDFDocument4 pagesGuía de Estudio EXCRECIÓN 7° 2020 PDFmariangel narvaez perezNo ratings yet
- Metabolismo Del AzufreDocument6 pagesMetabolismo Del AzufreRafael Mendoza RodriguezNo ratings yet
- Lab BactolacilusDocument4 pagesLab BactolacilusJuliana AtehortuaNo ratings yet