Professional Documents
Culture Documents
T2 S201
Uploaded by
Anonymous 73gEYyEtLOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
T2 S201
Uploaded by
Anonymous 73gEYyEtLCopyright:
Available Formats
Squence 2
Titrage des ions chlorure
Sance 1
Thme 2
Dans la sance 2 de la squence 1, nous nous sommes intresss la mesure de la concentration des ions chlorures. Nous avons conclu que la
mthode la plus rapide pour dterminer la concentration tait une mesure conductimtrique. Cependant, cette mthode peut avoir ses limites
et nous obliger nous rabattre sur lautre mthode voque (que vous avez d trouver sur internet) : la mthode de Mohr. Elle est notamment
utilise pour dterminer la concentration en ions chlorure dans une eau de consommation.
1.
Informations sur les ions chlorures [Documents]
Document 1 : Lgislation franaise
Larrt du 6 fvrier 2007, publi au Journal officiel de la Rpublique franaise, fixe la concentration maximale en ions chlorures des eaux
destines la consommation humaine 250 mg.L-1.
Document 2 : Composition de leau de St-Yorre
Composition moyenne en mg/L
Bicarbonates : 4368
Sodium : 1708
Chlorures : 322
Potassium : 132
Sulfates : 174
Calcium : 90
Fluorures : 1
Magnsium : 11
Minralisation totale, extrait sec 180 C : 4774 mg/L pH : 6,6
Document 3 : Liste des solutions et couleur des prcipits
Solution de chromate de potassium 1,0.10-2 mol.L-1 : 2 K+(aq) + CrO42-(aq)
Solution de chromate de potassium 5,0.10-2 mol.L-1 : 2 K+(aq) + CrO42-(aq)
Solution de nitrate dargent 1,0.10-2 mol.L-1 : Ag+(aq) + NO3-(aq)
Solution de chlorure de sodium 1,0.10-2 mol.L-1 : Ag+(aq) + NO3-(aq)
Deux prcipits seront observs : le chromate dargent (rouge) et le chlorure dargent (blanc).
2.
Dcouverte de la mthode de Mohr [AE 30 min]
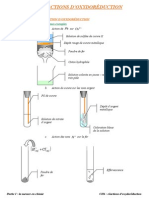
Exprience 1 :
Prendre deux tubes essai. Dans le premier, introduire 1,0 mL de chromate de potassium et dans le second, 1,0 mL de chlorure de
sodium.
Dans chaque tube ajouter quelques gouttes de la solution de nitrate dargent.
Exprience 2 :
Dans un tube essai, introduire 1,0 mL de chromate de potassium et 1,0 mL de chlorure de sodium. Ajouter quelques gouttes de la
solution de nitrate dargent.
Continuez ensuite en ajouter jusqu observer un changement.
2.1. Pour chaque exprience, schmatisez lexprience et notez vos observations.
2.2. Ecrire les quations des ractions qui se produisent dans les tubes de lexprience 1.
2.3. Quel est le prcipit dont la formation est favorise ? Justifier.
2.4. Quel est le prcipit le plus soluble dans leau ?
Exprience 3 :
Dans un premier bcher, introduire un volume V = 5,0 mL de la solution de chlorure de sodium et un volume V = 4,0 mL de la solution
de nitrate dargent.
Dans un second bcher, introduire un volume V = 5,0 mL de la solution de chlorure de sodium et un volume V = 4,0 mL de la solution
de nitrate dargent.
Dans chaque bcher, verser un volume V = 0,5 mL de la solution de chromate de potassium. Agiter.
2.5. Noter vos observations.
2.6. Calculer pour chaque bcher, la quantit initiale dions chlorures et la quantit initiale dions argents.
2.7. Quel est le ractif limitant dans chaque exprience ?
2.8. Les deux bchers avaient-ils un aspect diffrent avant lajout des ions chromates ?
2.9. Justifier lutilisation dions chromates comme indicateur de fin de raction lors de la raction entre les ions chlorure et les ions argents.
3.
Titrage dune eau [AE 1h]
3.1. Leau de St-Yorre [45 min]
3.1. A partir des rsultats prcdentes, proposer un protocole exprimental accompagn dun schma pour dterminer la concentration en
ions chlorures dune eau de St-Yorre. On utilisera une solution de chromate de potassium de concentration 0,050 mol.L-1 et la solution de
nitrate dargent prcdente.
3.2. Aprs accord du professeur, effectuer le titrage et noter la valeur du volume vers lquivalence.
3.3. Ecrire la raction de ce titrage.
3.4. Dterminer la concentration en ions chlorure dans leau de St-Yorre.
3.5. Calculer la concentration massique des ions chlorure.
3.6. En mettant en commun les rsultats des 7 groupes de la classe, calculer la moyenne de la concentration massique, son cart type et
lincertitude associe pour un niveau de confiance de 95%. Vous prsenterez le rsultat sous forme dun encadrement.
3.7. Cette eau respecte-t-elle le critre de consommation ?
3.8. Recherche internet : Dans quelles conditions peut-on consommer cette eau sans risque ?
3.2. Leau du robinet [15 min]
3.9. Dterminer la concentration massique dune eau de robinet. On prendra 100 mL deau pour le titrage.
4. Dosage spectrophotomtrique des ions nitrates [RP A rendre pour la semaine prochaine]
Donne : masse molaire du sulfate de cuivre pentahydrat : 249,68 g/mol.
Questions prliminaires :
- Quelle est lquation de la raction entre le cuivre et les ions nitrates ?
- A lquilibre, quelle est la relation entre les ions nitrates et les ions cuivres II ? (Tableau davancement)
You might also like
- TP Titrage Ions Chlorure Par MohrDocument3 pagesTP Titrage Ions Chlorure Par MohrNarimene Ch100% (2)
- TS Spe Chimie TP 8 Dosage Ions Chlorures Par La Methode de Mohr EleveDocument2 pagesTS Spe Chimie TP 8 Dosage Ions Chlorures Par La Methode de Mohr Elevechabi khaoulaNo ratings yet
- TPN°: 01. Dosage Des Ions Chlorure Par La Méthode de Mohr. (Dosage Par Précipitation) But Du TPDocument2 pagesTPN°: 01. Dosage Des Ions Chlorure Par La Méthode de Mohr. (Dosage Par Précipitation) But Du TPdehbimalaksymNo ratings yet
- 174241Document9 pages174241Sitta LedantiNo ratings yet
- Spe - Methode de MohrDocument4 pagesSpe - Methode de MohrAbdou aziz fallNo ratings yet
- Cours - Chimie - Solubilité Et Précipitation Des Électrolytes - 3ème Informatique (2017-2018) MR Hedfi KhemaisDocument3 pagesCours - Chimie - Solubilité Et Précipitation Des Électrolytes - 3ème Informatique (2017-2018) MR Hedfi KhemaisBAATOUT OUMAIMANo ratings yet
- Stage de Fin DDocument20 pagesStage de Fin DAyour Wazal TouaziNo ratings yet
- TP1 Facteurs Cinétiques-1Document3 pagesTP1 Facteurs Cinétiques-1Ach WakNo ratings yet
- TD03Document2 pagesTD03chouroukbelkacemi236No ratings yet
- Eau de JavelDocument7 pagesEau de JavelHenadi GhomrianeNo ratings yet
- TP Cinetique Et CatalyseDocument9 pagesTP Cinetique Et CatalyseGrairiNo ratings yet
- Exos AvancementDocument2 pagesExos AvancementPhysique MehdaouiNo ratings yet
- TP 1Document5 pagesTP 1alainNo ratings yet
- Activité Chapitre 4 Chimie Facteurs Cinétiques Et de LDocument3 pagesActivité Chapitre 4 Chimie Facteurs Cinétiques Et de LMalia TATENo ratings yet
- 1L Exercice Type Bac Eaux MineralesDocument3 pages1L Exercice Type Bac Eaux MineralesجعدبندرهمNo ratings yet
- TPC1-1Spe-Sujet-Autour Du Volume MolaireDocument3 pagesTPC1-1Spe-Sujet-Autour Du Volume MolairemhaouekNo ratings yet
- Dosage Du SelDocument5 pagesDosage Du SelKonan Richard Kouassi100% (2)
- TP 1Document6 pagesTP 1Anacleto AlfredoNo ratings yet
- TRAVAUX PRATIQUES - MasterS3E - 2019.version - Finale PDFDocument10 pagesTRAVAUX PRATIQUES - MasterS3E - 2019.version - Finale PDFYouSsef EchafaiNo ratings yet
- Fiche de TD N°1Document5 pagesFiche de TD N°1Paola DjeugaNo ratings yet
- TP Chlorure SerumDocument4 pagesTP Chlorure SerumyayaNo ratings yet
- TP Dosage Des Chlorures D'un Marais SalantDocument4 pagesTP Dosage Des Chlorures D'un Marais SalantkawterNo ratings yet
- L3 TAA Toutes Les Series TD TABCorrigésDocument27 pagesL3 TAA Toutes Les Series TD TABCorrigésIbtissam HmNo ratings yet
- tp23 Dosage Serum PhyDocument2 pagestp23 Dosage Serum PhyRATIARIVELO Mamy FrédéricNo ratings yet
- 2013 CtresEtrangers Exo2 Sujet Esters 8ptsDocument4 pages2013 CtresEtrangers Exo2 Sujet Esters 8ptsHaman Bello OumarouNo ratings yet
- UAA6 - Cinétique - Corrigé Des ExercicesDocument6 pagesUAA6 - Cinétique - Corrigé Des ExercicesThomas CocoNo ratings yet
- TP 05Document6 pagesTP 05aminatouat381No ratings yet
- T2 S201 CorrectionDocument2 pagesT2 S201 CorrectionAnonymous 73gEYyEtLNo ratings yet
- Chimie Des Solutions Fiche TD N1 PDFDocument2 pagesChimie Des Solutions Fiche TD N1 PDFleilalargate_378092967% (3)
- Exercice Revision Chimie PDFDocument4 pagesExercice Revision Chimie PDFAsmaaNo ratings yet
- Correction TP Olympiades Nitrates Dans EauDocument8 pagesCorrection TP Olympiades Nitrates Dans EausmiraniabderrahmenNo ratings yet
- 2 Ex ch5Document2 pages2 Ex ch5Le dab Des îlesNo ratings yet
- Gros Labo 1 en 4Document14 pagesGros Labo 1 en 4Afaf AchkanouNo ratings yet
- Serie 2Document1 pageSerie 2adamboumergoudNo ratings yet
- Caractéristique Du Sable FiltrantDocument14 pagesCaractéristique Du Sable FiltrantBENSLIMANEOTHMANENo ratings yet
- Compte Rendu Du TP N°1cinitique Chimique Et Catalyse: Facteurs Cinétique Et CatalyseDocument8 pagesCompte Rendu Du TP N°1cinitique Chimique Et Catalyse: Facteurs Cinétique Et CatalyseHadil Guimer50% (4)
- RECUEIL d'EXERCICES CORRIGesDocument46 pagesRECUEIL d'EXERCICES CORRIGesKeryl Crawford100% (1)
- Exercice Sur La CinétiqueDocument3 pagesExercice Sur La CinétiqueGuyleneNo ratings yet
- Colle 14 ExercicesDocument5 pagesColle 14 ExercicesLOUEMBET BourgetNo ratings yet
- Analyse Physico-Chimique D'eau D'irrigationDocument7 pagesAnalyse Physico-Chimique D'eau D'irrigationf.ezzahraeadnaniNo ratings yet
- Eaux MineralesDocument3 pagesEaux MineralesKFJDONo ratings yet
- 2006 09 National Exo1 Sujet pHPoisson 6 5ptsDocument5 pages2006 09 National Exo1 Sujet pHPoisson 6 5ptsla physique selon le programme FrançaisNo ratings yet
- Travaux Dirigés - Procédé Oxydatif - UKDocument6 pagesTravaux Dirigés - Procédé Oxydatif - UKTaki EddineNo ratings yet
- 1spe TP17 Dissolution Puis Dilution Especes IoniquesDocument4 pages1spe TP17 Dissolution Puis Dilution Especes IoniquesUlysse HubertNo ratings yet
- Exercices, Suivi D'une Transformation Chimique, ChtoukaphysiqueDocument1 pageExercices, Suivi D'une Transformation Chimique, ChtoukaphysiqueToki MimiNo ratings yet
- Ouvrir SA Chap1 ConductimétrieDocument44 pagesOuvrir SA Chap1 ConductimétrieLo Ana100% (1)
- Planche 3è PCTDocument41 pagesPlanche 3è PCTdupontvania822No ratings yet
- TP ChimieDocument12 pagesTP Chimieامير فردوس100% (1)
- TP Lampe A LaveDocument2 pagesTP Lampe A LaveRAZA LUCNo ratings yet
- Fascicule TP SMC3 - Version Covid 2020-21Document22 pagesFascicule TP SMC3 - Version Covid 2020-21Hamza FaFouriNo ratings yet
- TP 1 Analyse en Ligne m2Document9 pagesTP 1 Analyse en Ligne m2mouhamedakid1998No ratings yet
- PC GENE SUJET 041 Exo2 Chi PiscineClBeerDocument6 pagesPC GENE SUJET 041 Exo2 Chi PiscineClBeerElias AthanassiadisNo ratings yet
- TP08-dosage CL Conduct-WolhardDocument1 pageTP08-dosage CL Conduct-WolhardAbdou aziz fallNo ratings yet
- Adnani SolDocument7 pagesAdnani Solf.ezzahraeadnaniNo ratings yet
- Séri La Mole AlmouwtnaDocument2 pagesSéri La Mole AlmouwtnanadaelhaousNo ratings yet
- Nom: Prenom:: Exercice 1: HPLCDocument9 pagesNom: Prenom:: Exercice 1: HPLCdamienbh2907No ratings yet
- Exercices 3, Réaction Doxydo-Reduction, ChtoukaphysiqueDocument1 pageExercices 3, Réaction Doxydo-Reduction, Chtoukaphysiquekhalifa El harfiNo ratings yet
- Équilibres en solution: Les Grands Articles d'UniversalisFrom EverandÉquilibres en solution: Les Grands Articles d'UniversalisNo ratings yet
- Applications de la spectrophotomérie en phytochimie: sciencesFrom EverandApplications de la spectrophotomérie en phytochimie: sciencesNo ratings yet
- 490 VentilationBatimentsHabitation PDFDocument222 pages490 VentilationBatimentsHabitation PDFHassan OriafraNo ratings yet
- 6148 Cours Pompe ChaleurDocument54 pages6148 Cours Pompe ChaleurAnonymous 73gEYyEtLNo ratings yet
- TD Optique CoherenteDocument13 pagesTD Optique CoherenteAnonymous 73gEYyEtLNo ratings yet
- Variateurs de Vitesse - de La Régulation Cascade À La Commande Vectorielle PSIMDocument55 pagesVariateurs de Vitesse - de La Régulation Cascade À La Commande Vectorielle PSIMBALLOUK Soufiane100% (4)
- Calcul Bassin Et Piscine, Piscines, Eau, Evaporation, Déshumidification, Convection, Rayonnement, PychrométriqueDocument9 pagesCalcul Bassin Et Piscine, Piscines, Eau, Evaporation, Déshumidification, Convection, Rayonnement, PychrométriqueAnonymous 73gEYyEtLNo ratings yet
- Mecanique Des FluidesDocument22 pagesMecanique Des Fluidesprimou100% (4)
- Caract Eau PDFDocument2 pagesCaract Eau PDFAnonymous 73gEYyEtLNo ratings yet
- Chambre Froide NégativeDocument4 pagesChambre Froide NégativeAnonymous 73gEYyEtLNo ratings yet
- Acoustique Industrielle - Bruiteurs (01db)Document39 pagesAcoustique Industrielle - Bruiteurs (01db)orfea19No ratings yet
- Methode BINDocument18 pagesMethode BINhanane maria100% (1)
- Acoustique AerauliqueDocument33 pagesAcoustique AerauliqueAnonymous 73gEYyEtLNo ratings yet
- Pourquoi Les Présidents Américains Sont-Ils Élus Par Les Grands Électeurs - Bully PulpitDocument4 pagesPourquoi Les Présidents Américains Sont-Ils Élus Par Les Grands Électeurs - Bully PulpitAnonymous 73gEYyEtLNo ratings yet
- T2 S202Document3 pagesT2 S202Anonymous 73gEYyEtLNo ratings yet
- T2 S201 CorrectionDocument2 pagesT2 S201 CorrectionAnonymous 73gEYyEtLNo ratings yet
- 04 VanneDeServiceDocument1 page04 VanneDeServiceAnonymous 73gEYyEtLNo ratings yet
- 1-Realiser Une Installation de Ventilation Performante - 3Document1 page1-Realiser Une Installation de Ventilation Performante - 3Anonymous 73gEYyEtLNo ratings yet
- I) Le Choix: Conversion Des Pouce / Millimètres en Pouce en MM 1/4 3/8 9,52 1/2 12,7 5/8 15,9 3/4 19Document6 pagesI) Le Choix: Conversion Des Pouce / Millimètres en Pouce en MM 1/4 3/8 9,52 1/2 12,7 5/8 15,9 3/4 19HoussemTunisinoNo ratings yet
- 07 RelationPressionTemperatureDocument2 pages07 RelationPressionTemperatureAnonymous 73gEYyEtLNo ratings yet
- 06 ComposantPrincipauxDocument1 page06 ComposantPrincipauxAnonymous 73gEYyEtLNo ratings yet
- 03 ManifoldDocument2 pages03 ManifoldAnonymous 73gEYyEtLNo ratings yet
- 01 NotionsBasesDocument18 pages01 NotionsBasesAnonymous 73gEYyEtLNo ratings yet
- 03 ManifoldDocument2 pages03 ManifoldAnonymous 73gEYyEtLNo ratings yet
- 12 AutreComposantsDocument4 pages12 AutreComposantsAnonymous 73gEYyEtLNo ratings yet
- White Paper FR PDFDocument15 pagesWhite Paper FR PDFKarima Ait BeroualNo ratings yet
- Programme Pédagogique Socle Commun 4 Semestre: Domaine Sciences Et Technologies Filière: Génie Des ProcédésDocument32 pagesProgramme Pédagogique Socle Commun 4 Semestre: Domaine Sciences Et Technologies Filière: Génie Des ProcédésAnonymous 73gEYyEtLNo ratings yet
- Aec Eec11 MecbatimentDocument3 pagesAec Eec11 MecbatimentAnonymous 73gEYyEtLNo ratings yet
- Cours de Technique de CommunicationDocument54 pagesCours de Technique de CommunicationidazmNo ratings yet
- A5 VentilationDocument31 pagesA5 VentilationcoscosceneraNo ratings yet
- Af 842Document3 pagesAf 842Anonymous 73gEYyEtLNo ratings yet
- Acide SulfuriqueDocument13 pagesAcide SulfuriquechristopheNo ratings yet
- Révision D'Une Eie Typique Pour Un Projet Minier: 3.1 Evaluation Du Résumé ExécutifDocument22 pagesRévision D'Une Eie Typique Pour Un Projet Minier: 3.1 Evaluation Du Résumé ExécutifRogger Julca GonzaNo ratings yet
- EDM-CHAP2 Éléments D'assemblagesDocument19 pagesEDM-CHAP2 Éléments D'assemblagesFa TehNo ratings yet
- Chimie de MateriauxDocument2 pagesChimie de MateriauxDelphine KukumsNo ratings yet
- RAPPORT SARAH MASENGO BooooooooooooooooooooonDocument34 pagesRAPPORT SARAH MASENGO Booooooooooooooooooooonamitthai MasengoNo ratings yet
- Cps Orphelinat 1Document15 pagesCps Orphelinat 1laila.mghairat321No ratings yet
- Les MortiersDocument4 pagesLes MortiersFousseyni CisseNo ratings yet
- Spit - Fixation MecaniqueDocument27 pagesSpit - Fixation MecaniqueMaxime LebrumanNo ratings yet
- 06 - Reactions D OxydoreductionDocument3 pages06 - Reactions D OxydoreductionionelbudNo ratings yet
- DCE - Château D'eau MétalliqueDocument2 pagesDCE - Château D'eau MétalliqueAsma Farah100% (12)
- Science 2prep t1 FDocument149 pagesScience 2prep t1 FHassan RashadNo ratings yet
- Durete TPDocument5 pagesDurete TPLhou AmhaouchNo ratings yet
- Corespondente Stas DinDocument13 pagesCorespondente Stas DinDaria MarianNo ratings yet
- Inventaire Des Ressources Minières de La République D'Haïti (Nord Est)Document38 pagesInventaire Des Ressources Minières de La République D'Haïti (Nord Est)Orlando AurélienNo ratings yet
- Isolation 1Document37 pagesIsolation 1Rami RamiNo ratings yet
- Derouillage Par ElectrolyseDocument26 pagesDerouillage Par ElectrolyseJoseNo ratings yet
- Eurocode 5 BASE DE DONNEESDocument10 pagesEurocode 5 BASE DE DONNEEScabreraNo ratings yet
- Guide de Preparation de SurfaceDocument1 pageGuide de Preparation de SurfaceRaymond LalumiereNo ratings yet
- Gîtologie - Géologie Minère - P1 - CHP1-1-2Document46 pagesGîtologie - Géologie Minère - P1 - CHP1-1-2Idrissa Soumaila100% (2)
- PresentaDocument15 pagesPresentaqaadilNo ratings yet
- 2017 WALTER Fraises À ChanfreinerDocument15 pages2017 WALTER Fraises À ChanfreinerDPO PRNo ratings yet
- Béton - Sétra - Historique Des Armatures Du Béton Armé PDFDocument9 pagesBéton - Sétra - Historique Des Armatures Du Béton Armé PDFRomain CosentinoNo ratings yet
- Correspondance Norme Din Iso Nfen Nfe BV Ldoc36 1Document9 pagesCorrespondance Norme Din Iso Nfen Nfe BV Ldoc36 1ناريمان ابو السعودNo ratings yet
- MC1 - 06 Métallurgie Générale Et Choix Des MatériauxDocument221 pagesMC1 - 06 Métallurgie Générale Et Choix Des Matériauxsaigon80% (5)
- TP3 Roches Sedimentaires RedDocument27 pagesTP3 Roches Sedimentaires RedAloumi HichamNo ratings yet
- Feuillard31 EmboutissageDocument6 pagesFeuillard31 EmboutissagemohamedNo ratings yet
- TPCHIM310BDocument8 pagesTPCHIM310BNadège ReyNo ratings yet
- Dubois FRDocument2 pagesDubois FRfun factNo ratings yet
- Rapport de StageDocument35 pagesRapport de Stagesafaa zeganNo ratings yet
- Catalogue Mobilier Outdoor Roland VlaemynckDocument236 pagesCatalogue Mobilier Outdoor Roland VlaemynckVlaemynck_FranceNo ratings yet