Professional Documents
Culture Documents
Parcial Solucion
Uploaded by
darkwolf1003Original Description:
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Parcial Solucion
Uploaded by
darkwolf1003Copyright:
Available Formats
Pregunta N3:
A) Se sabe, que un solvente prtico es capaz de solvatar cationes y
aniones puestos que ambos polos de su dipolo estn fcilmente
disponibles. Mientras que un solvente aprtico el oxgeno que es el polo
negativo del dipolo, est disponible para solvatar una carga positiva. Sin
embargo el polo positivo del solvente, que es el carbono en este caso,
queda oculto e impedido por el oxgeno y por los grupos alquilo
voluminosos. El polo positivo del solvente entonces no ser capaz de
acercarse al ion negativo y solvatarlo. Por esta razn, los solventes
polares aprticos son capaces de solvatar solo las cargas positivas o
cationes.
De lo dicho arriba, indique de la lista de solventes mostrados cuales son
prtico y aprticos.
Solucin:
Solvente
Agua
cido frmico
Dimetilsulfoxido
Dimetilformamida
Acetonitrilo
Metanol
Hexametilfosforamida
Etanol
Acetona
cido actico
Frmula
H2O
HCOOH
CH3SOCH3
HCON(CH3)2
CH3CN
CH3OH
((CH3)2N)3PO
CH3CH2OH
CH3COCH3
CH3COOH
Cte. Dielctrica
78.5
59.0
49.0
36.7
36.2
32.6
30.0
24.0
20.7
6.0
Tipo Polar
Prtico
Prtico
Aprtico
Aprtico
Aprtico
Prtico
Aprtico
Prtico
Aprtico
Prtico
B) Indique las estructuras ms estables usando el concepto de carga
formal.
I) H2S2O7
Carga Formal de los elementos del compuesto
C.F de H: 1-0-1= 0(2)= 0
C.F de S: 6-0-4= 2(2)= 4
C.F de O: 6-4-2= 0(3)= 0
C.F de O: 6-6-1= -1(4)= -4
C.F del compuesto= 4-4= 0
El compuesto H2S2O7 es estable pues su carga formal es cero.
II) H3AsO5
Carga Formal de los elementos del compuesto:
C.F de H: 1-0-1= 0(3)= 0
C.F de As: 5-2-3= 0
C.F de O: 6-4-2= 0(5)= 0
C.F del compuesto= 0
El compuesto H3AsO5 es estable pues su carga formal es cero.
C) Indique el orden de crecimiento de su presin de vapor en neohexileno,
n-hexileno e isohexileno.
Isohexileno
Neohexileno
n-hexileno
Presin de Vapor
Pregunta N4:
Para determinar la formula emprica y molecular de un compuesto orgnico, 1gr
de muestra se someti a una combustin completa adicionndole CuO(s),
luego de la combustin se obtuvo 0.559gr de H2O (l) y el CO2 producido
reacciono con Ca(OH)2 y se obtuvo 3.7gr de precipitado blanco, en otro anlisis
0.5gr del compuesto orgnico reaccion con Na y luego de otros tratamientos,
se obtuvo 1.53gr de precipitado negro Ag 2S.
Adems una solucin de 2gr del compuesto en 50gr de H 2O (l) tiene una
presin de vapor de
17,423 Torr a 20C. Presin de vapor de agua a 20C= 17.5 Torr.
Solucin:
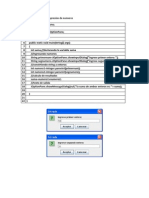
*Hallando la masa de Hidrgeno y Carbono en 1gr de muestra:
0.559gr
18gr/mol (H2O)
100gr/mol (CaCO3)
Masa de H
2gr/mol
3.7gr
(H)
Masa de C
Masa de H= (2)*(0.559)/18= 0.062 gr.
12gr/mol
Masa de C= 0.444 gr.
*Hallando la masa de Azufre en 0.5gr de muestra:
1.53gr
248gr/mol
Masa de S
32gr/mol
(Ag2S)
(S)
Masa de S= (32)*(1.53)/248= 0.1974gr.
0.19741gr. de S
0.5gr de muestra
Masa de S
1gr de muestra
Masa de S en 1 gr de muestra= 0.3948gr.
*Hallando la masa de Oxigeno en 1 gr de muestra:
Masa de O en 1gr de muestra= 1gr-0.3948gr-0.444gr-0.062gr=0.09906gr.
C
0.444gr
H
0.062gr.
S
0.3948gr.
O
0.09906gr.
(C)
12gr/mol
1gr/mol
0.036mol
0.062mol 0.012mol
0.006mol
0.006mol
0.006mol 0.006mol
0.006mol
10
32gr/mol
16gr/mol
(entre el menor)
Formula Emprica= C6H10S2O
*Hallando la Formula Molecular:
Pv (Agua en la solucin a 20C)= Xi(AGUA) * Pv(Agua a 20C)
17.423 Torr =
(50gr)/ (18gr/mol)
* 17.5Torr
(50gr)/ (18gr/mol)+(2gr)/()
= 162.9gr/mol
Formula Molecular= C6H10S2O
You might also like
- Informe de Practica Aldehidos y CetonasDocument18 pagesInforme de Practica Aldehidos y Cetonasroyser avellaneda alarconNo ratings yet
- Quimica 2Document3 pagesQuimica 2luz stella Delgado PicoNo ratings yet
- AlquinosDocument9 pagesAlquinosCarol Rubi MolinaNo ratings yet
- Guia de Práctica Virtual 01 Reconocimiento de C, H, O, N, S, XDocument16 pagesGuia de Práctica Virtual 01 Reconocimiento de C, H, O, N, S, Xjorge severinoNo ratings yet
- Alcoholes 123Document10 pagesAlcoholes 123Joy Way Quispe QuintanaNo ratings yet
- Informe N 06 y N 07 - Laboratorio (Quimica Organica) - Andres AlamaDocument18 pagesInforme N 06 y N 07 - Laboratorio (Quimica Organica) - Andres AlamaAndrésEduardoAlamaGuerreroNo ratings yet
- Analisis Elemental Quimica InorganicaDocument11 pagesAnalisis Elemental Quimica InorganicaCANAL DE ING. ELECTRONICA UNJFSCNo ratings yet
- Prácticas Qoiii 2017 II 59Document30 pagesPrácticas Qoiii 2017 II 59pdivadpNo ratings yet
- OBJETIVOSDocument8 pagesOBJETIVOSYAGNER BELTRAN MEDINA TINOCONo ratings yet
- Informe N 04 y N 05 - Laboratorio (Quimica Organica) - Andres AlamaDocument18 pagesInforme N 04 y N 05 - Laboratorio (Quimica Organica) - Andres AlamaAndrésEduardoAlamaGuerreroNo ratings yet
- Analisis Elemental123Document11 pagesAnalisis Elemental123Alexander ColqeNo ratings yet
- Practica No.5. Aldehídos y CetonasDocument9 pagesPractica No.5. Aldehídos y CetonasElaine LaraNo ratings yet
- Trabajo de Organica N 1Document14 pagesTrabajo de Organica N 1JorgeAlayoGironNo ratings yet
- Respuestas de La Prueba de QuimicaDocument11 pagesRespuestas de La Prueba de Quimicajhonny zambranoNo ratings yet
- Analisis Elemental123Document12 pagesAnalisis Elemental123Alexander ColqeNo ratings yet
- Practica AldehídosDocument8 pagesPractica AldehídosLi ArrataNo ratings yet
- Informe de Haluros de AlquiloDocument11 pagesInforme de Haluros de AlquiloJulissa OréNo ratings yet
- Reacciones QuimicasDocument11 pagesReacciones QuimicassidergioNo ratings yet
- HGJGHJGHJHJGGDocument14 pagesHGJGHJGHJHJGGLIZBETH AGUILARNo ratings yet
- Análisis de Resultados Prácticas 4, 5 y 6. Peña T. Jose Luis, Portillo V. Juan Carlos, Quiros C. María Camila. Química Orgánica. Grupo 1Document13 pagesAnálisis de Resultados Prácticas 4, 5 y 6. Peña T. Jose Luis, Portillo V. Juan Carlos, Quiros C. María Camila. Química Orgánica. Grupo 1Juan Carlos Portillo VillarruelNo ratings yet
- Aldehido, Cetona y Acidos CarboxílosDocument10 pagesAldehido, Cetona y Acidos CarboxílosWilsonC.CastilloNo ratings yet
- Preparación de Cloruro de HexaminocobaltoDocument7 pagesPreparación de Cloruro de HexaminocobaltoDome VásconezNo ratings yet
- Practica #1. Orgánica AmbientalDocument11 pagesPractica #1. Orgánica AmbientalYelitsa Naomi Flores YajahuancaNo ratings yet
- Obtención de Un Alqueno A Partir de La Deshidratación de Un Alcohol y Reacciones de HidrocarburosDocument11 pagesObtención de Un Alqueno A Partir de La Deshidratación de Un Alcohol y Reacciones de HidrocarburosMichelle Granados JohansenNo ratings yet
- Informe de Aldehídos y CetonasDocument4 pagesInforme de Aldehídos y CetonasDenis Enit Uribe Pulgarin0% (1)
- Haluros Organicos 2Document4 pagesHaluros Organicos 2mary lisNo ratings yet
- Propiedades de Lo Compuestos OrganicosDocument20 pagesPropiedades de Lo Compuestos OrganicosMadeley Viera Avila90% (10)
- Informe 3 Organica IIDocument22 pagesInforme 3 Organica IIJean Carlo Pizarro100% (1)
- Informe 5 Hidrocarburos OrganicaDocument10 pagesInforme 5 Hidrocarburos OrganicaDey Calcina86% (7)
- Alcoholes y CetonasDocument6 pagesAlcoholes y CetonasĄbner DiazNo ratings yet
- Laboratorio N°3Document14 pagesLaboratorio N°3Dasha GalánNo ratings yet
- Cuestionario Laboratorio 2Document7 pagesCuestionario Laboratorio 2Noelia Alondra MartinezNo ratings yet
- Aldehidos y CetonasDocument19 pagesAldehidos y Cetonasricardo lopezNo ratings yet
- Alcoholes y FenolesDocument14 pagesAlcoholes y Fenolesbryanmateo50% (2)
- Aldehidos y CetonasDocument19 pagesAldehidos y CetonasSuyey Valerio Claudio0% (1)
- Reacciones y EstequiometriaDocument4 pagesReacciones y EstequiometriaJessica VargasNo ratings yet
- Practica #4 Hidrocarburos Saturados Alcanos y AlquiloDocument10 pagesPractica #4 Hidrocarburos Saturados Alcanos y AlquiloFranck PhoccoNo ratings yet
- HidrocarburosDocument19 pagesHidrocarburosJefferson Josue Escobedo Flores100% (1)
- Alcohol EsDocument6 pagesAlcohol EsEliana picoNo ratings yet
- ALCOHOLESDocument26 pagesALCOHOLESPaul Paz Cieza100% (3)
- Analisis Elemental123Document13 pagesAnalisis Elemental123Alexander Colque TorresNo ratings yet
- Práctica 8Document10 pagesPráctica 8Jose angelNo ratings yet
- Reporte #10 Carbono y SilicioDocument15 pagesReporte #10 Carbono y SilicioALEJANDRA LUCERO MEJ�A CRUZNo ratings yet
- Alcoholes Informe "VISITEN MI BLOG ALLÍ ESTOY SUBIENDO NUEVOS ARCHIVOS Http://quimicofiq - Blogspot.com/"Document10 pagesAlcoholes Informe "VISITEN MI BLOG ALLÍ ESTOY SUBIENDO NUEVOS ARCHIVOS Http://quimicofiq - Blogspot.com/"denis100% (52)
- Informe de Laboratorio Nro 6Document15 pagesInforme de Laboratorio Nro 6AlbertoLaraNo ratings yet
- Practica Quimica Sobre Balanceo de EcuacionesDocument7 pagesPractica Quimica Sobre Balanceo de EcuacionesGabriela Torres HerreraNo ratings yet
- Informe 6Document6 pagesInforme 6daniellgb96No ratings yet
- QuimicaDocument20 pagesQuimicaHector BarbachanNo ratings yet
- Informe de ReaccionesDocument13 pagesInforme de ReaccionesJose Luis Gonzales Medrano100% (1)
- Propiedades de Lo Compuestos OrganicosDocument20 pagesPropiedades de Lo Compuestos OrganicosRoxio Stefany Caasanova AlegriaNo ratings yet
- PreguntasicfesdequmicaDocument80 pagesPreguntasicfesdequmicaArturo TurizoNo ratings yet
- Practica Nº 07organicaDocument7 pagesPractica Nº 07organicaEnrique JenyNo ratings yet
- Práctica 2 - Reacciones de Aldehídos y CetonasDocument9 pagesPráctica 2 - Reacciones de Aldehídos y CetonasYekiita Quintero100% (1)
- PRACTICA N°5 Determinción de Aldehidos y Cetonas Lab QMC Org IIDocument10 pagesPRACTICA N°5 Determinción de Aldehidos y Cetonas Lab QMC Org IIFabiola Pacheco CamargoNo ratings yet
- Experimento Nº11Document7 pagesExperimento Nº11Orlando SamudioNo ratings yet
- Aldehidos y SetonasDocument4 pagesAldehidos y SetonasRosario CastroNo ratings yet
- Rporte 10 OrganicaDocument11 pagesRporte 10 OrganicaLizette AngelNo ratings yet
- Practica 6 CuestionarioDocument3 pagesPractica 6 CuestionarioMikaela RivasNo ratings yet
- Proyecto 1Document2 pagesProyecto 1darkwolf1003No ratings yet
- Reglamento Matricula 20181Document23 pagesReglamento Matricula 20181Miguel TineoNo ratings yet
- Pararrayos y Benjamin FranklinDocument1 pagePararrayos y Benjamin Franklindarkwolf1003No ratings yet
- Labo 2-Electronica de PotenciaDocument13 pagesLabo 2-Electronica de Potenciadarkwolf1003No ratings yet
- Tema 1-Primer PrincipiookDocument32 pagesTema 1-Primer PrincipiookMiguel FinoNo ratings yet
- LaplaceDocument8 pagesLaplacedarkwolf1003No ratings yet
- 3 ErrorDocument36 pages3 Errordarkwolf1003No ratings yet
- Numeros PrimosDocument2 pagesNumeros Primosdarkwolf1003No ratings yet
- 1 Quincena 1Document16 pages1 Quincena 1Daisy Alejandra Muñoz SilvaNo ratings yet
- Unidad1 Conjunto NumericoDocument24 pagesUnidad1 Conjunto NumericoBrenda GarcíaNo ratings yet
- Indice Recurrente AltaneroDocument19 pagesIndice Recurrente Altanerodarkwolf1003No ratings yet
- Problema de PrograDocument2 pagesProblema de Progradarkwolf1003No ratings yet
- Ayuda s7 200Document57 pagesAyuda s7 200Elvis ErikNo ratings yet
- Manual Deep FreezeDocument24 pagesManual Deep Freezemarcos_apablaza6205No ratings yet
- CARATULADocument1 pageCARATULAdarkwolf1003No ratings yet
- Nucleo e ImagenDocument17 pagesNucleo e ImagenPaul Huayta RojasNo ratings yet
- Ee341 SilabusDocument3 pagesEe341 Silabusdarkwolf1003No ratings yet
- Tutorial PC Simu, s7-200 y Microwin BymarshallDocument8 pagesTutorial PC Simu, s7-200 y Microwin BymarshallfenixflyNo ratings yet
- IntsupDocument7 pagesIntsupdarkwolf1003No ratings yet
- Valores y Vectores Propios DiagonalizacionDocument17 pagesValores y Vectores Propios Diagonalizaciondarkwolf1003No ratings yet
- Lab 1JOptionPane Lectura e Impresion Ejerccio ResueltoDocument4 pagesLab 1JOptionPane Lectura e Impresion Ejerccio ResueltoDavidGarciaNo ratings yet
- Normalizacion PDFDocument54 pagesNormalizacion PDFGino Acero SalinasNo ratings yet
- MAPA2012 Version Final Rev03 PDFDocument2 pagesMAPA2012 Version Final Rev03 PDFYael BalvinNo ratings yet
- 2 Trabajo de ParraDocument8 pages2 Trabajo de Parradarkwolf1003No ratings yet
- Conceptos y Ejercicios Acido - BaseDocument32 pagesConceptos y Ejercicios Acido - BaseJavier Mercado DiazNo ratings yet
- Reacciones QuimicaDocument39 pagesReacciones Quimicadarkwolf1003No ratings yet
- Quimica IDocument23 pagesQuimica Idarkwolf1003No ratings yet
- Ejercicios Resueltos Con PseintDocument10 pagesEjercicios Resueltos Con Pseintapi-373574971% (41)
- Formato de DiagramaDocument1 pageFormato de Diagramadarkwolf1003No ratings yet
- Salud Reproductiva Marco TeoricoDocument19 pagesSalud Reproductiva Marco Teoricokeyo318No ratings yet
- Patologias Hombro Con SemiologiaDocument25 pagesPatologias Hombro Con Semiologiadaniel QuinteroNo ratings yet
- La Cosmetica Infantil y AplicacionDocument6 pagesLa Cosmetica Infantil y AplicacionSarah MorganNo ratings yet
- DisertacionDocument2 pagesDisertacionCarolina VillagránNo ratings yet
- 1 Academia A La Que Corresponde La Unidad de AprendizajeDocument15 pages1 Academia A La Que Corresponde La Unidad de AprendizajeAlberto GalarzaNo ratings yet
- El Menalocito en El VitíligoDocument10 pagesEl Menalocito en El VitíligoKarim AlvarezNo ratings yet
- PROBLEMAS. LizDocument4 pagesPROBLEMAS. LizLizzi Torralba100% (1)
- Presentacion Final de Monografia Cultivo de CañaDocument62 pagesPresentacion Final de Monografia Cultivo de CañaDaiana SolizNo ratings yet
- MicrobiologíaDocument7 pagesMicrobiologíaGreisy HurtadoNo ratings yet
- AGUAYMANTODocument4 pagesAGUAYMANTONicky Xikitho KevinnNo ratings yet
- Morin, Edgar 1971 La Revolucion de Los SabiosDocument13 pagesMorin, Edgar 1971 La Revolucion de Los Sabiosgoyo2kNo ratings yet
- Degradacion de ProteinasDocument8 pagesDegradacion de ProteinasGuido Gomez AlarconNo ratings yet
- Rabietas InfantilesDocument79 pagesRabietas InfantilesCarlos Gutierrez100% (2)
- Sesion 14 Guia de Practica Biologia. (Anny - Yuleysi)Document6 pagesSesion 14 Guia de Practica Biologia. (Anny - Yuleysi)YULEYSI PAOLITA GONZALES LEONNo ratings yet
- Apilados Maiz 2018Document70 pagesApilados Maiz 2018Robert Allen Yañez CastilloNo ratings yet
- La Familia Del OesteDocument23 pagesLa Familia Del OesteEvelyn FloresNo ratings yet
- Libro EspañolDocument26 pagesLibro EspañolERIKA DAFNA DURAND FERNANDEZNo ratings yet
- CB31-28 Cadenas y Tramas Alimentarias. Ciclos Biogeoquímicos 2015Document16 pagesCB31-28 Cadenas y Tramas Alimentarias. Ciclos Biogeoquímicos 2015VICENTE NORAMBUENANo ratings yet
- Cartas A LucilioDocument11 pagesCartas A LuciliogabrielaNo ratings yet
- Ciclo Del CarbonoDocument2 pagesCiclo Del CarbonoJose Francisco Briceño LanzNo ratings yet
- Tema 1 - El SueloDocument5 pagesTema 1 - El Sueloams93aNo ratings yet
- Densidad ResumenDocument2 pagesDensidad ResumenPedro Ignacio Acuña VeraNo ratings yet
- Enfermedades Cardiovasculares: IntegrantesDocument24 pagesEnfermedades Cardiovasculares: IntegrantesTORRES AGUADO JorgeNo ratings yet
- Fitoterapia en GanaderiaDocument30 pagesFitoterapia en GanaderiaCarla SeguelNo ratings yet
- Las Regiones Naturales de CentroamericaDocument4 pagesLas Regiones Naturales de CentroamericaXtrem Net81% (16)
- Categoría de Aprendizaje Parte 1Document5 pagesCategoría de Aprendizaje Parte 1DjHebri Controlando La ZonaNo ratings yet
- Principales CoenzimasDocument12 pagesPrincipales CoenzimasCarlos Aarón Ortega100% (1)
- AllportDocument3 pagesAllportAngelica RodriguezNo ratings yet
- Clase Progresiva y Especialidades de Aventureros 2016Document23 pagesClase Progresiva y Especialidades de Aventureros 2016Gmm Cañas100% (1)
- Hija de La NocheDocument6 pagesHija de La Nochemayao.fluixaNo ratings yet