Professional Documents
Culture Documents
Manual de Organica Ia
Uploaded by
Esly Grettel MuñozCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Manual de Organica Ia
Uploaded by
Esly Grettel MuñozCopyright:
Available Formats
MANUAL DE FUNDAMENTOS DE
QUIMICA ORGANICA
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
PRACTICA No. 1
CONOCIMIENTO DEL MATERIAL DE LABORATORIO
OBJETIVO:
El alumno identificar el material ms frecuente utilizado en el Laboratorio de Qumica, as
como explicar el uso de cada uno de ellos.
PRELABORATORIO:
Qu materiales conoces de un laboratorio?
Investiga los materiales ms utilizados en el laboratorio de qumica orgnica.
Investiga los materiales de los que estn hechos los materiales de laboratorios y porque
se usan dichos materiales para su elaboracin.
GENERALIDADES:
El laboratorio escolar es uno de los lugares ms importantes de la escuela, ya que en l se
realizan experimentos para descubrir y elaborar sus propios conocimientos, de acuerdo
con el mtodo cientfico.
La familiarizacin del estudiante con los equipos, materiales, sustancias qumicas y
aparatos sencillos de uso constante en el Laboratorio, es uno de los objetivos ms
importantes para que adquiera habilidad en el desarrollo de las siguientes prcticas,
permitiendo que sea capaz de seleccionarlos y usarlos adecuadamente. Es esencial
conocer el nombre y uso de los elementos que constituyen el equipo de laboratorio, as
como los cuidados que deber proporcionar a cada uno de ellos para su conservacin.
Para que las prcticas planeadas sean debidamente realizadas, se debe contar con cierto
tipo de materiales que pueden ser de vidrio, porcelana y metal, los materiales ms
utilizados y sus funciones ms comunes en cuanto al:
Vidrio
a)
Tubo de ensaye: contener lquidos y hacer reacciones a pequea escala.
b)
Vidrio de reloj: calentar slidos y cristalizar ciertas sustancias.
c)
Matraz de Erlenmeyer: contener, calentar y mezclar sustancias.
d)
Matraz aforado: preparar soluciones y diluciones a un vol. determinado.
e)
Vaso de precipitados: contenedor de lquidos.
f)
Agitador: revolver o mezclar sustancias.
g)
Probeta: medir volmenes con menor precisin que las pipetas.
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
h)
Pipeta: medir lquidos con bastante precisin.
i)
Bureta: verter cantidades variables de lquido.
j)
Embudo de separacin: separar lquidos de diferentes densidades.
k)
Cristalizador: cristalizar sustancias y contenerlas.
Con respecto a la porcelana son:
a)
Crisol: contener sustancias a muy altas temperaturas.
b)
Mortero con pistilo: moler o machacar sustancias slidas.
Con respecto al metal son:
a)
Mechero de Bunsen: calentar o esterilizar muestras.
b)
Soporte universal: realizar montajes y obtener sistemas de medicin.
c)
Trpode: apoyar la tela metlica para calentar sustancias.
d)
Gradilla: sostener y almacenar tubos de ensayo.
e)
Tela metlica: sostener los matraces que van a ser calentados.
f)
Pinzas de Mohr: fijar tubos de ensayo para calentarlos.
g)
Pinzas metlicas: sujetar cosas.
h)
Anillo de hierro: sostener la tela metlica.
i)
Balanza: pesar sustancias.
METODOLOGIA:
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Con ayuda del maestro identificar el material y equipo de uso general,
explicando la utilizacin de los mismos.
El material de laboratorio
El material de un laboratorio de Qumica se puede clasificar atendiendo al uso a que est
destinado, si bien existe un material de mltiples usos que se clasifica segn de que est
hecho.
Material para pesar
Para pesar los slidos es necesario disponer de esptula (1), vidrio de reloj (2) y balanza
(3):
Material para medir volmenes
Para medir el volumen de un lquido, dependiendo de la cantidad y exactitud que se
necesite se pueden utilizar:
Pipetas: Pueden ser graduadas (4) o aforadas (5). Las primeras permiten tomar una
cantidad cualquiera, por ejemplo 5,4 ml, mientras que las aforadas slo permiten tomar
una cantidad determinada: 10, 20, 50 ml.
Probetas (6): Para cantidades mayores pudiendo variar su capacidad: 10, 100, 1000 ml.
Segn su capacidad, as ser su graduacin: Las de 10 ml estn graduadas de 0,5 en 0,5
ml.; las de 100 ml estn graduadas de 2 en 2 ml. Y las de 1000 ml lo estn de 20 en 20 ml.
Bureta (7): Una vez llena sirve para verter una cantidad exacta de lquido al abrir la llave
inferior (hasta 0,1 ml)
Matraz aforado (8): Al preparar una disolucin se necesita una gran precisin en la medida
final del volumen, por lo que se utiliza un matraz aforado, en cuyo cuello tiene una marca y
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
para realizar el enrase correcto hay que hacer coincidir la marca con la tangente
del lquido. Los matraces aforados ms usuales son de 100, 500 y 1000 ml.
Material para filtraciones y separaciones
Para separar un slido de un lquido se puede filtrar con embudo de cristal (9) provisto de
un filtro de pliegues (10), si lo que interesa es el lquido. Si lo que interesa es el slido se
utiliza un embudo Bchner (11) o embudo de placa que mediante un tapn de goma se
ajusta a un kitasato (12) que a su vez se conecta a travs de una tubera de goma con un
trompa de vaco (13).
Para separar lquidos inmiscibles se utiliza un embudo de decantacin (14).
Material para destilacin y calentamiento a reflujo.
Para destilar se necesita un soporte con aro (15) sobre el que se coloca una rejilla de
asbesto (16). En la parte inferior se sita el mechero Bunsen (17) y sobre ella el matraz de
destilacin (18), al que se acopla mediante tapones de goma un termmetro (19) y un
refrigerante recto de Liebig, (20). A este ltimo se le puede acoplar una alargadera (21).
4
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Si se trata de un calentamiento a reflujo se utiliza el soporte con aro y rejilla, as
como el mechero Bunsen. Sobre la rejilla se coloca un matraz de fondo redondo (22) al
que se le puede acoplar un refrigerante de bolas (23) o de serpentn (24).
Existe una gran variedad de material de laboratorio cuya funcin no es tan especfica
como los descritos anteriormente y por lo tanto sirven para funciones diversas. Se pueden
clasificar atendiendo al material del que estn fabricados.
Material de vidrio
Varillas de vidrio (hueca y maciza) (25), fabricadas en vidrio plastificado, que se pueden
moldear por calentamiento y sirven para realizar conducciones rectas y curvas, capilares y
agitadores.
Vaso de precipitados (26) y matraz erlenmeyer (27). La graduacin que presentan es a
ttulo indicativo, no debiendo nunca enrasar un lquido en dichos aparatos. Las
capacidades ms comunes en ambos son de 100, 250, 500 y 1000 ml.
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Otro material diverso de vidrio es:
Cristalizador (28), tubo de ensayo (29), placa de vidrio (30), cuentagotas (31). La cpsula
Petri (32) sirve para guardar pequeas cantidades de lquido o slido dentro de un
desecador (33) con disco de porcelana (34) en el que se introduce una sustancia
higroscpica, de tal forma que se crea una cmara exenta de humedad. Algunos de los
desecadores llevan un dispositivo por el que se les puede hacer el vaco. El tubo de Thiele
(35) sirve para determinar el punto de fusin de los slidos. Por ltimo existen frascos de
tapn normal (36) o tapn esmerilado (37), as como matraces de fondo plano (38).
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Material de porcelana y arcilla
En este apartado se pueden incluir las cpsulas de porcelana (39) y los crisoles de
porcelana (40) y de arcilla (41). Todos se pueden calentar al fuego directamente o en
horno ya que resisten altas temperaturas.
Material diverso
Entre otros cabe citar: agitador magntico (42), pinzas (43 y 44), doble nuez (45), gradilla
para tubos de ensayo (46) y frasco lavador (47). Los morteros pueden ser de hierro (48),
vidrio (49), porcelana (50) y gata (51).
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
CONCLUSIONES
ACTIVIDAD COMPLEMENTARIA
Dibuja los materiales y los equipos que conociste en este Laboratorio y anota el nombre y
el uso ms frecuente de los aqu dibujados.
NOTA: Usar las hojas necesarias para su descripcin de acuerdo al formato que se
muestra en la siguiente pagina.
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
NOMBRE
DIBUJO
BIBLIOGRAFIA
USO
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
PRCTICA No. 2
ENSAYO PRELIMINAR DE SUSTANCIAS ORGNICAS.
OBJETIVO:
Identificar una sustancia orgnica por medio de un examen preliminar o diagnstico y
utilizar las medidas de seguridad pertinentes.
Adquirir hbitos que le permitan trabajar en equipo, con entusiasmo y de manera
ordenada y pulcra.
PRELABORATORIO
1. Cules son caractersticas ms comunes presentan los compuestos orgnicos?
2. Qu precauciones se deben tener al efectuar la prueba de ignicin y para
percibir el olor de un compuesto orgnico?
3.-Investigue la toxicidad de los reactivos a emplear.
GENERALIDADES:
Ensayos preliminares
Son ensayos sencillos para compuestos que generalmente estn puros y tienen como
propsito diferenciar un compuesto orgnico de uno inorgnico y asociar el compuesto
orgnico con algn grupo funcional presente en su estructura, se pueden clasificar en:
Estado fsico: Se debe observar el estado fsico, slido o lquido. En los slidos se debe
describir la forma cristalina (agujas lminas prismas), distinguir entre un slido amorfo y
uno microcristalino.
Caractersticas Fsicas: observar el color, que puede estar asociado con la presencia de
aromticos o grupos con dobles enlaces altamente conjugados y el olor, por ejemplo,
algunas aminas pueden tener olores desagradables, pero los esteres pueden tener olores
fragantes.
Combustin: El ensayo de combustin se basa en un calentamiento cuidadoso de la
muestra directamente en el mechero y la observacin de la presencia de cenizas, quienes
determinarn si la muestra est formada solamente por CHO y si hay o no presencia de
metales de reaccin cida o bsica a los indicadores
10
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
MATERIAL
REACTIVOS
2 Cpsulas de porcelana pequeas
Muestras problemas
5 Tubos de ensayo de 13x100.
HCl concentrado.
5 Tapones para tubo de ensaye
1 Mechero
1 Tripi
1 Tela de alambre con centro de
asbesto.
2 Pipetas graduadas de 5 ml.
1 Porta-asa.
1 Gradilla
1 Perilla.
PROCEDIMIENTO:
1.- Observar y anotar el estado fsico de cada una de las muestras.
MUESTRA 1:
Observaciones:____________________________________________________________
________________________________________________________________________
_____________________________________________
MUESTRA 2:
Observaciones:____________________________________________________________
________________________________________________________________________
2.- Distinguir el color y olor de cada una de las sustancias dadas.
MUESTRA 1:
Observaciones:____________________________________________________________
________________________________________________________________________
_____________________________________________
MUESTRA 2:
Observaciones:____________________________________________________________
________________________________________________________________________
3.-PRUEBA DE IGNICIN
11
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
a) En una cpsula de porcelana coloque 0.5 g 0.5 ml, de la sustancia en
estudio y aproxime el mechero a la cpsula para observar si la sustancia es
inflamable o no. Si no lo es, caliente la cpsula por la parte inferior, observando la
naturaleza de la flama, el olor desprendido y el del gas producido.
b) Cuando estime que la accin de calor ha terminado, deje enfriar y si existe un
residuo no carbonoso, agregue unos 2 ml de agua destilada y tome la reaccin
cida o alcalina con papel tornasol.
c) Despus agregue unas gotas de HCl y observe si se produce efervescencia,
enseguida haga la prueba de la llama mediante un porta-asa con alambre para
determinar si se encuentra presente algn metal en las muestras orgnicas.
MUESTRA 1:
Observaciones:____________________________________________________________
________________________________________________________________________
_____________________________________________
MUESTRA 2:
Observaciones:____________________________________________________________
________________________________________________________________________
CONCLUSIONES:
ACTIVIDAD COMPLEMENTARIA
1.- Explique a qu se debe el estado fsico, el color y olor de una sustancia?
2.- Qu es un ensayo preliminar?
3.- A qu se llama prueba de ignicin?
4.- Explique qu ventajas tiene la realizacin de la prueba de ignicin?
5.-Describa la importancia de realizar un ensayo preliminar de una
desconocida.
6.- Qu indica la formacin de un residuo carbonoso?
7.- Si la reaccin al papel tornasol es bsica Qu nos indica?
12
sustancia
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
8.- Si el residuo no se disuelve en HCl Qu nos indica?
BIBLIOGRAFIA:
MANEJO DE RESIDUOS:
Colocarlos desechos correspondientes en los frascos etiquetados de la siguiente manera:
Residuos carbonosos (Frasco 1)
Desechos de papel Tornasol (Frasco 2)
Desechos cidos de Ensayo preliminar (Frasco 3)
PRUEBA DE
IGNICIN
RESIDUO NO
CARBONOSO
RESIDUO
CARBONOSO
R1
RES. DE
PAPEL
TORNASOL
RES. NO
CARNONOSO
+ HCl
R2
R3
13
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
PRCTICA No. 3
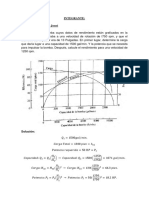
DETERMINACIN DEL PUNTO DE FUSIN
OBJETIVOS
Comprender la relacin existente entre fuerzas intermoleculares y el punto de fusin.
Determinar el punto de fusin de diversos compuestos orgnicos.
Comparar el punto de fusin obtenido experimentalmente con el reportado en la
literatura.
Adquirir la destreza necesaria en el manejo del equipo utilizado para la determinacin
de los puntos de fusin.
PRELABORATORIO
1.- Describa cmo son los puntos de fusin en los compuestos orgnicos?
2.- Qu tipo de bao se debe emplear en esta determinacin? Por qu?
3.-Elabore un diagrama de bloques de la tcnica
4.-Investigue la peligrosidad de las muestras a utilizar.
GENERALIDADES:
El fenmeno de fusin es el paso de una sustancia de estado slido a estado liquido por la
accin del calor, este cambio se lleva acabo a una temperatura determinada, la cual no
experimenta muchas variaciones con los cambios de presin, pero si con la presencia de
impurezas, esto hace que el punto de fusin sea utilizado muy a menudo como criterio de
pureza de un compuesto slido.
Los puntos de fusin de las molculas reflejan hasta cierto punto el tipo de fuerzas
intermoleculares que estn presentes, sin embargo aunque se esperara que los
compuestos donde existen fuerzas de Van der Waals fundiran a temperaturas ms bajas
que aquellos donde existe dipolo- dipolo, hay otros aspectos que tambin se deben
considerar al hacer el anlisis de los puntos de fusin de los compuestos, como por
ejemplo, la simetra de la molcula, ya que entre ms simtrica sea, esta se acomoda
mejor en la red cristalina que crea el cristal haciendo la molcula mas compacta y el punto
de fusin ms elevado.
Cuando un compuesto lquido se deposita en un recipiente abierto, se calienta y se
produce un progresivo aumento de la presin de vapor de dicho lquido; al prolongar su
14
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
calentamiento llega un momento en el cual la presin de vapor del liquido se
hace igual a la presin atmosfrica.
La pureza e identidad de una sustancia orgnica queda establecida cuando sus
constantes fsicas (punto de fusin, punto de ebullicin, peso molecular, densidad, ndice
de refraccin, rotacin ptica, color, espectros de absorcin, etc.) y sus propiedades
qumicas son idnticas con las registradas en la literatura para dicha sustancia. Por ser
fcil determinar correctamente los puntos de fusin y de ebullicin y sobre todo porque son
las constantes que con mas frecuencia se localizan en la bibliografa, su determinacin es
una de las operaciones de rutina en los laboratorios de Qumica Orgnica.
El punto de fusin de una sustancia es la temperatura a la cual, a la presin atmosfrica,
los estados slido y lquido de dicha sustancia se encuentran en equilibrio.
En un slido cristalino las partculas que actan como unidades estructurales -iones o
molculas- se hayan ordenados de algn modo regular y simtrico; hay un arreglo
simtrico que se repite a travs de todo el cristal del compuesto.
Fusin, es el cambio del arreglo ordenado de partculas en el retculo cristalino a uno o
ms desordenado que caracteriza a los lquidos. La fusin se produce cuando se alcanza
una temperatura en la que la energa trmica de las partculas es suficientemente grande
como para vencer las fuerzas intercristalinas que las mantiene en su lugar.
Existen actualmente muchos tipos de aparatos para determinar el punto de fusin. Por
ejemplo, el tubo de Thiele (muestra en capilar) y el aparato de Fisher-Johns (muestra en
cubre-objetos).
f) El aparato de Fisher-Johns consta de una platina calentada mediante una resistencia
elctrica, en la que se coloca la muestra entre dos cubre-objetos redondos ( unos cuantos
cristales en el centro del cubre-objetos). La velocidad de calentamiento se controla con un
restato integrado al aparato y la temperatura de fusin de la sustancia se lee en el
termmetro adosado a dicha platina.
Equipo para la determinacin del Punto de Fusin Bioamerican Bs 448: Es un instrumento
diseado para la determinacin del punto de fusin de slidos de muestras simples o
mezclas hasta una temperatura de 400C.
15
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
MATERIAL
REACTIVOS
2 Morteros con pistilos
1 Termmetro.
2 Vasos de precipitado de 100 ml.
2 Capilares
1 Soporte Universal
1 Anillo metalico
1 Mechero
1 Tela de alambre con asbesto
1 Pinza para termmetro
1 Tramo de tubo de vidrio de 30-50 cm.
2 Ligas.
2 Muestras problemas.
Aceite o glicerol
PROCEDIMIENTO:
Ponga en un vaso de precipitado de 100-150 ml, aproximadamente 60 ml de aceite
mineral o glicerina. Por otro lado se prepara un tubo capilar con las muestras problemas,
de la siguiente forma:
a) Triture la muestra perfectamente en un mortero.
b) Introduzca un poco de la sustancia en un tubo capilar, sellado anteriormente por uno de
sus orificios.
c) Deje caer el capilar con la muestra dentro de un tubo largo de vidrio, con objeto de
forzar el polvo a que se vaya al fondo. Cuando el capilar contenga aproximadamente 1 cm
de muestra, suspenda la operacin.
Una el capilar al termmetro, mediante una liga colocada en la parte superior del mismo.
Cuide que la liga no toque el aceite. Arme el aparato de manera que el termmetro quede
aproximadamente a 1 cm del fondo del recipiente del bao y el volumen de la muestra se
encuentre dentro del bao. Caliente el vaso del bao y observe la temperatura a la cual
empieza a fundirse la muestra, y la temperatura cuando se haya fundido toda la muestra.
Cuando se desconoce el punto de fusin de la muestra se recomienda repetir la
operacin.
Observaciones:____________________________________________________________
________________________________________________________________________
_________________________________________________________________
16
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Cuando se determina un punto de fusin, es muy importante anotar todos los
cambios que sufre la muestra durante el proceso. debe anotarse todo el intervalo de
temperatura en el que transcurre el proceso de reblandecimiento o contraccin. Es un
proceso en el que la muestra se contrae y se separa de las paredes del capilar. Deben
anotarse tambin los cambios de color, as como la temperatura a la que aparezca
cualquier efervescencia o prdida de gas. Se anotara tambin con cuidado la presencia de
cualquier slido residual que permanezca infusible durante el proceso de fusin, y si este
material se descompone y precipita, se evapora, se ennegrece, etc.; el punto de fusin se
anota con una parntesis que indica descomposicin.
ACTIVIDAD COMPLEMENTARIA
1.-Qu equipos a nivel industrial se utilizan para la determinacin del punto de fusin?
2.-Explique qu efecto producir en el punto y en el intervalo de fusin de una muestra lo
siguiente:
a) Empleo de un capilar de paredes muy gruesas.
b) Calentamiento demasiado rpido.
c) Que la muestra rebase el nivel del aceite del bao.
3.-Usando la tabla de los puntos de fusin obtenida en los experimentos grafique la
diferencia entre la referencia y el promedio (ordenada), contra la referencia (abscisa).
17
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
CONCLUSION
BIBLIOGRAFIA
MANEJO DE RESIDUOS
18
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Colocarlos residuos generados en esta prctica de la siguiente forma:
Frasco 1: residuos de capilares
Frasco 2: residuos de aceite.
MANEJO DE RESIDUOS
PUNTO DE
FUSIN
Triturar la
muestra
en un
mortero
Medir 50 ml de
aceite en un vaso
de pp de 100 ml
Poner
muestra en
un capilar
Adherir el capilar
con muestra al
termmetro
Colocar el vaso
con el aceite
sobre el equipo
de
R2
Calentar y observar
la temperatura de
fusin
R1
19
R1: Capilares y
muestra
problema
R2: Aceite
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
PRCTICA No. 4
DETERMINACIN DEL INDICE DE REFRACCION
OBJETIVO
Conocer el manejo del refractmetro de Abbe-Spencer.
Analizar los fundamentos de la refractometra.
Determinar el ndice de refraccin de algunos muestras
PRELABORATORIO
1.
Realizar un diagrama de bloques de la tcnica
2.
Investigar los ndices de refraccin del etanol, acetaldehdo, acetona, cido actico,
ter etlico.
3.
Investigue la peligrosidad de los reactivos a emplear
GENERALIDADES:
El ndice de refraccin (IR) se define como la relacin entre la velocidad de la luz en el
vaco y la velocidad de la luz a travs de una muestra. La velocidad de la luz en un medio
viene determinada por la interaccin de las ondas luminosas con los electrones de los
orbitales enlazantes y no enlazantes de la sustancia, por consiguiente, la velocidad de la
luz a travs del medio estar relacionada con la estructura de la molcula y en particular
con la clase de grupos funcionales que contenga.
El IR ms bajo de un lquido corriente es el agua 1.33. En general, los materiales
orgnicos tienen IRs que caen dentro del intervalo entre 1.3 y 1.6. Algunos valores tpicos
del IR son 1.358 para la acetona, 1.386 para el cido propanoico, 1.446 para el cloroformo
y 1.501 para el benceno.
En general, el IR es exacto por lo menos en dos cifras decimales, y a menudo en tres o
cuatro, por lo que puede ser un excelente criterio para distinguir entre varios compuestos
posibles.
El ndice de refraccin de una sustancia es una propiedad intrnseca como lo es el punto
de ebullicin, pero para determinarlo se requiere un instrumento algo ms complicado.
Es importante sealar que el IR es sensible a la presencia de impurezas.
20
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
El aparato que se emplea para la determinacin del IR se denomina
refractmetro, y consiste en una lmpara de sodio, en bao de temperatura constante y
un sistema ptico. Existen dos clase de refractmetros de uso corriente: uno es el
refractmetro de Fisher, y el otro es de Abbe-Spencer (Fig. 1), y los valores que se
obtienen se encuentran en el intervalo entre 1.3 y 1.7.
MATERIAL
REACTIVOS
Piseta
Refractmetro
Muestras problemas
Etanol al 95%
Agua destilada
Trapo de algodn
TCNICA
l. Se comprueba que en la superficie del prisma no queden residuos de Ia anterior
determinacin y se limpia con un algodn o un tejido suave (un pauelo de celulosa)
primero seco y luego humedecido con etanol del 95 % o bien, metanol o tolueno. En
ningn caso debe emplearse acetona, puesto que sta disolvera el adhesivo que
mantiene los prismas en su lugar.
2 Se deja secar perfectamente el solvente antes del uso. (Nota: Dado que el IR es
sensible a la presencia de pequeas cantidades de impurezas, asegrese que todo el
alcohol se ha evaporado).
3. Se coloca la muestra lquida (Pruebe por separado, con agua. acetona. cloroformo y
benceno ) en el prisma inferior, de modo que toda la anchura del mismo quede cubierta.
Para ello debe usarse un gotero, teniendo cuidado de que el extremo del mismo no entre
en contacto con el prisma, para evitar araazos.
4. Se baja el prisma superior hasta que toque el inferior. El lquido debe formar una capa
ininterrumpida entre ambos prismas.
21
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Ocular
Pantalla
Botn de
encendido
Tornillos de
ajuste
Botones de
seleccin de
operacin
22
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Prisma de refraccin
Muestra
patrn
Prisma de
consumo de
luz
Luz
Superficie
pulida
1.-Se observa en el ocular para enfocar los campos oscuro e iluminado centrados en el
retculo, como en la siguiente figura
6. A la derecha del refractmetro se encuentran los controles de ajuste macro y
micromtrico, para el movimiento de los prismas. Deben ajustarse de modo que a travs
del ocular se observe un semicrculo oscuro y otro iluminado (Fig. 10.3). Cuando estos dos
campos se encuentran en el punto de cruce del retculo se oprime la tecla leer (read) y
en la pantalla aparece el ndice de refraccin de la muestra.
23
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
La lectura se efecta hasta la cuarta cifra decimal y se anota tambin la temperatura.
CONCLUSIN
ACTIVIDAD COMPLEMENTARIA
1.- Investigue los IR de sus muestras en la bibliografa.
2.- Anote las frmulas de los compuestos analizados.
BIBLIOGRAFIA
MANEJO DE RESIDUOS
Los restos de muestra devolverlas al laboratorio.
24
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
PRCTICA No. 5
CLASIFICACION POR SOLUBILIDAD
OBJETIVOS
Determinar la solubilidad de diversos compuestos orgnicos empleando diferentes
solventes.
Analizar la solubilidad de los compuestos orgnicos de acuerdo a las fuerzas
intermoleculares.
Adquirir destreza manual en la determinacin de la solubilidad de compuestos
orgnicos.
Investigar y aplicar medidas de seguridad en la determinacin de la solubilidad de
compuestos orgnicos.
PRELABORATORIO
1.
Qu factores determinan la solubilidad de un compuesto orgnico?
2.
A que se denomina solvatacin?
3.
Investigue las precauciones que se deben guardar, as como la reactividad,
toxicidad, etc. de los reactivos empleados en esta determinacin.
FUNDAMENTO:
Completado el anlisis elemental orgnico, la investigacin del comportamiento de
una sustancia orgnica pura frente a diversos disolventes, limita a un corto nmero, las
funciones o clases a las cuales puede pertenecer la sustancia que se trata de identificar.
La solubilidad de una sustancia en un disolvente puede ser de tres tipos: fsico, intermedio
y de reaccin.
Los disolventes pertenecientes a los dos primeros tipos son disolventes inertes, los
del tercer tipo son disolventes de reaccin.
Reglas de solubilidad:
1.- Entre ms parecida es la estructura de u.na sustancia a la estructura de un disolvente
inerte, mayor es la solubilidad en l. As los hidrocarburos son solubles en derivados
halogenados o viceversa.
2.- Los trminos ascendente de una serie homloga tienden a parecerse en sus
propiedades fsicas, como la solubilidad, a los hidrocarburos de los cuales se derivan.
25
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
3.- Los compuestos de peso molecular elevado, tienen una solubilidad decreciente en los
disolventes inertes.
4.- Los disolventes de reaccin pueden ser cidos, para disolver las bases y alcalinos para
disolver sustancias de propiedades cidas.
5.- Los cidos inorgnicos concentrados pueden disolver compuestos orgnicos inertes
que tengan grupos funcionales que puedan formar sales de oxonio, sulfonio (esteres,
teres, cetonas) o compuestos de adicin (olefinas) o de sustitucin (hidrocarburos
aromticos).
Independientemente de las causas de la disolucin del compuesto que se investiga, se
considera que hay disolucin cuando 0.05 g de la sustancia solida 0.1 ml de la sustancia
lquida forman una fase homognea a la temperatura ambiente con 3 ml del disolvente (1
parte de soluto en 30 partes de disolvente).
Para simplificar la clasificacin e identificacin de los compuestos orgnicos se les puede
agrupar en nueve clases, segn su comportamiento ante siete disolventes, como se puede
apreciar en la siguiente marcha de solubilidad. Cada una de las pruebas se hace con
sustancia pura y una vez que se clasifica se suspende la determinacin de solubilidad.
+ La clase S1, est constituida por compuestos orgnicos de bajo peso molecular,
exceptuando a los hidrocarburos y compuestos halogenados que se encontraran en la
clase I.
+ En la clase S2 se incluyen todas las clases solubles en agua, compuestos
polioxhidrlicos, cidos polibsicos, oxcidos, aminocidos y algunas aminas, amidas y
derivados sulfonados.
+ En la clase B, hay aminas alifticas, alicclicas, algunas aminas aromticas, algunos
compuestos anfotricos e hidracinas, N, N-dialquilamidas.
+ La clase A1, incluye cidos carboxlicos y algunos derivados, algunos fenoles con
sustituyentes negativos del tipo del cido pcrico, nitro, ciano y aminocidos.
+ La clase A2, est formada por compuestos dbilmente cidos tales como cidos
aminosulfnicos, sulfonamidas de aminas primarias, nitroderivados de alcanos y ciclanos,
tanto primarios como secundarios, oximas, enoles, imidas, fenoles, tiofenoles y algunos
mercaptanos.
26
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
+ La clase M. est compuesta por sustancias neutras conteniendo otros
elementos adems de C, H, O y halgenos. Aqu se incluyen: derivados nitrados, amidas,
azo derivados, hidrazo derivados, sulfonas, derivados sulfanlicos de aminas secundarias,
marcaptanos, tioteres, sulfonas, nitrilos, aminas halogenadas.
+ En la clase N1, se catalogan alcoholes, aldehdos, metilcetonas, cetonas alicclicas,
teres con menos de nueve tomos de carbono, acetales, lactonas, anhdridos,
polisacridos.
+ En la clase N2 estn aldehdos, cetonas y steres con ms de nueve tomos de
carbono, quinonas, hidrocarburos no saturados y teres.
+ La clase I. est constituida por hidrocarburos alifticos saturados, hidrocarburos
aromticos, derivados halogenados y steres diarlicos.
Material.
Reactivos.
20 Tubos de ensayo
1 Gradilla
1 Piseta
1 Perilla
1 Pipeta graduada de 5 ml
1 Balanza granataria
5 Tapones para tubos de ensayo.
NaOH al 5%
HCl al 5%
NaHCO3 al 5%
ter isoproplico
H2SO4 y H3 PO4 concs.
Benceno
Alcohol amlico,
Sulfonamida ,
Acido saliclico,
cido oxlico
Sacarosa,
p-Cresol
Acetato de etilo,
cido ctrico
Anilina
PROCEDIMIENTO:
En un tubo de ensayo ponga 0.1gr. del compuesto slido 0.1 ml si el compuesto
es lquidos (2 gotas). Aada en pequeas porciones, 3 ml del disolvente, agitando
fuertemente despus de cada adicin. Durante cada determinacin anote si se desprende
calor, gases, cambios de color, formacin de precipitados, etc.
27
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Una vez clasificado un compuesto en un grupo de solubilidad suspenda la
determinacin. Determine la solubilidad de los siguientes compuestos, anotando cambios
de color, generacin de calor, formacin de precipitados, etc.: a) benceno, b) alcohol
amlico, c) cido saliclico, d) sacarosa, e) acetato de etilo, f) anilina, g) sulfonamida, h)
cido oxlico, i) p-cresol, j) cido ctrico.
Anote los resultados en forma de tabla, indicando con + si es soluble, con - si es
insoluble y +/- si es dudosa la solubilidad del compuesto en estudio.
Nombre
Formula
Acetofenona
C6H5COCH
Agua ter
-
NaOH
-
NaHCO3
-
HCl
-
H2SO4
H3PO4
CLASE
N1
ESQUEMA PARA LA CLASIFICACIN POR SOLUBILIDAD
CONCLUSIN
28
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
ACTIVIDAD COMPLEMENTARIA.
1.-Explicar cul sera la solubilidad del etanol, ter etlico y del acetato de sodio, indicando
su razonamiento.
2.-Explique que es un solvente polar y un no polar.
3.- Qu es un solvente aprtico dipolar?
4.Qu tipo de disolventes favorecen la solvatacin?.
5.-En la industria, en qu podra aplicarse la determinacin de solubilidad?
BIBLIOGRAFA
MANEJO DE RESIDUOS
Tubos con muestra + agua destilada (Frasco 1)
Tubos con muestra + ter etlico (Frasco 2)
Tubos con muestra + Acido clorhdrico (Frasco 3)
Tubos con muestra + Hidrxido de sodio (Frasco 4)
Tubos con muestra + Bicarbonato de sodio (Frasco 5)
Tubos con muestra + Acido sulfrico concentrado (Frasco 6)
Tubos con muestra + Acido fosfrico concentrado (Frasco 7)
Residuos de muestra slida: Entregar al laboratorio en el tubo original
29
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
PRACTICA No 6
IDENTIFICACIN DE GRUPOS FUNCIONALES
OBJETIVO:
Familiarizar al alumno con algunas de las reacciones caractersticas que permiten la
identificacin de ciertos grupos funcionales orgnicos. Tras esta toma inicial de contacto,
se aplicar este conocimiento a la identificacin del tipo de compuesto presente en una
serie de muestras problema, mediante un examen sistemtico de las mismas.
PRELABORATORIO
1.-Defina qu es un grupo funcional?
2.-Investigue las estructuras de las sustancias de la tabla
3.-Investigue la peligrosidad de los reactivos a emplear
GENERALIDADES:
El comportamiento fsico y qumico de una molcula orgnica se debe principalmente a la
presencia en su estructura de uno o varios grupos, funciones o familias qumicas. Los
grupos funcionales son agrupaciones constantes de tomos, en disposicin espacial y
conectividad, que por tal regularidad confieren propiedades fsicas y qumicas muy
similares a las estructuras que las poseen. En qumica orgnica los grupos funcionales
ms importantes son los que se muestran a continuacin:
Grupo
Funcional
Sales
amonio
Fosfonio
Sulfonio
Agrupamiento
caracterstico
Ejemplos
de R4N+
R4P+
R3S+
cido
carboxlico
Anhdrido
R-COOH
steres
R-CO-O-R
(CH3)3NH+
:
trimetilamonio
(C6H5)4PH+
:
trifenilfosfonio
(CH3CH2)3S+
:
trietilsulfonio
CH3COOH : cido actico
R-CO-O-OC-R
CH3CO-O-OCCH3:
anhdrido actico
CH3CO-O-C2H5:acetato
de etilo
30
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Halogenuro
acilo
Amida
Nitrilo
Aldehdo
R-CHO
CH3CO-Cl:cloruro
de
etanoilo
CH3CO-NH2: acetamida
CH3(CH2)2-CN:
butanonitrilo
CH3CH2-CHO: propanal
Cetona
R-CO-R
CH3-CO-CH3: acetona
Alcohol
R-OH
CH3CH2-OH: etanol
Mercaptano
R-SH
CH3CH2-SH: etanotiol
Amina
R-NH2
ter
R-O-R
CH3(CH2)5-NH2:
hexanamina
(CH3CH2)2O: ter etlico
Sulfuro
R-S-R
Alqueno
C=C
(CH3CH2)2S:sulfuro
de
dietilo
CH3CH=CH2: propeno
Alquino
C=C
CH3C=CH: propino
Halogenuro
alquilo
Nitro
Alcano
de R-CO-X
R-CO-NH2
R-CN
de R-X
R-NO2
CH3CH2-Br: bromuro de
etilo
C6H5-NO2: nitrobenceno
C-C
CH3(CH2)6CH3: n-octano
La clasificacin de los productos orgnicos segn los grupos funcionales que contengan,
proviene de un esfuerzo de clasificacin de los mismos, en funcin de la afinidad de sus
propiedades.
As, si por ejemplo, comparamos el amonaco y el conjunto de compuestos orgnicos
conocidos como aminas, resulta que estas ltimas podran ser obtenidas a partir de
amonaco mediante la sucesiva sustitucin de 1, 2 3 de los tres hidrgenos del primero.
Adems, las aminas presentan las propiedades bsicas caractersticas del amoniaco, por
lo que se puede sugerir que son molculas orgnicas de la "clase" del amonaco.
La ventaja que conlleva esta clasificacin es que no es necesario conocer al detalle las
reacciones de cada una de las aminas; basta con estudiarlas como una clase de
compuestos orgnicos caracterizada por las propiedades del grupo amino.
31
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
De esta manera, es posible agrupar los compuestos orgnicos en una serie de
clases, que tengan en comn una agrupacin de tomos - grupo funcional -, a pesar de
que el resto de la molcula sea una cadena hidrocarbonada distinta.
Identificacin de grupos funcionales orgnicos
Esta ser posible en base a una serie de reacciones caractersticas para cada grupo
funcional.
Puede que ms de un grupo funcional de una misma reaccin caracterstica, por lo que
ser necesario aplicar alguna otra ms especfica para discernir entre estos; se dice
entonces que podemos tener una interferencia en la identificacin
La mayora de estos grupos funcionales se presentan en las molculas de origen natural.
Algunas de stas, por ejemplo los halogenuros de acilo, por su reactividad son poco
frecuentes en la naturaleza y se utilizan como intermediarios en sntesis orgnica.
Las propiedades fsicas y qumicas de una molcula sencilla estn determinadas por la
presencia de algunos de estos agrupamientos, pero en la mayora de las molculas ms
tiles, naturales o sintticas existen varios de estos agrupamientos. En tal caso las
propiedades fsicas y qumicas de la molcula son el resultado del comportamiento
combinado y de la distribucin espacial de las funciones qumicas presentes en ella.
Para un profesional de la qumica es muy importante averiguar qu grupos funcionales
posee una molcula, ya que ello depender en ocasiones el poder predecir sus
propiedades o explicar su comportamiento en un proceso qumico o fsico.
32
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Molcula problema
Adicionar el indicador universal
Color rojo
Color amarillo
Acido carboxlico
Color verde o azul
oscuro
Alcano, alqueno, alcohol
Aldehdo o cetona
amina
Adicionar KMnO4 neutro
Caf oscuro
Alqueno o aldehdo
No reacciona
Alcano, alcohol o acetona
Adicionar reactivo de Tollens
Espejo plateado
Aldehdo
No reacciona
Alqueno
Adicionar dinitrofenilhdrazina
No reacciona
Alcano o alcohol
Amarillo-anaranjado
Cetona
Adicionar sodio metlico
Burbujea
Alcohol
No reacciona
Alcano
Ruta recomendada para la clasificacin de una molcula desconocida en un
grupo funcional orgnico
33
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
MATERIAL
REACTIVOS
12 Tubos de ensayo con tapn
2 Vasos de precipitado de 50 mls.
2 Pipetas Pasteur
1 Pipeta graduada de 5 mls.
1 Esptula
1 Gradilla
1 Pizeta
2 Pinzas para tubos
1 perilla
Hexano
Ciclohexeno
Etanol
Acetaldehdo
Acetona
Acido actico
Dietilamina
Sol. de Permanganato de potasio
0.02M
Reactivo de Tollens
Muestra Problema
Indicador universal
Sol. De 2,4-dinitrofenilhidrazina
Sodio metlico.
PROCEDIMIENTO
Se numeran 10 tubos de ensaye pequeos y se colocan en ellos las sustancias en la
cantidad indicada en la tabla siguiente.
Adems de la siguiente lista deben analizarse dos muestras problema.
Tubo No. Sustancia
Volumen/gotas
Acido actico
10
Agua destilada
10
Dietilamina
10
Acetaldehdo o butiraldehdo
10
Ciclohexeno o aguarrs
10
Acetaldehdo o butiraldehdo
Ciclohexeno o aguarrs
Acetona
10
Etanol
20
10
n-Hexano
20
MP
10
34
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Una vez hecho lo anterior, se procede a realizar
indican
las pruebas que a continuacin se
A) Se adicionan 10 gotas de agua destilada a los tubos 1-3, se mezclan perfectamente
y se agrega una gota del indicador universal.
Recurdese que:
Si la disolucin se torna roja, hay un cido carboxlico presente
Si la disolucin se torna azul-verdosa, hay una sustancia bsica presente, muy
probablemente una amina.
Si la disolucin se torna amarillo-verdosa o amarillo-anaranjada, la disolucin es
neutra y puede tratarse de un alcano, un alqueno, un aldehdo, una cetona o un
alcohol. Si este es el caso, proceda a la etapa siguiente.
Observaciones:____________________________________________________________
________________________________________________________________________
________________________________________________________________________
B) Se agregan 10 gotas de agua destilada a 5 gotas de disolucin 0.02M de KMnO 4 a
los tubos 4 y 5. Se agita suavemente cada tubo por aproximadamente 1 minuto.
Qu sucedi?
________________________________________________________________________
_____________________________________________________
Si despus de este tiempo se observa la formacin de un precipitado color caf
(MnO2), se trata de un aldehdo o un alqueno.
Si no ocurre cambio de color y la mezcla permanece de color violeta oscuro,
ello indica que no ocurri reaccin alguna y que se trata de un alcano, un alcohol o una
cetona.
C) Se agregan 2 ml de reactivo de Tollens a los tubos 6 y 7, se agitan suavemente por
dos minutos y se dejan reposar por otros cinco minutos.
Observaciones:____________________________________________________________
________________________________________________________________________
_____________________________________________
35
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Si se observa la formacin de una capa de precipitado, el espejo de plata, se trata
de un aldehdo.
Si no se observa precipitado alguno, se trata de un alqueno.
D) Se agregan 2 ml de solucin de 2,4-dinitrofenildrazina (es txica) al tubo 8, se agita
vigorosamente y se deja reposar por dos minutos. Si no se forma de inmediato un
precipitado, deber de dejarse reposar hasta 15 minutos.
Qu sucedi?
________________________________________________________________________
_____________________________________________________
Si no se observa la formacin de un slido amarillo-anaranjado, la reaccin ha
ocurrido y se trata de una cetona.
Si no se observa precipitado alguno (ignore la turbidez), la reaccin no ha ocurrido y
se trata de un alcano o de un alcohol.
Nota:
a) Lo recomendable es agregar una o dos gotas del aldehdo o la cetona que se va a
estudiar a 2 ml de etanol al 95% y agregar esta mezcla a 3 ml de la disolucin de 2,4dinitrofenilhidrazina.
b) Si se hace reaccionar un aldehdo con 2,4-dinitrofenilhidrazina puede producir una
coloracin amarillo-anaranjado y confundirse con una cetona; sin embargo, puede
distinguirse entre ambos mediante la reaccin del permanganato de potasio.
E) Se agregan a los tubos 9 y 10 una pequea pieza de sodio metlico
(PRECAUCIN: EL SODIO METLICO ES MUY REACTIVO CON EL AGUA).
Agtese suavemente por 15 segundos y obsrvese si ocurre alguna reaccin.
Observaciones:____________________________________________________________
________________________________________________________________________
_____________________________________________
Si el sodio metlico se disuelve y hay burbujeo, se trata de un alcohol.
Si no se observa reaccin alguna, se trata de un alcano.
36
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
F) Se determina qu grupo funcional hay en las muestras MP1 y MP2 siguiendo el
esquema anterior y las etapas A a E, teniendo cuidado en esta ltima etapa, al
trabajar con sodio metlico, no disuelva las sustancias en agua o disolventes
prticos (con hidrgenos liberables), ya que reacciona vigorosamente e incendiarse.
A qu grupo funcional pertenece la muestra problema?
________________________________________________________________________
______________________________________________________
Para concluir sobre el grupo funcional de estas dos especies se pueden realizar otras
pruebas, como la determinacin del punto de fusin, la medicin del ndice de refraccin,
el olor, el color, la espectroscopia IR, UV-visible, etc.
CONCLUSIONES:
ACTIVIDADES COMPLEMENTARIAS
1. La reaccin del sodio metlico con el alcohol es una reaccin especfica para la
identificacin de alcoholes.
2. Qu otra reaccin podra emplear para identificar un alcano.
3. Escriba las reacciones qumicas de los grupos funcionales a analizar.
4. Un alquino se oxida con permanganato de potasio?
5. Si una molcula posee tanto grupos carbonlicos como carboxlicos, puede
utilizarse una fenildrazina para identificarlos? Explique.
6. El vinagre pertenece a la familia o funcin qumica de los:
A) Alcoholes
B) Esteres
C) cidos
D) Aldehdos.
7. El
formol
es
un
compuesto
que
tiene
el
grupo
funcional:
A)Hidroxilo
B)Carbonilo
C)Carboxilo
D)ter
37
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
8. La Formula del grupo carboxilo es:
A)-OH
B)-OC)-COOH
D)-CO9. En que se diferencian un aldehdo y una acetona?
10. Establecer el Producto de oxidacin de un alcohol 1 ario y 2ario
11. Establecer el producto de oxidacin y reduccin de un aldehdo, un cido, una
cetona, un alcohol.
12. Reconocer y dar los productos de una esterificacin y formacin de amidas.
BIBLIOGRAFIA:
MANEJO DE RESIDUOS
Muestras
Indicador
universal
R1
R
2
Permanganato
de potasio
R3
Reactivo de
Tollens
2,4Dinitrofenilhidrazina
Sodio metlico
R
38
R
4
R1: Indicador Universal +
Muestras
R2: Sol de Permanganato
de potasio + Muestras
R3: Reactivo de Tollens +
Muestras
R4:
2,4-
Dinitrofenilhidrazina
Muestras
R5:
Sodio
metlico
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
PRCTICA No 7
EXTRACCION DE GRASAS
OBJETIVOS
Aplicar los fundamentos de enlace qumico para demostrar la similitud de las fuerzas de
atraccin intermoleculares del soluto y del solvente usando la extraccin slido lquido.
Adquirir destreza y habilidad en la separacin y purificacin de compuestos orgnicos
empleando este procedimiento.
Aplicar medidas de seguridad durante el desarrollo de la extraccin slido-lquido.
PRELABORATORIO
1.
Haga un diagrama de bloques de esta tcnica.
2.
Cules son las precauciones que se deben tener en la extraccin slido-lquido?
3.
Qu es el equipo de soxhlet y cules son sus componentes?
4.
Qu aplicacin industrial tiene este proceso?
5.
Qu tiempo se recomienda para hacer una extraccin de grasas?
GENERALIDADES:
La extraccin de grasas es una extraccin slido-lquido, este trmino indica que la
sustancia que se extrae est contenida en un material slido, junto con otros compuestos,
los que debern ser prcticamente insolubles en el disolvente utilizado.
La extraccin de grasas se conoce comnmente con el trmino "extracto etreo" ya que es
extrada usualmente con ter etlico, isoproplico o de petrleo. Incluye adems de los
steres de los cidos grasos con el glicerol y los fosfolpidos, las lecitinas, los esteroles,
las ceras, los cidos grasos libres, los carotenoides, la clorofila y otros pigmentos.
La extraccin Soxhlet es la tcnica de separacin slido-lquido comnmente usada para
la determinacin del contenido graso en muestras de diferente naturaleza. De igual modo,
puede ser usada como tcnica preparativa de muestra como paso previo al anlisis
mediante otra tcnica instrumental, por ejemplo, la extraccin de cidos grasos en
muestras de tocino para su posterior determinacin mediante cromatografa de gases.
Aunque su campo de aplicacin es fundamentalmente el agroalimentario es tambin de
utilidad en el rea medioambiental, as es el mtodo de anlisis recomendado para la
39
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
determinacin del aceite y la grasa total recuperable en aguas de vertidos
industriales permitiendo la determinacin de hidrocarburos relativamente no voltiles,
aceites vegetales, grasas animales, ceras, jabones y compuestos relacionados.
Como ya hemos comentado, el contenido de materia grasa es uno de los parmetros
analticos de inters en los productos destinados a la alimentacin, tanto humana como
animal, y, en consecuencia, su determinacin es muy habitual. El procedimiento para
llevar a cabo su extraccin se basa en la extraccin slido-lquido en continuo, empleando
un disolvente, con posterior evaporacin de ste y pesada final del residuo.
El resultado representa el contenido de sustancias extrables, que mayoritariamente son
grasas, aunque tambin hay otras sustancias como las vitaminas liposolubles y pigmentos
en el caso de su determinacin en alimentos.
La extraccin Soxhlet ha sido (y en muchos casos, continua siendo) el mtodo estndar de
extraccin de muestras slidas ms utilizado desde su diseo en el siglo pasado, y
actualmente, es el principal mtodo de referencia con el que se comparan otros mtodos
de extraccin.
MATERIAL
1 Equipo Soxhlet
1 parrilla
1 cartucho o dedal de papel filtro
1 soporte metlico
2 pinzas para refrigerante
1 vaso de precipitado de 250 ml
1 mortero con pistilo
Conexiones de hule ltex
REACTIVO
ter etlico, de petrleo o hexano
Muestra de cacahuate, nuez ,coco,
pistachos, almendras, calabaza, nuez
de la india, etc.
PROCEDIMIENTO:
Monte el aparato para la extraccin de grasas indicado por el instructor. En la cmara de
extraccin (recipiente B) se coloca un cartucho de papel filtro conteniendo 15 g de semilla
molida rica en grasas y aceites. El matraz A limpio y seco se pesa con anterioridad y se
anota su peso, a este recipiente se le agrega hasta la mitad ter etlico, isoproplico o
cualquier otro solvente que indique el instructor. Por el refrigerante C, se circula agua fra.
40
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
El matraz A se calienta en bao Mara o con una manta de calentamiento o con
una lmpara infrarroja. Al cabo de dos horas suspenda el calentamiento. El calentamiento
debe ser moderado para evitar que se escapen los vapores del disolvente. Destile el ter
en bao Mara hasta que queden 40-45 ml y elimnelo del matraz evaporndolo con
precaucin. Enfrese y psese. Saque el contenido de grasa por diferencia de peso.
Cmo ocurri el proceso de extraccin? explique
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
__________________
CONCLUSIN
41
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
ACTIVIDAD COMPLEMENTARIA
1.
Qu otros tipos de solventes se pueden utilizar para la extraccin de grasas?.
2.
Por qu se debe eliminar el ter con precaucin?
3.
Qu otros ejemplos puede mencionar de extraccin slido-lquido?
4.
Realice los clculos del rendimiento de grasas correspondiente a su muestra
empleada
BIBLIOGRAFIA:
MANEJO DE RESIDUOS: Sern recolectados por el facilitador.
PRCTICA No. 8
ISOMERIA CIS-TRANS (Z - E)
CONVERSION DEL ACIDO MALEICO A ACIDO FUMARICO
OBJETIVOS
Sintetizar cido maleco y cido fumrico
Emplear los fundamentos de estereoisomera en la determinacin de cido maleco y
fumrico
Determinar la isomera configuracional del cido maleco y fumrico.
Identificar los cidos formados.
PRELABORATORIO
1.
Investigue los fundamentos de la isomera geomtrica.
2.
Elabore un diagrama de bloques de la tcnica a emplear.
3.
Investigue la reactividad y toxicidad de los reactivos empleados en esta prctica.
42
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
4.
Investigar las frmulas de los cidos maleico y fumrico.
5.
Investigue los puntos de fusin de los cidos maleico y fumrico.
GENERALIDADES:
En la presente prctica se estudia la reaccin de isomerizacin de cido maleico a cido
fumrico con el fin de determinar, mediante un diseo de experimentos, las condiciones
ptimas de reaccin. La reaccin es catalizada por un cido mineral, en este caso el cido
clorhdrico (ver Figura 1). En dicha figura, se representa la configuracin espacial de los
dos ismeros geomtricos del cido 2-butendioco, los ya mencionados, cidos maleico y
fumrico.
La formula molecular sera la siguiente: C4O4H4 cido maleico (ismero cis) cido
fumrico (ismero trans).
Figura 1. Reaccin de isomerizacin del cido fumrico a cido maleco.
De acuerdo con estas dos estructuras diferentes, estos dos compuestos tienen
propiedades fsicas y qumicas muy diferentes. Mientras que el cido fumrico es un
producto normal del metabolismo, el cido maleco es muy txico. Adems, se sabe
empricamente que el ismero trans (fumrico) tiene el punto de fusin ms elevado,
menor solubilidad y mayor estabilidad (Tabla 1). Estas diferentes propiedades permitirn
conocer la evolucin de la reaccin, ya que debido a su insolubilidad, la mayor parte del
fumrico formado precipita.
Conocidas las concentraciones iniciales de los reactivos se calcular la cantidad de
producto formado (fumrico) y del reactivo sin reaccionar (maleico) con el fin de calcular el
rendimiento de la reaccin. La cantidad de cido fumrico producido se calcula por dos
mtodos distintos.
El primer mtodo consiste en una gravimetra. Mediante centrifugacin y decantacin se
separa el cido fumrico precipitado de la mezcla final. Por diferencia de pesada se
conoce la cantidad de fumrico formado.
43
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Por otro lado, se valora con NaOH la disolucin decantada. Conociendo los
equivalentes de cido maleico y HCl antes de la reaccin y valorando los equivalentes
finales, se obtiene por diferencia el cido fumrico formado.
Tabla 1. Propiedades fsicas y qumicas de los cidos maleco y fumrico.
MATERIAL
4Tubos de ensaye 11 x 75
1 Vaso de precipitado de 50 ml.
1 Equipo de calentamiento
2 Pipetas graduadas de 5 y 10 mls.
1 Piseta
Papel filtro
Agua destilada
REACTIVOS
Anhdrido maleico
HCl concentrado
Sol. de bromo al 1%
Sol. de KMNO4 al 1%
Hielo
Equipo para punto de fusin
Esptula
PROCEDIMIENTO
1.- Tome 2 tubos de ensaye, en el primero agregue 0.5 gr de anhdrido maleco, 0.5 ml de
agua (caliente) y 0.5 ml de HCl conc.
PRECAUCION:
Manejar con cuidado el acido clorhidrico ya que
altamente corrosivo.
En el segundo tubo coloque 0.5 gr de anhdrido maleco junto con 0.5 ml de agua
caliente.
44
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
2. Coloque el primer tubo en un bao mara (vaso de precipitado con agua
destilada) y caliente de forma constante hasta que se forme un precipitado.
3.-Tome el segundo tubo de ensaye y colquelo en un bao de hielo hasta obtener la
formacin de un precipitado.
4.-Una vez que se hayan formados los cristales en cada tubo deposite cada uno en un
vidrio de reloj para que se sequen.
5.-Realice la prueba de punto de fusin tomando una pequea muestra de cada uno de
los precipitados y anote los resultados en la siguiente tabla:
Compuesto
Acido maleco
Acido fumrico
Punto de fusin
PRUEBAS
A) Disuelva unos 10 a 20 mg. De cido maleco y ve si se decolora 1 o 2 gotas de
solucin acuosa de bromo al 1%. Repita la prueba con una solucin al 1% de
permanganato de potasio.
B) Disuelva de 10 a 20 mg de cido fumrico (0.05) gramos y repita las pruebas con
las soluciones de bromo y de permanganato de potasio.
CONCLUSIONES
ACTIVIDAD COMPLEMENTARIA
1.- Defina el concepto de isomera .Describa los tipos de isomera ms frecuentes en
qumica orgnica.
2.- A qu se debe la mayor solubilidad del acido maleico en agua?
3.-Por qu el acido fumrico hierve a mayor temperatura?
4.-Describa el mecanismo de reaccin de la transformacin del acido maleico a fumrico.
5. En la experiencia anterior -El acido clorhdrico como un reactivo o un catalizador?
BIBLIOGRAFIA
MANEJO DE RESIDUOS
45
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
El residuo de acido maleco depositarlo en el frasco 1
El residuo del acido fumrico depositarlo en el frasco 2
Los residuos de las pruebas se almacenan de la siguiente manera:
Acido maleco +
Sol. de bromo al 1%
Sol. de KMNO4 al 1%
Colocar en el frasco 3
Colocar en el frasco 4
Acido fumrico +
Sol. de bromo al 1%
Sol. de KMNO4 al 1%
Colocar en el frasco 5
Colocar en el frasco 6
PRCTICA No. 9
DETERMINACIN DE LA BASICIDAD Y DE LA ACIDEZ EN LOS COMPUESTOS
ORGNICOS
OBJETIVOS
Comprender los conceptos de basicidad y acidez
Entender por qu las aminas presentan carcter bsico, y los cidos, carcter cido.
Analizar que factores hacen variar la acidez y la basicidad
Analizar las reacciones que ponen de manifiesto el carcter bsico de las aminas
primarias, secundarias y terciarias.
Manejar normas de seguridad para determinar el desarrollo de esta tcnica.
PRELABORATORlO
1. Investigar las estructuras de las aminas primarias, secundarias y terciarias.
46
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
2. Investigar las reacciones que se llevan a cabo en la tcnica.
3. Investigar la toxicidad de los reactivos a emplear.
4. Elaborar un diagrama de bloques de la tcnica.
FUNDAMENTO
La metilamina posee propiedades bsicas igual que el amonaco. El centro bsico
lo constituye el par de electrones no compartido del tomo de Nitrgeno; por tanto, el
amonaco y las tres clases de aminas (primarias, secundarias y terciarias) pueden actuar
como donadores de electrones (bases) frente a otros tomos o iones que sean deficientes
en electrones y, en consecuencia, acten como "aceptores de electrones.
Las aminas, en general, son bases orgnicas moderadamente fuertes. Se
comportan como bases ms fuertes que el agua, pero ms dbiles que los iones hidrxido
y alcxido y que los carbaniones. La metilamina disuelta en agua (solucin 1 N) conduce a
una solucin con un pH de 12.3
Una forma conveniente de expresar las basicidades relativas es una cantidad
llamada constante de basicidad, K b. Cuando se disuelve una amina en agua se establece
el siguiente equilibrio;
y la Kb est dada por la expresin:
Kb= [RNH3+] [OH-]
[RNH2 ]
Cuanto ms alto es el valor de K b, mayor es la tendencia de las aminas a aceptar
un protn del agua y, por tanto, mayor ser la concentracin de RNH 3+ y OH- en fa
solucin. Es decir, los valores altos de K b se relacionan con las aminas que son las bases
fuertes; los valores bajos, con las aminas que son bases dbiles.
Las aminas son ms bsicas que los alcoholes, teres, steres, etc., ya que el
nitrgeno es menos electronegativo que el oxgeno y est mejor capacitado para
acomodar la carga positiva del ion. Una amina aliftica es ms bsica que el amonaco,
porque los grupos alquilo liberadores de electrones tienden a dispersar la carga positiva
del ion amonio sustituido, estabilizndolo de una manera imposible para el ion amonio no
sustituido. Las diferencias en basicidad entre aminas alifticas primarias, secundarias y
terciarias se deben a una combinacin de factores polares y de solvatacin.
47
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
Las reacciones siguientes ponen de manifiesto las propiedades bsicas de
la metilamina.
MATERIAL
REACTlVOS
12 Tubos de ensayo de 13X100
3 Agitador
Metilamina, dietilamina. Trietilamina,
amonaco y anilina
1 Pipeta graduada de 5 ml.
HCI concentrado
3 matraces erlenmeyer de 125 ml
Sol. de cloruro frrico al 5%
2 Vidrios de reloj grandes
Papel tornasol rojo.
3 pipetas graduadas de 10 ml
Sol. De Fenolftalena
3 pipetas volumtricas de 1 ml.
1 Perilla
1 Pizeta
PROCEDIMIENTO
1. Comportamiento de la solucin acuosa frente al tornasol: Ponga una gota de la solucin
de metilamina en una tira de papel tornasol rojo. Observe el cambio de color. Repita el
ensayo con la dietilamina, con la trietilamina y con la anilina. Formule las ecuaciones de
la reaccin de las aminas con el agua. Repita el mismo ensayo con soluciones de
cido actico, cido benzoico y cido cloroactico, pero ahora empleando una tira de
papel tornasol azul.
2. Reaccin con cloruro de hidrgeno: Moje una varilla de vidrio con la solucin de
metilamina y acrquela a la boca de un tubo de ensayo que contenga 1 ml de HCI
concentrado. Observe el resultado y formule la reaccin. Repita el ensayo con las otras
tres aminas. Observe y anote las diferencias en cada una de las reacciones.
3. Reaccin con cloruro frrico: Aada solucin de metilamina a 3 ml de la solucin de
cloruro frrico hasta que aparezca un precipitado. Repita la reaccin con la dietilamina,
con la trietilamina, con la anilina y con el amoniaco. Compare las reacciones y formule
las ecuaciones. Este mismo ensayo reptalo con el cido actico, cido benzoico y el
cido cloroactico.
48
INSTITUTO TECNOLGICO DE MINATITLN
DEPARTAMENTO DE QUMICA Y BIOQUMICA
LABORATORIO DE QUMICA ORGNICA
1. Con una solucin de NaOH al 0.1N titule 1 ml de solucin de cada uno de los
cido empleados, utilizando como indicador fenolftalena. Anote sus observaciones
ACTIVIDAD COMPLEMENTARIA
1. Escriba las reacciones que se llevaron a cabo en la tcnica.
2. Podra usar otras substancias, equipo, etc. para determinar la basicidad de las
aminas?
3. Quien tendra mayor carcter bsico entre las aminas, primarias, secundarias y
terciarias?
4. Qu peso de metilamina esta contenido en 1 litro de la solucin 0.10N?
5. Cunto vale aproximadamente el pH a 25C de una solucin de etilamina 0.1 M?
Kb = 5.6 X 10-4
1. Qu es el pKb y para qu se utiliza?
CONCLUSION
BIBLIOGRAFIA
MANEJO DE RESIDUOS
49
You might also like
- Bacterias AnaerobiasDocument27 pagesBacterias AnaerobiasEsly Grettel MuñozNo ratings yet
- 6Document51 pages6Sef VaPeNo ratings yet
- Prueba de biodegradabilidad acelerada para suelos contaminadosDocument1 pagePrueba de biodegradabilidad acelerada para suelos contaminadosEsly Grettel MuñozNo ratings yet
- Residuos Sólidos Urbanos en La ArgentinaDocument7 pagesResiduos Sólidos Urbanos en La ArgentinaEsly Grettel MuñozNo ratings yet
- Prueba de biodegradabilidad acelerada para suelos contaminadosDocument1 pagePrueba de biodegradabilidad acelerada para suelos contaminadosEsly Grettel MuñozNo ratings yet
- Actividad de Lectura Capítulo 7Document9 pagesActividad de Lectura Capítulo 7Eric CabrialesNo ratings yet
- Guia MEC FLUIDOS. Banco de Pruebas en Carabobo..Document23 pagesGuia MEC FLUIDOS. Banco de Pruebas en Carabobo..LeinedRazalasNo ratings yet
- Test de Motores de Corriente ContinuaDocument6 pagesTest de Motores de Corriente ContinuaDAYWERNo ratings yet
- Hiperboloide de Dos HojasDocument7 pagesHiperboloide de Dos HojasAnderson ZambranoNo ratings yet
- Pauli, Hunt y AufbauDocument2 pagesPauli, Hunt y AufbauvictorNo ratings yet
- PRINCIPIOS DEL ELECTROMAGNETISMODocument17 pagesPRINCIPIOS DEL ELECTROMAGNETISMOAna Cristina Jara RodriguezNo ratings yet
- Reporte Laboratorio 1 Electronica 2Document9 pagesReporte Laboratorio 1 Electronica 2Ronny DiazNo ratings yet
- Guía N4 Caja Power Shif Colineal MEDocument16 pagesGuía N4 Caja Power Shif Colineal MELuis Enrique CruzNo ratings yet
- 3 Estructuras de Solidificacion de Los Metales2Document4 pages3 Estructuras de Solidificacion de Los Metales2fany pmNo ratings yet
- Características Físicas y Mecánicas de Las RocasDocument5 pagesCaracterísticas Físicas y Mecánicas de Las RocasLuis Iporre RengifoNo ratings yet
- Curso de Tuberías para Plantas de Proceso - 0207 Conexion A CompresoresDocument37 pagesCurso de Tuberías para Plantas de Proceso - 0207 Conexion A CompresoresChimuelinNo ratings yet
- Lubricantes FluidosDocument10 pagesLubricantes FluidosjoseNo ratings yet
- Presentación Sellos Mecánicos-RuhrpumpenDocument37 pagesPresentación Sellos Mecánicos-RuhrpumpenAllan SeminarioNo ratings yet
- Introduccion Al PandeoDocument3 pagesIntroduccion Al PandeoUriel Cano ColloyNo ratings yet
- NTC1610Document19 pagesNTC1610Charles GuzmanNo ratings yet
- EcuaciónesDocument21 pagesEcuaciónesСистемаNo ratings yet
- Peso específico y absorción del agregado finoDocument5 pagesPeso específico y absorción del agregado finoAriel Nina Choque0% (1)
- 07 Practica 7 Primera Ley de NewtonDocument1 page07 Practica 7 Primera Ley de Newtonnisimilu100% (1)
- Diseño A Cortante de Vigas de Concreto ArmadoDocument20 pagesDiseño A Cortante de Vigas de Concreto Armadoscribenauta100% (6)
- Trabajo de Mecánica de Fluidos. 2017-I PDFDocument7 pagesTrabajo de Mecánica de Fluidos. 2017-I PDFJoseNo ratings yet
- Teoría AtómicaDocument13 pagesTeoría AtómicaDemah wiiiNo ratings yet
- Control Del Sistema de Traccion de Un Vehiculo ElectricoDocument127 pagesControl Del Sistema de Traccion de Un Vehiculo ElectricoCfi Mafi Facu100% (1)
- Velocidad Ascensional Recomendado para Evacuar DetritusDocument7 pagesVelocidad Ascensional Recomendado para Evacuar DetritusHugo Hernan Mamani ChiquiNo ratings yet
- Estructura Atomica Modelo Atomo Actual-Configuracion ElectronicaDocument12 pagesEstructura Atomica Modelo Atomo Actual-Configuracion ElectronicaVICTOR PEÑANo ratings yet
- Clases de HipérbolasDocument4 pagesClases de HipérbolasJohn Andrés Trujillo100% (13)
- Incidencia oblicua ondasDocument5 pagesIncidencia oblicua ondasSebastián Muñoz AndradeNo ratings yet
- Informe 4Document9 pagesInforme 4Hugo JaraNo ratings yet
- Reporte 4.Document12 pagesReporte 4.Kevin CalzadaNo ratings yet
- Unidad 3.1 Introducción A Las Técnicas EspectroscópicasDocument6 pagesUnidad 3.1 Introducción A Las Técnicas EspectroscópicasFernando PadillaNo ratings yet