Professional Documents
Culture Documents
Cinética Química
Uploaded by
PacoquimicoCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Cinética Química
Uploaded by
PacoquimicoCopyright:
Available Formats
Cintica qumica
CINTICA QUMICA
CONTENIDOS
1.-
Velocidad de reaccin (estudio cualitativo).
1.1. Expresin de la velocidad de una reaccin qumica.
1.2. Factores que afectan a la velocidad de una reaccin.
2.-
Ecuacin y constante de velocidad.
2.1. Orden de reaccin. Forma de determinarlo.
3.4.5.-
Mecanismos de reaccin. Molecularidad.
Teora de las colisiones. Energa de activacin (Ea).
Factores de los que depende la velocidad de una reaccin qumica:
5.1. Estado fsico y concentracin de los reactivos.
5.2. Temperatura (ecuacin de Arrhenius).
5.3. Catalizadores.
6.-
Utilizacin de catalizadores en procesos de inters industrial y biolgico.
VELOCIDAD DE REACCIN.
Cuando se produce una reaccin qumica, las concentraciones de cada uno de los
reactivos y productos va variando con el tiempo, hasta que se produce el equilibrio qumico, en el cual las concentraciones de todas las sustancias permanecen constantes.
[HI]
La velocidad de formacin de
un producto d[HI]/dt (tangente)
va disminuyendo con el tiempo
t (s)
v = lim
t 0
La velocidad de una reaccin es
la derivada de la concentracin de un
reactivo o producto con respecto al
tiempo tomada siempre como valor
positivo.
Es decir, es el cociente de la variacin de la concentracin de algn
reactivo o producto por unidad de
tiempo cuando los intervalos de tiempo tienden a 0.
[Sustancia] d[Sustancia]
=
t
dt
Pgina 1 de 10
Cintica qumica
Ejemplo de velocidad de reaccin:
Sea la reaccin: Br2(ac) + HCOOH(ac)
2 HBr(ac) + CO2(g)
Tiempo (s) [Br2] (mol/l) vel. media
0
0,0120
3,8 x 105
Vamos a estudiar como vara la concentracin
de Br2 a lo largo del tiempo:
50
0,0101
3,4 x 105
La velocidad puede expresarse como:
100
0,0084
2,6 x 105
d [Br2 ]
d
[
CO
]
d [HCOOH ]
d [HBr ]
2
150
0,0071
v =
=
=
=
dt
dt
dt
2dt
2,4 x 105
200
0,0059
Parece claro que la velocidad de aparicin de
HBr ser el doble que la de aparicin de CO2 por lo que en este caso la velocidad habr
que definirla como la mitad de la derivada de [HBr] con respecto al tiempo.
Expresin de la velocidad de una reaccin qumica
En la reaccin estndar: a A +b B c C +d D
v =
d [ A]
d [B ]
d [C ]
d [D ]
=
=
=
a dt
b dt c dt d dt
Como la velocidad es positiva segn transcurre la reaccin hacia la derecha, es decir segn va desapareciendo los reactivos, es necesario poner un signo delante de las
concentraciones de stos.
Ejemplo:
Expresar la velocidad de la siguiente reaccin qumica en funcin de la concentracin de
cada una de las especies implicadas en la reaccin: 4 NH3 (g) + 3 O2 (g) 2 N2 (g) + 6
H2O (g)
v =
d [NH3 ]
d [O2 ] d [N2 ] d [H2O ]
=
=
=
4 dt
3 dt 2 dt
6 dt
ECUACIN DE VELOCIDAD
En general, la velocidad depende de las concentraciones de los reactivos siguiendo
una expresin similar a la siguiente para la reaccin estndar: a A + b B c C + d D
v = k [ A]n [B]m
Es importante sealar que m y n no tienen porqu coincidir con los coeficientes
estequiomtricos a y b, sino que se determinan experimentalmente.
A la constante k se le denomina constante de velocidad (No confundir con KC o KP)
Pgina 2 de 10
Cintica qumica
Ejemplos:
Las reacciones: a) H2 (g) + I2 (g) 2 HI (g) y b) H2 (g) + Br2 (g) 2 HBr (g)
tienen ecuaciones de velocidad diferentes: a) v = k x [H2] x [I2] b) v = k x [H2] x [Br2]1/2
Nota: El valor de k depende de cada reaccin.
Orden de reaccin
En la expresin: v = k [A]nx[B]m se denomina orden de reaccin al valor suma de
los exponentes n + m.
Se llama orden de reaccin parcial a cada uno de los exponentes. Es decir, la reaccin anterior es de orden n con respecto a A y de orden m con respecto a B.
Ejemplo:
Determina los rdenes de reaccin total y parciales de las reacciones anteriores:
a) H2 (g) + I2 (g) 2 HI (g)
v = k x [H2] x [I2]
b) H2 (g) + Br2 (g) 2 HBr (g) v = k x [H2] x [Br2]1/2
a) H2 (g) + I2 (g) 2 HI (g)
v = k x [H2] x [I2]
Reaccin de segundo orden (1 + 1)
De primer orden respecto al H2 y de primer orden respecto al I2.
b) H2 (g) + Br2 (g) 2 HBr (g) v = k x [H2] x [Br2]1/2
Reaccin de orden 3/2 (1 + )
De primer orden respecto al H2 y de orden respecto al Br2.
Determinacin de la ecuacin de velocidad
Consiste en medir la velocidad inicial manteniendo las concentraciones de todos los
reactivos constantes excepto la de uno y ver cmo afecta la variacin de ste al valor de
la velocidad.
Si por ejemplo, al doblar la concentracin de un reactivo la velocidad se multiplica
por cuatro, podemos deducir que el orden parcial respecto a ese reactivo es 2.
Ejemplo:
Determinar el orden de reaccin: CH3-Cl(g) + H2O(g) Experiencia [CH3-Cl] (mol/l) [H2O] (mol/l) v (moll1s1)
CH3-OH(g) + HCl(g) usando los
1
0,25
0,25
2,83
datos de la tabla.
2
0,50
0,25
5,67
3
0,25
0,5
11,35
v = k [CH3 -Cl]n [H2 O]m
Pgina 3 de 10
Cintica qumica
En las experiencias 1 y 2 vemos que no cambia [H2O] luego el cambio de v se debe al cambio de [CH3-Cl ]. Como al doblar [CH3-Cl] se dobla la velocidad podemos deducir
que el orden de reaccin r especto del CH3-Cl es 1.
En las experiencias 1 y 3 vemos que no cambia [CH3-Cl] luego el cambio de v se
debe al cambio de [H2O]. Como al doblar [H2O] se cuadruplica la velocidad podemos deducir que el orden de reaccin respecto del H2O es 2.
Por tanto, la ecuacin de velocidad en este caso se expresar:
v = k [CH3 -Cl] [H2 O]2
Y el orden total de la reaccin es 3. El valor de k se calcula a partir de cualquier
experiencia y resulta 181,4 mol2L2s 1.
Para determinar los rdenes de reaccin, tambin puede usarse logaritmos:
log v = log k + n x log [CH3-Cl ] + m x log [H2O]
Aplicamos dicha expresin a cada experimento:
(1) log 2,83 = log k + n x log 0,25 M + m x log 0,25 M
(2) log 5,67 = log k + n x log 0,50 M + m x log 0,25 M
(3) log 11,35 = log k + n x log 0,25 M + m x log 0,50 M
Si restamos dos ecuaciones en las que se mantenga constante uno de los reactivos,
podremos obtener el orden de reaccin parcial del otro. As, al restar (1) (2) eliminamos
k y [H2O]:
log (2,83/5,67) = n x log (0,25/0,50)
Anlogamente restando (1) (3) eliminamos k y [CH3-Cl]
log (2,83/11,35) = m x log (0,25/0,50)
2,83
5,67
n=
= 1
0,25
log
0,50
log
2,83
11,35
= 2
m=
0,25
log
0,50
log
Ejercicio A:
En la obtencin del cido ntrico, una de las etapas principales es la oxidacin del xido
ntrico a dixido de nitrgeno: 2 NO(g) + O2(g) 2 NO2(g). Para esta reaccin, se ha determinado experimentalmente que su ecuacin de velocidad es: v = k [NO]2 [O2] y que la
constante de velocidad, a 250 C, vale: k = 6,5 . 10 -3 mol-2L2s-1. Calcular la velocidad de
oxidacin del NO, a dicha temperatura, cuando las concentraciones iniciales (mol L-1) de
los reactivos son: a) [NO] = 0,100 M ; [O2] = 0,210 M; b) [NO] = 0,200 M; [O2] = 0,420 M.
Pgina 4 de 10
Cintica qumica
Ejercicio B:
El oxido ntrico, NO, reacciona con hidrgeno formando xido nitroso, N2O: 2NO(g) +
H2(g) N2O (g) + H2O (g). En una serie de experimentos se han obtenidos los siguientes
resultados: Determinar la ecuacin de la velocidad y calcular el valor de la constante de
velocidad.
Experiencia Concentracin inicial (mol L-1) Velocidad inicial (mol L-1s-1)
[NO]
[H2]
1
0,064
0,022
2,6 . 10-2
2
0,064
0,044
5,2 . 10-2
3
0,128
0,022
0,10
MECANISMOS DE REACCIN. MOLECULARIDAD.
La reaccin: H2 (g) + I2 (g) 2 HI (g), cuya ecuacin de velocidad tiene la forma:
v = k [H2] x [I2], es una reaccin elemental (que sucede en una sola etapa) y para que suceda es necesario el choque de dos molculas (una de H2 y otra de I2). Se dice que es
una reaccin bimolecular.
Se llama molecularidad al nmero de molculas de reactivos que colisionan simultneamente para formar el complejo activado en una reaccin elemental. Se trata de un
nmero entero y positivo. As hablamos de reacciones unimoleculares, bimoleculares, trimoleculares, etc Generalmente, en reacciones elementales, coincide con el orden de
reaccin. Sin embargo, existen casos en los que no coinciden, como las reacciones de
hidrlisis en los que interviene una molcula de agua ya que al ser [H2O] prcticamente
constante la velocidad es independiente de sta.
Es raro que una reaccin intervengan ms de tres molculas, pues es muy poco
probable que chocan entre s simultneamente con la energa y orientacin adecuadas.
Por dicha razn, la mayora de las reacciones suceden en etapas. El conjunto de estas etapas se conoce como mecanismo de la reaccin. Las sustancias que van apareciendo y que no son los productos finales se conocen como intermedios de reaccin.
La velocidad de la reaccin depender de las sustancias que reaccionen en la etapa
ms lenta.
Ejemplo de mecanismo de reaccin :
La reaccin siguiente: NO2 (g) + CO (g) NO (g) + CO2 (g) sucede en dos etapas:
1 etapa (lenta): 2 NO2 NO + NO3
2 etapa (rpida): NO3 + CO NO2 + CO2
Pgina 5 de 10
Cintica qumica
La reaccin global es la suma de las dos. NO3 es un intermedio de reaccin. Como
en la etapa lenta intervienen dos molculas de NO2, v = k x [NO2]2
TEORA DE LAS COLISIONES. ENERGA DE ACTIVACIN (EA).
El nmero de molculas de productos es proporcional al nmero de
choques entre las molculas de los
reactivos. De stos, no todos son efectivos, bien porque no tienen la energa
necesaria para constituir el complejo
activado, (asociacin transitoria de
molculas muy inestable, porque su
energa es mayor a la de reactivos y
productos por separado, pero por el
cual debe transcurrir necesariamente
la reaccin), o bien porque no tienen la
orientacin adecuada.
Productos
I
I2
Complejo
activado
Reactivos
Choque eficaz
H2
Choque no eficaz
Orientacin en el choque.
La energa de activacin es la necesaria para formar el complejo activado, a partir
del cual la reaccin transcurre de forma natural.
Ver vdeoclip (flash) (gif)
Perfil de una reaccin.
Entalpa
Complejo activado
Complejo activado
Energa de activacin
productos
reactivos
reactivos
productos
Reaccin exotrmica
Entalpa de reaccin (H)
Reaccin endotrmica
FACTORES DE LOS QUE DEPENDE LA VELOCIDAD DE UNA REACCIN QUMICA.
Naturaleza de las sustancias.
Estado fsico.
Superficie de contacto o grado de pulverizacin (en el caso de slidos)
Pgina 6 de 10
Cintica qumica
Concentracin de los reactivos.
Temperatura.
Presencia de catalizadores.
Estado fsico de los reactivos.
Cuando los reactivos se encuentran en estado gaseoso o en disolucin las reacciones son ms rpidas que si se encuentran en estado lquido o slido.
En las reacciones heterogneas la velocidad depender de la superficie de contacto
entre ambas fases, siendo mayor cuanto mayor es el grado de pulverizacin.
Concentracin de los reactivos.
En la ecuacin de velocidad ya observamos la influencia que tenan los reactivos o
al menos alguno de ellos en la velocidad de la reaccin. En general, al aumentar la concentracin de stos se produce con mayor facilidad el choque entre molculas y aumenta
la velocidad.
La constante de velocidad, y por tanto la velocidad de una reaccin, aumenta si aumenta la
temperatura, porque la fraccin de molculas que
sobrepasan la energa de activacin es mayor.
As, a T2 hay un mayor porcentaje de molculas
con energa suficiente para producir la reaccin
(rea sombreada) que a T1.
Fraccin de molcul
Temperatura. (Ecuacin de Arrhenius).
T1
EA
T2
Energa
La variacin de la constante de la velocidad
con la temperatura viene recogida en la ecuacin de Arrhenius:
k = Ae
EA
RT
k = const. de velocidad
A = constante
T = temp. absoluta
Normalmente se expresa de forma logartmica para calcular EA.
ln k = ln A
EA
R T
Ejemplo:
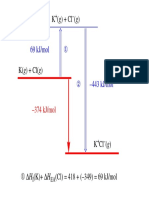
Cual es el valor de la energa de activacin para una reaccin si la constante de velocidad se duplica cuando la temperatura aumenta de 15 a 25 C?
Sabemos que k2 (298 K) = 2 x k1 (288 K)
Pgina 7 de 10
Cintica qumica
(1) ln k1 = ln A Ea/RT1;
(2) ln 2 k1 = ln A Ea/RT2
Sustituyendo R = 8,31 Jmol1 K, T1 = 288 K y T2 = 298 K y restando (2) (1):
ln 2 =
EA
EA
1
1
8,31 J mol 298 K 8,31 J mol 1288 K
Despejando EA se obtiene: E A = 4,95 104 J mol 1
Catalizadores
Pueden ser:
EA sin catalizador
Energa
Intervienen en alguna etapa de la
reaccin pero no se modifican, pues se
recuperan al final y no aparecen en la
ecuacin global ajustada. Modifican el
mecanismo y por tanto la Ea de la reaccin. Sin embargo, no modifican las constantes de los equilibrios.
EA con catalizador
reactivos
productos
coordenada de reaccin
Perfil de la reaccin con y sin catalizador
Positivos: hacen que v aumente, pues consiguen que EA disminuya.
Negativos: hacen que v disminuya, pues consiguen que EA aumente.
Los catalizadores tambin pueden clasificarse en:
Homogneos: en la misma fase que los reactivos.
Heterogneos: se encuentra en distinta fase.
Ejemplo de catlisis heterognea
En los catalizadores de los coches hay una mezcla de Pt y Rh sobre las que se producen las siguientes reacciones:
2 CO (g) + O2 (g) 2 CO2 (g)
2 NO (g) + 2 CO (g) N2 (g) + 2 CO2 (g)
2 C2H6 (g) + 7 O2 (g) 4 CO2 (g) + 6 H2O (g)
con objeto de eliminar los gases txicos CO y NO, as como hidrocarburos que no se
hayan quemado del todo.
Teniendo en cuenta la grfica adjunta: a) Indique si
la reaccin es exotrmica o endotrmica b) Represente el valor de H de reaccin c) Representa la
curva de reaccin al aadir un catalizador positivo.
d) Qu efectos produce el hecho de aadir un
catalizador positivo?
Energa
Ejercicio de Selectividad. (Madrid Junio 1998):
reactivos
productos
coordenada de reaccin
Pgina 8 de 10
a) Es exotrmica ya que Eproductos < Ereactivos.
b) Ver grfica.
c) Ver grfica.
Energa
Cintica qumica
EA
reactivos
productos
d) Disminuye la Eactivacin y por tanto existe
coordenada
de
reaccin
una mayor cantidad de reactivos con energa
suficiente para reaccionar; por tanto aumentar la velocidad.
UTILIZACIN DE CATALIZADORES EN PROCESOS DE INTERS INDUSTRIAL.
La mayora de los procesos industriales utilizan catalizadores slidos. Estos slidos,
de composicin altamente compleja (en ocasiones llegan a tener 10 o ms elementos en
su frmula), pueden ser sin embargo descritos en forma de tres componentes elementales: la fase activa, el soporte y el promotor.
La fase activa, como su nombre lo indica, es la directamente responsable de la actividad cataltica. Esta fase activa puede ser una sola fase qumica o un conjunto de ellas,
sin embargo, se caracteriza porque ella sola puede llevar a cabo la reaccin en las condiciones establecidas. Sin embargo, esta fase activa puede tener un costo muy elevado,
como en el caso de los metales nobles (platino, paladio, rodio, etc.) o puede ser muy sensible a la temperatura (caso de los sulfuros de molibdeno y cobalto), por lo cual se requiere de un soporte para dispersarla, estabilizarla y proporcionarle buenas propiedades mecnicas.
El soporte es la matriz sobre la
cual se deposita la fase activa y el que
permite optimizar sus propiedades catalticas. Este soporte puede ser poroso y por lo tanto presentar un rea superficial por gramo elevada.
El promotor es aquella sustancia
que incorporada a la fase activa o al
soporte en pequeas proporciones,
permite mejorar las caractersticas de
un catalizador en cualquiera de sus
funciones de actividad, selectividad o
estabilidad.
Catalizador de un coche. Tomado de:
http://www.oni.escuelas.edu.ar/olimpi99/autos-ypolucion/cataliza.htm
Pgina 9 de 10
Cintica qumica
Algunos enlaces interesantes:
http://www.indexnet.santillana.es/powerpoints/graficos/cinetica.ppt
http://www.uv.es/~baeza/cqtema3.html
http://www.oni.escuelas.edu.ar/olimpi99/autos-y-polucion/cataliza.htm
Anmate a hacer esta breve evaluacin sobre cintica qumica:
http://perso.wanadoo.es/cpalacio/evalua/ecinetica.htm
Pgina 10 de 10
You might also like
- Ejercicios de Estructura de La Materia Con SolucionDocument6 pagesEjercicios de Estructura de La Materia Con SolucionPacoquimicoNo ratings yet
- Acido BaseDocument16 pagesAcido BasePaula LlacerNo ratings yet
- TEMA Estructura de La MateriaDocument11 pagesTEMA Estructura de La MateriaPacoquimicoNo ratings yet
- Resumen Tema OrganicaDocument17 pagesResumen Tema OrganicaPacoquimicoNo ratings yet
- RedoxDocument16 pagesRedoxPacoquimicoNo ratings yet
- Resumen EstequiometriaDocument6 pagesResumen EstequiometriaGabriela DiazNo ratings yet
- Tabla Periodic ADocument13 pagesTabla Periodic AJuan José Macha AnayaNo ratings yet
- Espectroscopia y EstructuraDocument43 pagesEspectroscopia y EstructurasurivahoNo ratings yet
- BibliografiaDocument4 pagesBibliografiaPacoquimicoNo ratings yet
- Enlace Quimico TransparenciasDocument20 pagesEnlace Quimico TransparenciasPacoquimicoNo ratings yet
- Anexo3 Cuadro - De.simbolos.y.valenciasDocument1 pageAnexo3 Cuadro - De.simbolos.y.valenciasMonica SiiErraNo ratings yet
- Practicas 1 BachilleratoDocument6 pagesPracticas 1 BachilleratoPacoquimicoNo ratings yet
- Mapa Mental Lineas y Sublineas de InvestigacionDocument1 pageMapa Mental Lineas y Sublineas de InvestigacionCAMILO VIDES0% (1)
- Tipos de MarketingDocument1 pageTipos de MarketingMathius Nuñez CasillaNo ratings yet
- Comprimidos Obtenidos Por Compresión de Un GranuladoDocument12 pagesComprimidos Obtenidos Por Compresión de Un GranuladoMaria Rene TorresNo ratings yet
- Fórmulas para Cuantificar La Compensación EconómicaDocument14 pagesFórmulas para Cuantificar La Compensación EconómicaHelenAvalosNo ratings yet
- Mercadona AnalisisDocument13 pagesMercadona Analisisicastrou50% (2)
- Radio CognitivaDocument17 pagesRadio CognitivaMoisesClintonSonccoHuisaNo ratings yet
- GEOGRAFIADocument5 pagesGEOGRAFIAAlfonso PrietoNo ratings yet
- Introducción A La Metodología BIM Una PUno PDFDocument68 pagesIntroducción A La Metodología BIM Una PUno PDFDjBenjaPaucarYagamiNo ratings yet
- Política de SelecciónDocument10 pagesPolítica de SelecciónClarisa Rojas MoyaNo ratings yet
- NORMA Oficial Mexicana NOM-008 Sistema General de Unidades de Medida (Resumen)Document1 pageNORMA Oficial Mexicana NOM-008 Sistema General de Unidades de Medida (Resumen)Tareas RápidasNo ratings yet
- Negociacion Empresarial U2 Fases Toma Decisiones PDFDocument29 pagesNegociacion Empresarial U2 Fases Toma Decisiones PDFMirgen MirandaNo ratings yet
- Ejercicios Cambiado EnunciadoDocument15 pagesEjercicios Cambiado EnunciadoSandra Portal0% (1)
- Proyecto Interdisciplinario 1° TrimestreDocument6 pagesProyecto Interdisciplinario 1° TrimestreJANETH MAGDALENA ROSARIO RIOFRIONo ratings yet
- Mini Excavadora Kubota KX121 3 Alpha SPDocument4 pagesMini Excavadora Kubota KX121 3 Alpha SPramon hidalgoNo ratings yet
- Didáctica general: enseñanza, aprendizaje y evaluaciónDocument22 pagesDidáctica general: enseñanza, aprendizaje y evaluaciónVictoria AriasNo ratings yet
- Examen 2023 ESFMDocument20 pagesExamen 2023 ESFMnayeliquinotolaNo ratings yet
- Kendal Home kpm23Document26 pagesKendal Home kpm23Hope ChileNo ratings yet
- Tarea 1 - Maira MárquezDocument7 pagesTarea 1 - Maira MárquezMaira MárquezNo ratings yet
- Principios de ElectromagnetismoDocument7 pagesPrincipios de ElectromagnetismoAlcantara Ordoñez CitlalliNo ratings yet
- Cartilla ADElante ABC SINDICAL - ESCUELA SINDICAL ADEDocument30 pagesCartilla ADElante ABC SINDICAL - ESCUELA SINDICAL ADEגאָרנישט גאָרנישטNo ratings yet
- Afilado de BurilesDocument4 pagesAfilado de BurilesGrevy Oziel FloresNo ratings yet
- Unidad 2 Comunicacion 2 3 NominacionDocument11 pagesUnidad 2 Comunicacion 2 3 Nominacionrosaritofcg1982100% (11)
- Ciencia y AmbienteDocument3 pagesCiencia y AmbienteEdilberto Linares100% (1)
- Resume NDocument85 pagesResume NCARMEN OSORIONo ratings yet
- Sonic The HedgehogDocument4 pagesSonic The HedgehogAnthony CamarenaNo ratings yet
- Compressors STC Portfolio Esp (Exposicion 3)Document8 pagesCompressors STC Portfolio Esp (Exposicion 3)Luis Francisco Palma ZentNo ratings yet
- RESERVORIO RETROGRADO TAMBIEN WordDocument6 pagesRESERVORIO RETROGRADO TAMBIEN WordGonzalo vargasNo ratings yet
- Capacitacion TareaDocument5 pagesCapacitacion Tareasri mantraNo ratings yet
- Cronograma de Constitucion de Una EmpresaDocument2 pagesCronograma de Constitucion de Una EmpresaFloresRamireƺNo ratings yet