Professional Documents
Culture Documents
Equilíbrio Químico
Uploaded by
Vânia Maria SantosOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Equilíbrio Químico
Uploaded by
Vânia Maria SantosCopyright:
Available Formats
ESCOLA SECUNDRIA DE MONSERRATE
F.Q. A 2 ANO EQUILBRIO QUMICO
1. Para ocorrer uma situao de equilbrio num sistema so necessrias, pelo menos, duas das condies
seguintes:
A Todos os reagentes se convertam em produtos.
B Uma reaco reversvel.
C Duas reaces simultneas em sentidos opostos.
D Um sistema fechado.
E A rapidez da reaco inversa seja zero.
2. Qual ou quais das opes seguintes completam correctamente a frase: "O valor da constante de
equilbrio..."?
A ... aumenta quando aumentam as concentraes de reagentes.
B ... pode sofrer alterao se a temperatura variar.
C ... de um sistema em fase gasosa pode variar se a presso tambm variar.
D ... varia se for utilizado um catalisador.
E ... aumenta se aumentarem as concentraes dos produtos da reaco.
3. Para haver equilbrio qumico necessrio, entre outras condies, que:
A A reaco directa e a reaco inversa ocorram com igual rapidez.
B A quantidade de produtos seja igual quantidade de reagentes.
C O valor da constante de equilbrio seja igual a 1.
4. Escreve a expresso da constante de equilbrio para as seguintes reaces:
(A) 2 CO (g) + O 2 (g) 2 CO 2 (g)
(B) 2 H 2 (g) + CO (g) CH 3 OH (g)
(C) PCl 5 (g) PCl 3 (g) + Cl 2 (g)
(D) 2 H 2 S (g) + 3 O 2 (g) 2 H 2 O (g) + 2 SO 2 (g)
5. De entre as reaces seguintes, indica quais so as que envolvem equilbrios homogneos e as
que envolvem equilbrios heterogneos.
(A) 2 NO (g) + O 2 (g) 2 NO 2 (g)
(B) 2 Cu(NO 3 ) 2 (s) 2 CuO (s) + 4 NO 2 (g) + O 2 (g)
(C) 2 N 2 O ( g ) 2 N 2 ( g) + O 2 ( g )
(D) 2 NH 3 (g) + 3 CuO (s) 3 H 2 O (g) + N 2 (g) + 3 Cu (s)
6. Para determinar a constante de equilbrio da reaco qumica representada por:
2 NO (g) + O2 (g) 2 NO2 (g)
misturaram-se, num reactor laboratorial de 15 litros, monxido de azoto e oxignio. Quando se atingiu o
equilbrio qumico estavam presentes 9x10-2 moles de monxido de azoto, 5x10-2 moles de oxignio e
4x10-2 moles de dixido de azoto. Calcule o valor da constante de equilbrio Kc temperatura de
trabalho.
7. A constante de equilbrio para a reaco:
N 2 (g) + O 2 (g) 2 NO (g) 2, 5x1 0 - 2 , a 2 1 30 C.
Determina a constante de equilbrio para a equao:
NO (g) N 2 (g) + O 2 (g)
8. Por vezes, uma reaco qumica resulta da soma de duas etapas (reaces parciais), como
no caso seguinte:
2 NO (g) N 2 (g) + O 2 (g) K 1
N2 (g) + 2 O2 (g) N2O4 (g) K2
2 NO ( g ) + O 2 ( g ) N 2 O 4 ( g) K3
Demonstra que a constante K 3 obtida pelo produto das duas constantes (K 1 e K 2 ), ou seja:
K3 = K1 x K2
9. Um recipiente de 1,5 dm3 de capacidade contm, em equilbrio, 63,4 g de PCl5, 7,75 x 10-2 mol de
PCl3 e 127,8 g de Cl2, a uma dada temperatura. A reaco que ocorre traduzida pela equao:
PCl5 (g) PCl3 (g) + Cl2 (g)
Calcula o valor da constante de equilbrio da reaco de decomposio do PCl5 temperatura da
experincia.
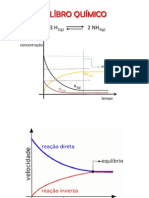
10. Tem em ateno o grfico abaixo indicado.
Neste grfico est registado o modo como variam as concentraes dos reagentes e dos produtos da
reaco, ao longo do tempo, num sistema onde ocorre a seguinte reaco de equilbrio:
H 2 (g) + I2 (g) 2 HI (g)
10.1. Quais so as concentraes iniciais dos reagentes?
10.2. Em que instante se atingiu o equilbrio? Justifique.
10.3. Determina o valor da constante de equilbrio temperatura a que foi feita a experincia.
10.4. Qual dos grficos seguintes representa a variao das velocidades das reaces directa e inversa,
at se atingir o equilbrio?
I II III
11. Num recipiente fechado de volume igual a 20 cm3, temperatura de 256 C, d-se a decomposio do
iodeto de hidrognio, segundo a equao:
2HI (g) H2 (g) + I2 (g)
Inicialmente introduzem-se 25,6 g de HI e quando se atinge o equilbrio esto presentes 0,20 mol de H2. Calcula o
valor da constante de equilbrio temperatura da experincia.
12. Uma amostra de 2,0 mol de dixido de azoto colocada num reactor de 80,0 L de capacidade,
temperatura de 200 C, tendo-se dissociado 6,0%. A equao que traduz este equilbrio :
2 NO 2 (g) 2 NO (g) + O 2 (g)
Calcule o valor da constante de equilbrio da reaco a 200 C.
13. Um reactor com 2,0 L de capacidade contm 1,0 mol de SO2, 3,0 mol de O2 e 8,0 mol de SO3, em
equilbrio. O valor da constante de equilbrio Kc para a reaco traduzida pela equao:
2 SO2 (g) + O2 (g) 2 SO3 (g)
: A 1,25x10-3 C 42,7
B 160 D 5,0x10-2
14. Para a temperatura T, a reaco de equilbrio traduzida por
N2O4 (g) 2 NO2 (g) tem Kc = 1 .
Isto significa que, a essa temperatura:
A [N2O4] = 0 D [N2O4] = 2 [NO2]
B [N2O4] = 1 E [N2O4] = [NO2]2
C [N2O4] = [NO2]
15. Durante a 1. Guerra Mundial utilizou-se, para o fabrico de explosivos, o amonaco produzido pelo
processo de Haber, que pode ser traduzido pela seguinte equao qumica:
N2 (g) + 3 H2 (g) 2 NH3 (g) com Kc = 6,06 temperatura T.
No reactor de Haber encontram-se em equilbrio di-hidrognio e amonaco com as concentraes iguais a
7,68 mol dm-3 e 90,0 mol dm-3, respectivamente. A concentrao de diazoto ser:
A 0,34 mol dm-3 C 2,95 mol dm-3
B 0,23 mol dm-3 D 108,4 mol dm-3
16. Considere o equilbrio qumico temperatura T:
A (g) + B (g) C (g) + D (g)
Inicialmente, [A(g)] = [B(g)] = 0,60 mol/dm3 e ao ser atingido o equilbrio, [C(g)] = 0,40 mol/dm3.
Calcule o valor da constante de equilbrio temperatura referida. (Kc = 4)
17. A reaco traduzida por:
N2 (g) + 3 H2 (g) 2 NH3 (g) H < 0
apresenta, a 350 C. para a constante de equilbrio Kc, o valor 2,37 x 10-3.
Num determinado estrado de equilbrio, temperatura referida, as concentraes so:
[N2] = 0,683 mol.dm-3; [H2] = 8,80 mol. dm-3; [NH3] = 1,05 mol. dm-3;
17.1. Considere que, num dado instante t1, a concentrao de amonaco foi aumentada para 3,0 mol.
dm-3, a temperatura constante. Indique, justificando, o sentido em que evolui o sistema at atingir outro
estrado de equilbrio.(, Q = 1,93 x 10-2)
17.2. Escolha entre os grficos I, II e III, aquele que compatvel com a situao apresentada.
Justifique.
17.3. A uma temperatura T, as concentraes de equilbrio para o mesmo sistema so:
[N2] = 0,808 mol. dm-3; [H2] = 9,180 mol. dm-3; [NH3] = 0,800 mol. dm-3
Calcule o valor da constante de equilbrio Kc, nestas condies, e indique, com a respectiva justificao,
se a temperatura T superior ou inferior a 350 C. (Kc = 1,0 x 10-3, T > 350C)
18. Colocou-se num recipiente de 5,0 dm3 de capacidade 1,00 mol de iodeto de hidrognio.
O sistema atingiu o equilbrio temperatura de 458C.
2 HI (g) H2 (g) + I2 (g)
N inicial de moles 1,00 -- --
Variao do n de moles
N moles no equilbrio 0,79
Concentrao no equilbrio
(mol. dm-3)
18.1. Complete o quadro.
18.2. Calcule o valor de Kc temperatura de 458 C. (Kc = = 1,77 x 10-2)
19. Um processo industrial importante para a preparao de hidrognio traduzido pela equao
qumica:
CO (g)+ H2O (g) H2 (g) + CO2 (g) + 410 kJ
19.1. Inicialmente misturaram-se 2 mol de CO (g) com 1,5 mol de H2O (g) num recipiente com 2 dm3 de
capacidade. A uma dada temperatura atingiu-se o equilbrio, sendo a concentrao de CO (g) no
equilbrio de 0,35 mol/dm3. Determina as concentraes dos restantes componentes do sistema. ([H2O]
= 0,10; [H2] = [CO2] = 0,65)
19.2. Entre as seguintes alteraes, indica, justificando, a(s) que conduz(em) a uma maior produo de
hidrognio:
A) adio de gua;
B) adio de dixido de carbono;
C) remoo de monxido de carbono;
D) aumento da temperatura;
E) diminuio do volume do recipiente onde se processa a reaco;
20. Uma mistura de 0,1 mol de NO, 0.5 mol de H2 e 0,1 mol de H2O foi colocada num vaso de quatro
litros de capacidade, tendo-se estabelecido o equilbrio a uma dada temperatura:
2 NO (g) + 2 H2 (g) N2 (g) + 2 H2O (g)
Analisando a composio do sistema em equilbrio, verificou-se a presena de 0,07 mol de NO.
20.1. Calcula as concentraes das vrias espcies presentes no equilbrio. ([NO] = 0,0175, [H2O] =
0,0325; [H2] = 0,118; [N2] = 0,0038)
20.2. Que alterao prevs, quanto ao sistema em equilbrio se:
i) se introduzir uma substncia que reaja com o hidrognio;
ii) se introduzir uma substncia que reaja com o azoto,
iii) se introduzir monxido de azoto;
iv) se aumentar o volume do vaso onde se processa a reaco;
v) se adicionar um catalisador; =
vi) se aumentar a presso.
21. Misturando 10 mol de Cl2 com 4 mol de H2O num recipiente de capacidade 2 dm3, atingido um
estado de equilbrio a uma determinada temperatura, de acordo com a seguinte equao:
2 Cl2 (g) + 2 H2O (g) 4 HCl (g) + O2 (g) (reaco endotrmica)
A quantidade de Cl2 no equilbrio 7 mol.
21.1. Calcula a massa de H2O que reagiu. (54 g)
21.2. Determina as concentraes de todas as espcies presentes no sistema em equilbrio.
21.3. Alguma das reaces pode considerar-se completa? Justifica.
21.4. Que alteraes prevs, quanto ao sistema em equilbrio, se:
i) se diminuir o volume do recipiente onde se encontra o sistema;
ii) se diminuir a temperatura;
iii) se aumentar a concentrao de Cl2;
iv) se adicionar um catalisador.
22. Considera o sistema em equilbrio temperatura de 25 C.
N2O4 (g) 2 NO2 (g)
A concentrao inicial de N2O4 0,670 mol. dm-3 e, no equilbrio 0,6427 mol. dm-3. Calcula:
22.1. a concentrao de NO; no equilbrio;(5,46 x 10-2 mol/dm3)
22.2. o valor da constante de equilbrio Kc; (Kc = 4,6 x 10-3)
*23. 15 g de cido actico reagem com 23 g de lcool etlico obtendo-se 18,43 g de acetato de etilo e
gua. Calcula a constante de equilbrio temperatura da experincia. A equao que traduz a reaco de
esterificao : (Kc = 1,22)
CH3COOH (l) + CH3CH2OH (l) CH3COOCH2CH3 (l) + H2O (l)
24. Num recipiente de 5,0 dm3 introduziram-se 4,0 mol de PCl5 temperatura T. Quando se atingiu o
equilbrio qumico, 60 % de PCl5 estava dissociado.
PCl5 (g) PCl3 (g) + Cl2 (g)
Calcula o valor da constante de equilbrio temperatura T. (Kc = 0,72)
25. Considera o seguinte equilbrio qumico temperatura t = 200 C.
N2 (g) + 3 H2 (g) 2 NH3 (g)
A constante de equilbrio, temperatura referida, Kc = 0,65.
Num recipiente de 10 dm3 introduziram-se 2,0 mol de N2, 0,40 mol de H2 e 0,030 mol de NH3.
25.1. Verifica que o sistema no est em equilbrio e indica em que sentido se deve deslocar para atingir
o equilbrio. (Q = 0,70, )
25.2. Se no sistema em equilbrio se adicionar algum NH3 indica, justificando, em que sentido se desloca
o equilbrio.
26. Considere a seguinte equao qumica:
2 CH4 (g) + O2 (g) 2 CO (g) + 4 H2 (g)
26.1. Admitindo que, inicialmente, se misturam CH4 (g) e O2 (g) em concentraes iguais, os grficos A
e B no podem traduzir a evoluo do sistema at atingir o equilbrio. Indica, para cada um dos grficos
A e B, uma razo que justifique a afirmao anterior.
26.2. Escreve a expresso da constante de equilbrio.
26.3. Em que sentido se deslocaria o equilbrio se fosse aumentado o volume do sistema reaccional,
mantendo constante a temperatura? Justifica com o quociente da reaco.
27. Considere o equilbrio traduzido pela equao:
CH4 (g) + H2O (g) CO (g) + 3 H2 (g)
temperatura T, Kc = 2,0.
Num vaso fechado de capacidade 1,0 L, introduziram-se 1,0 mol de cada um dos componentes do
sistema.
27.1. O sistema estar em equilbrio? Justifique.
27.2. Em que sentido progredir a reaco at se estabelecer o equilbrio? Justifique.
28. Considere o equilbrio traduzido pela equao:
2 H2O (g) + 2 Cl2 (g) 4 HCl (g) + O2 (g).
Sabendo que a reaco exotrmica, qual o efeito na concentrao de equilbrio de O2 por:
A Adio de um catalisador.
B Aumento da presso total do sistema.
C Aumento da temperatura.
D Aumento da concentrao de Cl2.
29. A 425 K, a constante de equilbrio para a reaco:
2 HI (g) H2 (g) + I2 (g) Kc = 1,8 x 10-2.
Num balo de 1,0 L de capacidade introduziram-se, a 425 K, 0,25 mol de cada um dos intervenientes na
reaco referida.
29.1. Determine o quociente de reaco.
29.2. Indique em que sentido evolui o sistema at atingir o equilbrio,
30. Num recipiente de 1,0 L de capacidade colocaram-se 1,0 mol de PCl5. A 250 C verificou-se a
decomposio parcial do PCl5 de acordo com a equao:
PCl5 (g) PCl3 (g) + Cl2 (g)
Aps o estabelecimento do equilbrio, o nmero de moles de Cl2 0,47 mol. Complete as frases de modo
a obter afirmaes cientificamente correctas.
A O nmero de moles de PCl5 que reagiu foi _________.
B O valor da constante de equilbrio, Kc __________.
C A percentagem de decomposio de PCl5 foi de __________.
31. Num recipiente de 1,0 L de capacidade introduziram-se 2,0 mol de C, que reagiram segundo o
esquema:
A (g) + B (g) 2 C (g)
temperatura T, o sistema atinge o equilbrio, sendo Kc = 1,2.
Determine as concentraes de equilbrio dos trs gases.
You might also like
- Kc_reações_químicas_equilíbrioDocument3 pagesKc_reações_químicas_equilíbrioRafael TeixeiraNo ratings yet
- Princípio de Le Châtelier em equilíbrios químicosDocument4 pagesPrincípio de Le Châtelier em equilíbrios químicosAndrei GalanNo ratings yet
- 11FQA Ficha Trab Ini Q1.2 - N.º 1Document4 pages11FQA Ficha Trab Ini Q1.2 - N.º 1Quim Caçador TransdufiNo ratings yet
- Equilíbrio químico: exercícios sobre Kc e KpDocument3 pagesEquilíbrio químico: exercícios sobre Kc e KpLetícia Rossi0% (1)
- Ficha 1 - Equilíbrio QuímicoDocument5 pagesFicha 1 - Equilíbrio QuímicoBeatriz AmorimNo ratings yet
- Equilíbrio químico - lista de exercícios resume de forma concisa e otimizada para o conteúdo do documento, que trata de uma lista de exercícios sobre equilíbrio químico, como solicitadoDocument5 pagesEquilíbrio químico - lista de exercícios resume de forma concisa e otimizada para o conteúdo do documento, que trata de uma lista de exercícios sobre equilíbrio químico, como solicitadoLussandra MarquezNo ratings yet
- Equilíbrio Químico - Constante de Equilíbrio KcDocument9 pagesEquilíbrio Químico - Constante de Equilíbrio KcRaisson HolandaNo ratings yet
- Equilíbrios químicos e iônicosDocument4 pagesEquilíbrios químicos e iônicosmailas33No ratings yet
- Exerc EquilibrioDocument4 pagesExerc EquilibrioJr FantinellNo ratings yet
- 1a FichaDocument4 pages1a FichaAlexandre DiazNo ratings yet
- Equilíbrio Químico e Cálculo de Constante de Equilíbrio KcDocument3 pagesEquilíbrio Químico e Cálculo de Constante de Equilíbrio KcAlda Maria Dinis Ginja100% (1)
- Go Tarefa Semanal Curso 5e8b7a80d74e8Document22 pagesGo Tarefa Semanal Curso 5e8b7a80d74e8rafinhagebrinNo ratings yet
- Lista de Exercícios - EquilíbrioDocument2 pagesLista de Exercícios - EquilíbrioRian TorresNo ratings yet
- Lista de Exercícios Equilíbrio Químico UFPBDocument3 pagesLista de Exercícios Equilíbrio Químico UFPBAline MirandaNo ratings yet
- Ficha 2 - Equilíbrio QuímicoDocument5 pagesFicha 2 - Equilíbrio QuímicoBeatriz AmorimNo ratings yet
- Ficha de Trabalho 7 - Aspetos Quantitativos Das RQ e Equilíbrio Químico e Extensão Das RQDocument4 pagesFicha de Trabalho 7 - Aspetos Quantitativos Das RQ e Equilíbrio Químico e Extensão Das RQFranciscaNo ratings yet
- Equilíbrio QuímicoDocument17 pagesEquilíbrio QuímicojulioNo ratings yet
- Lista de Exercícios Equilíbrio QuímicoDocument3 pagesLista de Exercícios Equilíbrio QuímicoDebora SeguchiNo ratings yet
- Lista de equilíbrios químicosDocument5 pagesLista de equilíbrios químicosAnderson_NizNo ratings yet
- 40-Cálculos de EquilíbrioDocument4 pages40-Cálculos de Equilíbrionv77vnmNo ratings yet
- Equilíbrio químico e extensão de reaçõesDocument4 pagesEquilíbrio químico e extensão de reaçõesINES DE LEMOS SARGENTO E ALMEIDANo ratings yet
- Equilíbrio químico - exercícios de químicaDocument8 pagesEquilíbrio químico - exercícios de químicaThania ArrudaNo ratings yet
- 11FQA Ficha Trab Ini Q1.2 - N.º 2Document4 pages11FQA Ficha Trab Ini Q1.2 - N.º 2carlosNo ratings yet
- Equilíbrio QuímicoDocument4 pagesEquilíbrio QuímicoGustavo NoriyukiNo ratings yet
- Teste 4 v1Document5 pagesTeste 4 v1André MatosNo ratings yet
- Constante de equilíbrio Kc para reação de formação de HCNDocument22 pagesConstante de equilíbrio Kc para reação de formação de HCNDeborah LGNo ratings yet
- ExercíciosDocument6 pagesExercíciosCaroline Paglia NadalNo ratings yet
- Equilíbrio Químico APFQ Curso Técnico QuímicaDocument2 pagesEquilíbrio Químico APFQ Curso Técnico QuímicaGerson SilvaNo ratings yet
- Lista de Equilíbrio Químico PDFDocument3 pagesLista de Equilíbrio Químico PDFMarcelo SatorresNo ratings yet
- 1 Lista de Atividades de Equilíbrio QuímicoDocument4 pages1 Lista de Atividades de Equilíbrio QuímicoDavid RonaldNo ratings yet
- Lista de Exercícios II - Equilíbrio QuímicoDocument6 pagesLista de Exercícios II - Equilíbrio QuímicoErenilson SantosNo ratings yet
- 11FQA Ficha Trab Ini Q1.2 - N.º 2Document4 pages11FQA Ficha Trab Ini Q1.2 - N.º 2Andrei GalanNo ratings yet
- 11FQA Ficha trab ini Q1.2 - n.º 2 - soluçãoDocument8 pages11FQA Ficha trab ini Q1.2 - n.º 2 - soluçãoρ૯ѳρl૯ツNo ratings yet
- Equil Brio Qu MicoDocument3 pagesEquil Brio Qu Micodaniel_nrnNo ratings yet
- Química Geral equilíbrio químico solubilidadeDocument2 pagesQuímica Geral equilíbrio químico solubilidadeGabriel PereiraNo ratings yet
- Equi Lib Rio CompletoDocument50 pagesEqui Lib Rio CompletoLeonardo JunglesNo ratings yet
- Introdução à Química-Física - Equilíbrio QuímicoDocument10 pagesIntrodução à Química-Física - Equilíbrio QuímicofersayNo ratings yet
- Ficha de trabalho sobre equilíbrio químicoDocument2 pagesFicha de trabalho sobre equilíbrio químicoDiogo NunesNo ratings yet
- Equilíbrio QuímicoDocument43 pagesEquilíbrio QuímicoSilvio RobertoNo ratings yet
- Exercícios Constante de EquilíbrioDocument13 pagesExercícios Constante de EquilíbrioPietra LemosNo ratings yet
- Equilíbrio químico e cálculos estequiométricosDocument3 pagesEquilíbrio químico e cálculos estequiométricosnelson_honorioNo ratings yet
- QFL0605 - Lista de Exercicios - Equilíbrio Químico 26-03-2020Document3 pagesQFL0605 - Lista de Exercicios - Equilíbrio Químico 26-03-2020Esperança FLORENTINONo ratings yet
- Ae q11 Fich Form 1Document5 pagesAe q11 Fich Form 1carla50% (2)
- Lista de Equilíbrio QuímicoDocument5 pagesLista de Equilíbrio QuímicoMÁRIO LIMANo ratings yet
- Equilibrio QuimicoDocument4 pagesEquilibrio QuimicoEfraim Nobre SoaresNo ratings yet
- Equilíbrio químico - Constante de equilíbrio KcDocument8 pagesEquilíbrio químico - Constante de equilíbrio Kcprofmarkao0% (1)
- Ficha - 13 - Estado de Equilíbrio e Extensão Das Reações Químicas - AlunoDocument3 pagesFicha - 13 - Estado de Equilíbrio e Extensão Das Reações Químicas - AlunoJoão MoreiraNo ratings yet
- LISTA_DE_EXERCCIOS_Tpico_9Document2 pagesLISTA_DE_EXERCCIOS_Tpico_9a.mendesNo ratings yet
- Lista Exercícios - Equilíbrio QuímicoDocument3 pagesLista Exercícios - Equilíbrio QuímicoMarianaCamargosNo ratings yet
- Equilíbrio químico - Lista de exercíciosDocument4 pagesEquilíbrio químico - Lista de exercíciosSamara CristinyNo ratings yet
- Equilibrio Quimico 2009Document47 pagesEquilibrio Quimico 2009Pedro LessaNo ratings yet
- EXERCICIOS CINÉTICA EQUIL Isct 12 CLASSE PDFDocument5 pagesEXERCICIOS CINÉTICA EQUIL Isct 12 CLASSE PDFKeila Jessica SamsonNo ratings yet
- Equilibrio QuimicoDocument2 pagesEquilibrio QuimicomuriloneaimeNo ratings yet
- Equilíbrio químico e cálculos termodinâmicosDocument6 pagesEquilíbrio químico e cálculos termodinâmicosOrionBuss0% (1)
- 1 Constante de Equilc3adbrioDocument32 pages1 Constante de Equilc3adbrioPROFº MARCELO SANTOSNo ratings yet
- Ângulos e TriângulosDocument3 pagesÂngulos e TriângulosVânia Maria SantosNo ratings yet
- Ficha1 - Fisica 11Document3 pagesFicha1 - Fisica 11Vânia Maria SantosNo ratings yet
- Funcionalidades MVODocument7 pagesFuncionalidades MVOVânia Maria SantosNo ratings yet
- 12 Antraquinonas NaftodiantronasDocument24 pages12 Antraquinonas NaftodiantronasVânia Maria SantosNo ratings yet
- Funções Sintáticas 1Document1 pageFunções Sintáticas 1Vânia Maria SantosNo ratings yet
- Análise de Gráficos MovimentosDocument2 pagesAnálise de Gráficos MovimentosVânia Maria SantosNo ratings yet
- Análise de gráficos de movimentosDocument5 pagesAnálise de gráficos de movimentosDiana Isabel VieiraNo ratings yet
- Acidos CarboxilicosDocument40 pagesAcidos CarboxilicosVânia Maria SantosNo ratings yet
- Flyer Original ImpressãoDocument1 pageFlyer Original ImpressãoVânia Maria SantosNo ratings yet
- Aquecimento Global + Correção PDFDocument3 pagesAquecimento Global + Correção PDFCarla100% (2)
- Ficha Sobre Sismicidade PDFDocument4 pagesFicha Sobre Sismicidade PDFVânia Maria SantosNo ratings yet
- Teste de Ciências Naturais 8o anoDocument4 pagesTeste de Ciências Naturais 8o anosovilela100% (1)
- Recurso PDFDocument7 pagesRecurso PDFVânia Maria SantosNo ratings yet
- A.2.7 - Impulsão - Ficha de TrabalhoDocument1 pageA.2.7 - Impulsão - Ficha de TrabalhoVânia Maria SantosNo ratings yet
- O relógio de ShmuelDocument5 pagesO relógio de ShmuelmarcopereiraeslNo ratings yet
- Lei Dos Senos e Lei Dos Cossenos Aula 07Document11 pagesLei Dos Senos e Lei Dos Cossenos Aula 07Vânia Maria SantosNo ratings yet
- Processos de FossilizaçãoDocument1 pageProcessos de FossilizaçãoVânia Maria SantosNo ratings yet
- Ciências Naturais Objetivos7 Nov2016Document1 pageCiências Naturais Objetivos7 Nov2016Vânia Maria SantosNo ratings yet
- Sebenta HematologiaDocument386 pagesSebenta HematologiaTiago Teixeira100% (3)
- FichaAvaliação7 GlobalDocument6 pagesFichaAvaliação7 GlobalVânia Maria SantosNo ratings yet
- 2017 - Vírus Da Hepatie CDocument16 pages2017 - Vírus Da Hepatie CVânia Maria SantosNo ratings yet
- Apontamentos Sobre o Império RomanoDocument7 pagesApontamentos Sobre o Império RomanoVânia Maria SantosNo ratings yet
- 2017 - 4 Casos Clínicos HBVDocument7 pages2017 - 4 Casos Clínicos HBVVânia Maria SantosNo ratings yet
- GPS e queda de corpos na LuaDocument8 pagesGPS e queda de corpos na LuaVânia Maria SantosNo ratings yet
- 3 FamiliaPapovaviridae PapimomavirusHumanosDocument18 pages3 FamiliaPapovaviridae PapimomavirusHumanosVânia Maria SantosNo ratings yet
- BF - Aula TP 2 - JCDocument6 pagesBF - Aula TP 2 - JCVânia Maria SantosNo ratings yet
- Vírus da Hepatite B (HBV): Características e ReplicaçãoDocument25 pagesVírus da Hepatite B (HBV): Características e ReplicaçãoVânia Maria SantosNo ratings yet
- Aula MacroinvertebradosDocument33 pagesAula MacroinvertebradosVânia Maria SantosNo ratings yet
- Livro 1Document1 pageLivro 1Vânia Maria SantosNo ratings yet
- Ionização e Dissociação Iónica. Autoionização Da ÁguaDocument24 pagesIonização e Dissociação Iónica. Autoionização Da ÁguaAna Celia MendesNo ratings yet
- Lista 1Document4 pagesLista 1Tatiana Hartenberger CiscottoNo ratings yet
- Ficha de Trabalho 20Document8 pagesFicha de Trabalho 20Marta MachadoNo ratings yet
- Exercícios Sobre PH e pOHDocument3 pagesExercícios Sobre PH e pOHQuímicatualizadaNo ratings yet
- Exercícios - Funções InorgânicasDocument2 pagesExercícios - Funções InorgânicasMarcella AlvesNo ratings yet
- 11FQA Ficha Trab Ini Q2.1 - N.º 1 - SoluçãoDocument5 pages11FQA Ficha Trab Ini Q2.1 - N.º 1 - SoluçãoAndrei GalanNo ratings yet
- Relatório Titulação CondutométricaDocument8 pagesRelatório Titulação CondutométricaKarina RodriguesNo ratings yet
- Lista 3 Produto Ionico Da Água - GabaritoDocument6 pagesLista 3 Produto Ionico Da Água - GabaritomateusNo ratings yet
- Reações ácido-base experimento UFSMDocument11 pagesReações ácido-base experimento UFSMNatália NetoNo ratings yet
- Relatório prática identificação pHDocument2 pagesRelatório prática identificação pHAlex SantosNo ratings yet
- Relatório Laboratorial - Acido Forte - Base ForteDocument12 pagesRelatório Laboratorial - Acido Forte - Base ForteSofiaPinheiro100% (2)
- Indicador de repolho roxo revela pHDocument3 pagesIndicador de repolho roxo revela pHMonique Meireles PereiraNo ratings yet
- Questionario 1 - QAG2Document2 pagesQuestionario 1 - QAG2ALINE BEATRIZ SOARES PASSERININo ratings yet
- Construção Da Curva de TitulaçãoDocument19 pagesConstrução Da Curva de TitulaçãoIgor Botelho De AlmeidaNo ratings yet
- Lista de Exercício 1º Ano C - OutubroDocument2 pagesLista de Exercício 1º Ano C - OutubroCristiane FelixNo ratings yet
- Ácido BaseDocument3 pagesÁcido BaseLuciara MafraNo ratings yet
- Métodos potenciométricos para análise de amostras ácidasDocument21 pagesMétodos potenciométricos para análise de amostras ácidasBruno Oliveira100% (1)
- Equilíbrio Ácido-BaseDocument3 pagesEquilíbrio Ácido-BaseAngela Zandamela0% (1)
- AlcalinidadeDocument2 pagesAlcalinidadeArão Massindo MassindoNo ratings yet
- pH, tampões e indicadores colorimétricosDocument4 pagespH, tampões e indicadores colorimétricosCor BanNo ratings yet
- Exercícios Química SoluçõesDocument9 pagesExercícios Química Soluçõesgilliane santosNo ratings yet
- Cenro Universitário de Sete LagoasDocument13 pagesCenro Universitário de Sete LagoasElizangela GomesNo ratings yet
- Cálculos de equilíbrio químico para reações gasosasDocument2 pagesCálculos de equilíbrio químico para reações gasosasvitorNo ratings yet
- Testo de Apoio Equilibrio QuimicoDocument18 pagesTesto de Apoio Equilibrio QuimicoMira Luis BasilioNo ratings yet
- Equil Brio Qu MicoDocument3 pagesEquil Brio Qu Micodaniel_nrnNo ratings yet
- Relatório 1 - PH e Tampões - Parte 3Document3 pagesRelatório 1 - PH e Tampões - Parte 3Junior CastagnolliNo ratings yet
- Equilíbrio Químico: Fatores que InfluenciamDocument56 pagesEquilíbrio Químico: Fatores que InfluenciamEvisson de S. TavaresNo ratings yet
- Química Analítica - Ácidos e BasesDocument34 pagesQuímica Analítica - Ácidos e BasesMaria Eduarda Simplicio Da SilvaNo ratings yet
- Determinação dos pontos finais da titulação de Na2CO3 e NaOH por titulação diferencialDocument9 pagesDeterminação dos pontos finais da titulação de Na2CO3 e NaOH por titulação diferencialThanara ZanetiNo ratings yet