Professional Documents
Culture Documents
C01 Cinetique Correction
Uploaded by
Med BriniCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
C01 Cinetique Correction
Uploaded by
Med BriniCopyright:
Available Formats
CALCULATRICES INTERDITES
CORRECTION CONTROLE n1 SCIENCES PHYSIQUES TS1 27/09/2008
Il sera tenu le plus grand compte de la clart de l'expression, de l'orthographe et de la grammaire. Les questions
apparaissent en italique, les donnes en caractres ordinaires.
I- Dans cet exercice, on tudie la raction lente d'oxydorduction entre les ions peroxodisulfate S 2082- et les ions
iodure I- en solution aqueuse. Les couples redox qui interviennent sont : S 2082- / S042- et l2 / I-.
Dans un bcher, on introduit un volume V 1 = 40 mL d'une solution aqueuse de peroxodisulfate de potassium
(contenant des ions K+ et S2082-) de concentration C1 = 1,0 x 10-1 mol.L-1 (en ions peroxodisulfate)
linstant t = 0 s, on ajoute un volume V 2 = 60 mL d'une solution aqueuse d'iodure de potassium (contenant des
ions K+ et I-) de concentration C2 = 1,5 x 10-1 mol.L-1. Les ions potassium K+ sont spectateurs dans la raction qui
dmarre alors.
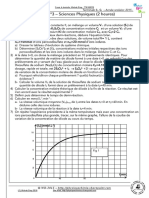
2 0 ,8
G en m S
2 0 ,6
Un dispositif lectrique permet de suivre l'volution
2 0 ,4
de la conductance G de la solution au cours du
2 0 ,2 temps. La courbe obtenue est reproduite ci-contre.
2 0 ,0
1 9 ,8
1 9 ,6
1 9 ,4
1 9 ,2
t en s
1 9 ,0
0 30 60 90 120 150 180 210
1- crire les demi-quations ainsi que le bilan global de la raction entre les ions peroxodisulfate et les ions
iodure.
2- Par un tableau d'avancement, dterminer, en mmol, la valeur x max de lavancement maximal de cette raction
(on se contentera de 1 chiffre significatif).
3- Calculer, en mol.L-1, la concentration des ions K + dans le mlange ractionnel. On donnera autant de chiffres
significatifs que la prcision des donnes permet.
4- En notant x l'avancement de la raction l'instant t, donner les expressions (littrales) des concentrations des
divers ions prsents dans le mlange en fonction de x et du volume V du mlange ractionnel.
On ngligera les ions H+ et OH- trs minoritaires en quantit par rapport aux autres ions.
5- On rappelle que la conductance G d'une telle solution a pour expression
G = k . ( 1 . [S2082-] + 2 . [I-] + 3 . [S042-] + 4 . [K+] )
o les i sont les conductivits molaires ioniques et k la constante de cellule.
5-1 Quelle est la signification prcise de la constante k ?
5-2 Rappeler les units de base (dans le SIU, systme international d'units) des diverses grandeurs contenues
dans cette expression.
5-3 (Ne pas passer plus de 5 minutes sur cette question. Le cas chant, on admettra dans la suite, le rsultat).
Montrer, par un calcul littral, que la relation entre la conductance G et l'avancement x de la raction est de la
1
forme G .( A.x B) o V est le volume total de la solution (suppos constant pendant toute la dure de
V
l'exprience) et A,B deux constantes dont on dterminera l'expression littrale en fonction des donnes.
6- Expliquer pourquoi la courbe donnant G en fonction du temps, ne passe pas par l'origine.
7- Pour la suite de l'tude, on donne les valeurs des constantes (dans les conditions de l'exprience) : A = 42
mS.L.mol-1 et B = 1,9 mS.L.
7-1 Justifier ces units par analyse dimensionnelle.
1
7-2 Quel est lintrt de la relation G .( A.x B) ?
V
D. KRAUSS Lyce Prier Marseille page 1 sur 5
CALCULATRICES INTERDITES
8- A partir de la courbe, dterminer, en mmol, la valeur x max de lavancement maximal de cette raction (on se
contentera de 1 chiffre significatif). Comparer avec la valeur obtenue la question 2.
CORRECTION
1- Dans cette raction, les ions I- sont oxyds en molcules I2 selon le schma : 2 I- l2 + 2 e-
Simultanment, les ions S2082- sont rduits en ions S042- par : S2082- + 2 e- 2 S042-
Le bilan global peut ainsi s'crire : S2082- + 2 I- l2 + 2 S042-
2- La solution de peroxodisulfate de potassium contient C 1.V1 mol d'ions S2082-. Numriquement, il y en a 40.10 -3 L
. 1,0.10-1 mol.L-1 soit 4 mmol environ.
Cette solution contient aussi des ions K +, ncessairement deux fois plus nombreux que les prcdents
(lectroneutralit de la solution). Il y en a donc 8 mmol environ.
D'autre part, la solution d'iodure de potassium contient autant d'ions iodure que d'ions K +. Il y en a ainsi une
quantit C2.V2 de chaque sorte. Numriquement, il y a 60.10 -3 L . 1,5.10-1 mol.L-1 soit 9 mmol environ de chaque
type d'ions.
En rsum, dans le mlange ractionnel, au dpart, il y a 4 mmol d'ions S 2082-, 9 mmol d'ions I- et 17 mol d'ions
K +.
Le bilan de la raction, expression des lois de conservation, impose que deux fois plus d'ions iodure que d'ions
peroxodisulfate disparaissent. En consquence, il y a un lger excs d'ions iodure : il en restera 1 mmol la fin
de la raction et tous les ions peroxodisulfate auront disparu.
En d'autres termes, l'avancement maximal de la raction vaudra environ 4 mmol.
3- Le dnombrement des ions prsents au dpart a montr qu'il y a 17 mmol d'ions potassium dans le mlange
ractionnel. Ces ions tant spectateurs dans la raction, la concentration de ces ions dans le mlange (de
volume total constant de 100 mL) vaudra en permanence 17 mmol / 100 mL soit 0,17 mmol.mL -1 ou, ce qui
revient au mme, 0,17 mol.L-1.
4- A un instant t donn de l'avancement de la raction, les ions prsents sont des ions K +, I-, S2082-,et S042-. Leurs
concentrations respectives peuvent s'crire en fonction de la valeur x(t) de l'avancement cet instant :
K 2.C V.V VC .V S O CV.V V x
1 1
1
2
2
2
2
2
8
1 1
1 2
I C V.V V2.x
2
1
2
2
et SO V 2.xV
2
4
1 2
5-1 et 2 Une solution aqueuse se comporte lectriquement comme un conducteur ohmique. Sa conductance
dpend la fois des caractristiques gomtriques des lectrodes utilises ainsi que de la concentration et du
type des divers ions prsents dans la solution. Plus prcisment, cette dpendance se traduit algbriquement par
la relation : G = . S/L o dsigne un coefficient de proportionnalit qui ne dpend que de la solution et non
des lectrodes utilises ( est appel conductivit de la solution). Le rapport S/L ne dpend que du type
dlectrodes utilises, se note k et sappelle la constante de cellule. La relation G = . k spare ainsi le rle de la
solution et de la cellule.
Enfin, la conductivit de la solution utilise dpend de la nature des espces ioniques prsentes (leur
mobilit ) ainsi que de leur concentration et de la temprature globale de la solution. Plus prcisment,
la conductivit peut scrire comme une somme de contributions pour chaque type dions prsents :
Concentration du type
i.
chaque type d' ions numro i
d'ions prsents
Dans chaque contribution, i caractrise le type dions indpendamment de leur concentration. Cette
grandeur, indpendante de la quantit dions, dpend fortement de la temprature et se nomme
conductivit molaire ionique du type dions considr.
Du point de vue des units, une analyse dimensionnelle montre que, dans les units de base du systme
international :
La conductance G sexprime en A.V-1 (ou Siemens : S)
La constante de cellule k sexprime en m
La conductivit s sexprime en S.m-1
Une concentration despce sexprime en mol.m-3
Une conductivit molaire ionique sexprime en S.m2.mol-1
D. KRAUSS Lyce Prier Marseille page 2 sur 5
CALCULATRICES INTERDITES
5-3 Dans le mlange ractionnel considr ici, il y a 4 types dions prsents dont les concentrations
changent dans le temps (sauf pour lespce spectatrice). Par consquent, linstant t, lexpression de la
conductance G(t) scrit :
G( t ) k . 1.[S2O82 ] 2 .[I ] 3 .[SO24 ] 4 .[K ]
et, en utilisant les expressions des diverses concentrations obtenues la question prcdente :
k
G( t ) . 1.(C1.V1 - x) 2 .(C2 .V2 - 2.x) 3 .2.x 4 .(2.C1.V1 C 2 .V2 )
V
En regroupant, dans lexpression entre crochets, les termes qui dpendent de x (et donc du temps) des
termes constants, on obtient :
k
G( t ) . 2.3 1 2. 2 .x C1.V1. 1 2. 4 C2 .V2 . 2 4
V
Cette expression est de la forme :
1
G( t ) . A.x B o A k. 2.3 1 2. 2 et B k. C1.V1. 1 2. 4 C 2 .V2 . 2 4
V
Autrement dit, la conductance G est une fonction affine croissante de lavancement x qui lui-mme est une
fonction croissante du temps. La conductance G est donc en dfinitive une fonction croissante du temps
(ce que confirme la courbe exprimentale).
Les constantes A et B sexpriment, dans les units de base du systme international, respectivement en
S.m3.mol-1 et en S.m3.
6- A l'instant initial, la solution contient dj des ions et, ce titre, est conductrice de l'lectricit. Sa
conductance n'est donc pas nulle cette instant.
7-1 A la question 5-3, on a tabli que les units SI des constantes A et B. On peut, bien sr, aussi les
rexprimer en utilisant le milliSiemens au lieu du Siemens pour les conductances et le litre au lieu du m 3
pour les volumes. Ainsi, les constantes A et B peuvent parfaitement s'exprimer respectivement en
mS.L.mol-1 et en S.L.
7-2 La relation tablit un lien trs simple(fonction affine) entre G et x. La conductance G est une grandeur
physique qu'on peut aisment mesurer en continu (sans aucune "manipulation, ni destruction de la
solution). On dispose ainsi d'un moyen indirect d'accder exprimentalement aux volutions de
l'avancement x de la raction.
8- Daprs la relation vrifie tout instant entre G et x, on dduit la ncessaire relation entre les valeurs
1 1
finales (et maximales de G et de x) : Gmax . A.x max B ou encore : x max Gmax .V B
V A
Le graphe donn permet de lire la valeur approximative de Gmax : 20,65 mS environ.
Numriquement,
1 0,165 mS.L 0,165 165
x max
1
20,65 mS . 0,100 L 1,9 mS.L 1
mol mmol 4mmol
42 mS.L.mol 42 mS.L.mol 42 42
A la prcision des calculs, on retrouve la valeur prvue par les lois de conservation
D. KRAUSS Lyce Prier Marseille page 3 sur 5
CALCULATRICES INTERDITES
II- Leau oxygne est une solution aqueuse contenant des molcules H 2O2. Une telle solution est instable : les
molcules H2O2 se dissocient trs lentement et spontanment en molcules H 2O et O2(g) si bien quau terme de
cette dissociation, cette solution sest transforme en eau. L'autre produit form est du gaz dioxygne qui
svacue dans latmosphre.
Sur un flacon deau oxygne, on lit eau oxygne 130 volumes . Cela signifie quun volume donn de cette
solution, a libr, au terme de sa lente dissociation, 130 fois ce volume en gaz dioxygne (gaz pris dans les
conditions dites "normales de temprature et de pression" o le volume molaire des gaz vaut 22,4 L.mol -1).
1- Par un calcul numrique d'ordre de grandeur, montrer que le volume molaire des gaz pris 0,00C et 1013
hPa est effectivement de l'ordre de 20 litres (on dtaillera les tapes du calcul).
2- Ecrire le bilan de la raction de dissociation lente.
3- Dans la liste de valeurs suivantes, dire quelle est celle de la concentration en molcules H 2O2 dans une eau
oxygne 130 volumes avant toute dissociation.
0,0580 0,116 0,580 1,16 5,80 11,6 58,0 116
On justifiera la valeur choisie (autant qu'on puisse le faire sans calculatrice) et on prcisera son unit.
On dispose dun flacon tiquet eau oxygne 130 volumes et on veut vrifier que cette solution ne sest
pratiquement pas dissocie. Pour cela on en prlve 10,0 mL et on dose cet chantillon avec une solution titrante
de permanganate de potassium (acidifie en excs par lacide sulfurique) telle que [MnO 4-] 0,100 mol.L-1.
4- Par un schma lgend, dcrire le dispositif exprimental utilis pour le dosage.
5- Dfinir, de faon gnrale, l'quivalence d'un dosage.
6- Dcrire le protocole exprimental du dosage. En particulier, comment sait-on concrtement qu'on est parvenu
l'quivalence ?
La raction de dosage est une raction rapide d'oxydo-rduction faisant intervenir les couples MnO 4-(aq) / Mn2+
(aq) et O2(g) / H2O2(aq)
7- Ecrire les demi-quations ainsi que le bilan global.
8- Calculer la valeur (avec 1 chiffre significatif) du volume de solution titrante qu'on devrait verser pour doser
cette eau oxygne suppose neuve ?
9- Est-il raliste de procder ainsi ? Proposer une modification du protocole.
CORRECTION
1- La loi de comportement des gaz (dite "loi des gaz parfaits) stipule qu'une mole d'un gaz quelconque occupe un
R.T
volume Vm donn par la relation Vm o T dsigne la temprature (en Kelvins) du gaz, P, la pression (en
P
Pa) du gaz et R, une constante universelle (la mme valeur pour tous les gaz, pris dans n'importe quelles
conditions).
Numriquement, dans les conditions de l'nonc :
8,31USI . 273 K 8,31.2,73 10 2 3 8,31.2,73 10 2 8,31.2,73
Vm . m .mol1 . .103 L.mol1 L.mol1
1013.10 2 Pa 1,013 10 5 1,013 10 5 1,013
En arrondissant les nombres figurant dans l'expression aux entiers les plus proches, on trouve 24 L.mol -1. Valeur
du mme ordre de grandeur que le rsultat fourni par l'nonc.
2- Le bilan de cette dissociation lente de l'eau oxygne s'crit : 2 H 2O2(aq) 2 H2O(L) + O2(g)
3- Un litre d'eau oxygne est susceptible de librer 130 litres de gaz dioxygne pris dans les conditions dites
"normales de temprature et de pression".
Par consquent, ce volume de gaz contient 130 L / 22,4 L.mol-1 soit, approximativement 6 mol de molcules O2.
Le bilan de la dissociation impose que l'apparition de ces 6 mol ait caus la disparition de 12 mol de molcules
H2O2.
A la prcision des calculs numriques mens ici, on en dduit que la concentration en molcules H 2O2. est
voisine de 12 mol.L-1.
D. KRAUSS Lyce Prier Marseille page 4 sur 5
CALCULATRICES INTERDITES
La liste de valeurs donnes contient 11,6 qui est donc la valeur plus prcise de cette concentration, exprime en
mol.L-1.
4- Voir schma ci contre
5- L'quivalence est le moment d'un dosage o on a ajout juste assez de solution
titrante dans le rcipient contenant l'chantillon de solution titre pour :
- que toutes les espces titres initialement prsentes dans l'chantillon titr aient
disparu dans le rcipient
et
- que toutes les espces titrantes introduites aient galement disparu dans le
rcipient.
6- Parmi toutes les espces intervenant dans cette raction de dosage, la seule qui donne une coloration est l'ion
MnO4- (coloration violette intense mme en faible concentration). Le passage par l'quivalence se traduira
concrtement notre chelle par la disparition brutale de la coloration violette du mlange. Ce changement de
teinte se produit en l'espace de deux gouttes de solution titrante. Le fait de lgrement dpasser l'quivalence se
traduit par une erreur infime sur la lecture du volume.
7- En milieu acide, le bilan dtaill puis global de cette raction doxydorduction scrit :
Oxydation : H2O2(aq) O2(g) + 2 H+(aq) + 2 e-
Rduction : MnO4-(aq) + 8 H+(aq) + 5 e- Mn2+(aq) + 4 H2O
Bilan global : 2 MnO4-(aq) + 5 H2O2(aq) + 6 H+(aq) 2 Mn2+(aq) + 5 O2(g) + 8 H2O
8- Si 1 L de solution "neuve", contient 11,6 mol de molcules H 2O2, alors 10 mL en contient seulement
0,116 (ou 116 mmol)
Daprs le bilan global, lquivalence du dosage (lorsquon a apport juste assez de solution titrante pour
que toutes les molcules H2O2 aient disparu), on ajout 2/5. 116 mmol dions MnO 4- soit environ 45 mol.
Cela correspond un volume de solution titrante denviron 45 mmol / 0,100 mmol.mL -1 soit 450 mL environ.
9- Un tel volume nest non seulement pas mesurable en un seul versement avec une burette standard de
25 mL mais conduirait gcher beaucoup de solution titrante inutilement.
On pourra avantageusement (meilleures prcision et conomie !) diluer par exemple 100 fois lchantillon
(en plaant, les 10 mL deau oxygne concentre dans une fiole de 1000 mL, en compltant avec de
leau ; on prlve , par exemple 20 mL de cette solution dilue ; on dose cet chantillon qui contient donc
50 fois moins de molcules H2O2.
Si leau oxygne est neuve , on aura besoin de 9,3 mL de solution titrante ce qui est la fois plus
raisonnable en quantit et mesurable avec prcision la burette.
D. KRAUSS Lyce Prier Marseille page 5 sur 5
You might also like
- 2008 09 Antilles Exo3 Sujet Titrage DemiEq PKa 4ptsDocument2 pages2008 09 Antilles Exo3 Sujet Titrage DemiEq PKa 4ptsMed BriniNo ratings yet
- Cours Physique Nature Ondulatoire de La Lumiere Sciences2016 Eleve1Document4 pagesCours Physique Nature Ondulatoire de La Lumiere Sciences2016 Eleve1Med BriniNo ratings yet
- Suivi CinetiqueDocument7 pagesSuivi CinetiqueMed BriniNo ratings yet
- D3 TS2 2017 Copel WahabdiopDocument2 pagesD3 TS2 2017 Copel WahabdiopMed BriniNo ratings yet
- Ac - Base 1Document2 pagesAc - Base 1Med BriniNo ratings yet
- Particule Dans Champ ElectDocument1 pageParticule Dans Champ ElectMed BriniNo ratings yet
- Devoir de Synthese N - 1-2Document5 pagesDevoir de Synthese N - 1-2Med BriniNo ratings yet
- Physique Terminale PDFDocument175 pagesPhysique Terminale PDFMed Brini100% (2)
- On Réalise Le Montage Schématisé CiDocument11 pagesOn Réalise Le Montage Schématisé CiMed BriniNo ratings yet
- 2009 Afrique Exo3 Sujet Quantique Brahic 4ptsDocument3 pages2009 Afrique Exo3 Sujet Quantique Brahic 4ptsla physique selon le programme FrançaisNo ratings yet
- CO1 TS2 2016 LSLL WahabdiopDocument4 pagesCO1 TS2 2016 LSLL WahabdiopMed BriniNo ratings yet
- Sal-Dev 2 15-16 TS2Document2 pagesSal-Dev 2 15-16 TS2Med BriniNo ratings yet
- D3 TS1 2016 LSLL Full WahabdiopDocument3 pagesD3 TS1 2016 LSLL Full WahabdiopMed BriniNo ratings yet
- Project NavireDocument3 pagesProject NavireMed BriniNo ratings yet
- D5 TS1 2016 LSLL Wahabdiop PDFDocument3 pagesD5 TS1 2016 LSLL Wahabdiop PDFMed BriniNo ratings yet
- Le Livre de PHYSIQUE - CHIMIE 1er S PDFDocument88 pagesLe Livre de PHYSIQUE - CHIMIE 1er S PDFالغزيزال الحسن EL GHZIZAL Hassane89% (44)
- CO2 TS2 2016 LSLL Interrompu WahabdiopDocument4 pagesCO2 TS2 2016 LSLL Interrompu WahabdiopMed BriniNo ratings yet
- D3 TS2 2017 Copel WahabdiopDocument2 pagesD3 TS2 2017 Copel WahabdiopMed BriniNo ratings yet
- Sal-Dev 1 15-16 TS3Document3 pagesSal-Dev 1 15-16 TS3Med BriniNo ratings yet
- CO1 TS1 2016 Lolb Wahabdiop-1Document4 pagesCO1 TS1 2016 Lolb Wahabdiop-1Med Brini0% (1)
- CO1 TS2 2016 LSLL WahabdiopDocument4 pagesCO1 TS2 2016 LSLL WahabdiopMed BriniNo ratings yet
- D0 TS2 2006 LSLL Ramplacement WahabdiopDocument2 pagesD0 TS2 2006 LSLL Ramplacement WahabdiopMed BriniNo ratings yet
- D0 TS2 2006 LSLL Ramplacement WahabdiopDocument2 pagesD0 TS2 2006 LSLL Ramplacement WahabdiopMed BriniNo ratings yet
- D2 TS1 2016 Lolb WahabdiopDocument4 pagesD2 TS1 2016 Lolb WahabdiopMed BriniNo ratings yet
- Sal-Dev 2 15-16 TS2Document2 pagesSal-Dev 2 15-16 TS2Med BriniNo ratings yet
- Le Livre de PHYSIQUE - CHIMIE 1er S PDFDocument88 pagesLe Livre de PHYSIQUE - CHIMIE 1er S PDFالغزيزال الحسن EL GHZIZAL Hassane89% (44)
- Sal-Dev 2 15-16-TS3Document3 pagesSal-Dev 2 15-16-TS3Med BriniNo ratings yet
- Exercices Champs Electrique Et Energie Potntielle Electrique SM 12 PDFDocument3 pagesExercices Champs Electrique Et Energie Potntielle Electrique SM 12 PDFMed BriniNo ratings yet
- Exercices Champs Electrique Et Energie Potntielle Electrique SM 12 PDFDocument3 pagesExercices Champs Electrique Et Energie Potntielle Electrique SM 12 PDFMed BriniNo ratings yet
- Présentation de La Leçon - Équations Trigonométriques Simples - NagwaDocument2 pagesPrésentation de La Leçon - Équations Trigonométriques Simples - NagwasodinosdnNo ratings yet
- Correction Serie 05 - Decisions D'investissementsDocument5 pagesCorrection Serie 05 - Decisions D'investissementsmohameddhia ajmiNo ratings yet
- Le Rôle de L Analogie en Théologie DogDocument498 pagesLe Rôle de L Analogie en Théologie DogS.R. PaineNo ratings yet
- Grille de Validation Des Attendus Élève - 6emeDocument2 pagesGrille de Validation Des Attendus Élève - 6emeJohanJorbbyNo ratings yet
- Carnier D'exercices Types ItmDocument26 pagesCarnier D'exercices Types ItmEPHRICE KITENGE BIN MAKENGONo ratings yet
- CRPE - Orthographe, GrammaireDocument3 pagesCRPE - Orthographe, GrammairePhilippe BriendNo ratings yet
- Abbas Lina IkramDocument8 pagesAbbas Lina IkramkalimiraNo ratings yet
- 02 10 241 PDFDocument87 pages02 10 241 PDFRora ÄsNo ratings yet
- Devoir Commun Frévier 2022 TERMINAL KesselDocument11 pagesDevoir Commun Frévier 2022 TERMINAL KesselNaouma ChahdNo ratings yet
- Math 1ere DDocument206 pagesMath 1ere DGeorgesNo ratings yet
- C4M Isométries (Cours)Document4 pagesC4M Isométries (Cours)Seif SouidNo ratings yet
- Etude MouvementDocument3 pagesEtude MouvementJean Leonardo100% (1)
- Examen 1 Corr 2015 FRDocument3 pagesExamen 1 Corr 2015 FRchaddad abdllahNo ratings yet
- TD m1 Notions de CinematiqueDocument1 pageTD m1 Notions de CinematiqueMdzayd EL Fahime100% (1)
- CH2 - Technologies Cibles Pour Les Systèmes Sur Puce - CodesignDocument24 pagesCH2 - Technologies Cibles Pour Les Systèmes Sur Puce - CodesignMed Aymen MessaoudiNo ratings yet
- Devoir de Contrôle N°1 Avec Correction 2010 2011 (Abdessatar)Document4 pagesDevoir de Contrôle N°1 Avec Correction 2010 2011 (Abdessatar)Ameni FerchichiNo ratings yet
- E - Chapitre 5 Processus de ChargementDocument4 pagesE - Chapitre 5 Processus de ChargementMova GatalassNo ratings yet
- 3 Les Vannes de Reglage-IiiDocument4 pages3 Les Vannes de Reglage-IiiSirineJamoussiNo ratings yet
- Cours Info Appliquée S6 - 2020Document92 pagesCours Info Appliquée S6 - 2020AYOUBNo ratings yet
- BiochimieDocument78 pagesBiochimieZoumana CoulibalyNo ratings yet
- 43 Tutorial Assemblage VanneDocument6 pages43 Tutorial Assemblage VanneAkram Ben KhemisNo ratings yet
- UntitledDocument17 pagesUntitledCyrille LamasséNo ratings yet
- Forces Et Champs2Document3 pagesForces Et Champs2MechoupiewouoNo ratings yet
- Cours - GP-L2-Méthode Numérique Génie Des ProcédésDocument68 pagesCours - GP-L2-Méthode Numérique Génie Des ProcédésZakaria Bba100% (1)
- Cours m1 Econometrie Appliquee Slide3Document23 pagesCours m1 Econometrie Appliquee Slide3Wajdi Frikha100% (1)
- Cem - Td1 - Enet'Com: Exercice 1Document4 pagesCem - Td1 - Enet'Com: Exercice 1asma nsiriNo ratings yet
- TDN 2. Etude de Fonctions: X 4+X X X+4 2 X+1 (X 2) (X+3) 2 X+1 X 1Document2 pagesTDN 2. Etude de Fonctions: X 4+X X X+4 2 X+1 (X 2) (X+3) 2 X+1 X 1Profchaari SciencesNo ratings yet
- l3 Neurophysio Chap3Document14 pagesl3 Neurophysio Chap3nobodyNo ratings yet
- Cocher Bonne Réponse:: Nom Et PrénomDocument5 pagesCocher Bonne Réponse:: Nom Et PrénommohadNo ratings yet
- Spectroscopie Chapitre 2 Et TD corrigé-L2-V2019-2020Document18 pagesSpectroscopie Chapitre 2 Et TD corrigé-L2-V2019-2020Houho DzNo ratings yet