Professional Documents
Culture Documents
Aminoacidos y Proteinas
Uploaded by
Josemaria Cambillo Martinez0 ratings0% found this document useful (0 votes)
9 views6 pagesOriginal Title
aminoacidos y proteinas.doc
Copyright
© © All Rights Reserved
Available Formats
DOC, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as DOC, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
9 views6 pagesAminoacidos y Proteinas
Uploaded by
Josemaria Cambillo MartinezCopyright:
© All Rights Reserved
Available Formats
Download as DOC, PDF, TXT or read online from Scribd
You are on page 1of 6
INTRODUCCIN
En el presente tema abordaremos aspectos generales sobre estructura
y funcin de los aminocidos y las protenas en el organismo, as como de los
medios de laboratorio para identificar a los mismos.
Por la importancia y el papel que desempea las protenas, es
necesario conocer la funcin de un grupo de ellas, como las protenas
plasmticas, para tal efecto realizaremos una revisin general de las mismas.
OBJETIVOS:
Conocer y determinar las diferentes propiedades fsicas y qumicas de
los aminocidos y protenas.
Evaluar mediante pruebas fsicas y qumicas la presencia de
aminocidos y protenas en las diferentes muestras.
Emplear tcnicas de reconocimiento de aminocidos y de protenas.
FUNDAMENTO TEORICO:
Las protenas son biopolmeros de alto peso molecular, conformadas por
unidades monomricas bsicas, denominadas aminocidos, de los
que 20 son biolgicamente importantes. La unin entre aminocidos
se forma mediante la interaccin del grupo carboxilo de un
aminocido con el grupo amino de otro para formar un enlace
peptdico. Siendo as que la adicin secuencial de aminocidos
origina un pptido y finalmente una protena. Las protenas forman
estructuras de diversas complejidades que podemos resumir en las
siguientes caractersticas biolgicas:
Ejercen y tienen relacin estrecha entre estructura y funcin (las del
msculo actan transluciendo energa mecnica).
Disponen de flexibilidad importante de su estructura, de ah su
diversidad infinita (hemoglobina, miosina, albmina, colgeno y todas en
s).
Disponen de un mecanismo de formacin que posee fidelidad absoluta e
inmutable para cada protena (esto quiere decir que cada protena tiene
una funcin determinada en el organismo).
Entre las caractersticas fsicas y qumicas de las protenas sealamos
las siguientes: La gran masa molecular de las protenas determina su
carcter coloidal en soluciones acuosas, por lo que su dimetro en
solucin es mayor a 0,001 um. Esta propiedad coloidal les confiere una
gran afinidad hacia el agua, siendo por esto muy soluble en ella. Otras
propiedades coloidales caractersticas de las protenas son: sus
diluciones tienen aspecto opalescente; producen el fenmeno de
Farady-Tyndall (ver difraccin); movimiento browniano (es el movimiento
permanente y desordenado de las partculas de materia muy pequea
(de micrmetros solamente) en el agua y otros lquidos; se debe a los
choques de las partculas con las molculas del lquido, las cuales segn
la teora cintica de la materia, se hallan sometidas constantemente a la
agitacin trmica); no son filtradas por ultrafiltracin; poseen presin
osmtica, pueden ser separadas de otros compuestos por dilisis a
travs de una membrana semipermeable.
La solubilidad proteica en agua, les permite formar sales en agua y
disoluciones acuosas de sustancias polares. Esta propiedad est ligada
a la hidratacin de sus molculas, por esto, cualquier factor que altere
esta propiedad provocar la disminucin de su solubilidad en agua y su
consecuente precipitacin. Esto ltimo podra lograrse al agregar a una
solucin acuosa proteica compuesta deshidratantes como alcohol,
acetona, soluciones de sales neutras de metales alcalinos y otros
compuestos que lograran la precipitacin proteica. Esta precipitacin
(con sales alcalinas) no produce la desnaturalizacin de las protenas,
es as, que este procedimiento es usado para separar protenas y
mantener su actividad biolgica. En resumen, la precipitacin de
protenas, consiste en la prdida de sus propiedades hidrfilas,
adquiriendo caractersticas hidrfobas, con prdida de carga elctrica.
Las protenas se comportan tambin, como electrlitos anfteros, es
decir que poseen simultneamente caractersticas de cidos y bases; se
debe tomar en cuenta que esta propiedad proteica deriva de sus bases
estructurales, los aminocidos. Un grupo anftero, como un aminocido,
puede disociar sus grupos amino y carboxlico de acuerdo al pH del
medio, siendo as que en medio cido, una protena se cargar
positivamente y en el medio alcalino ocurrir lo contrario. Esta propiedad
de los aminocidos en la estructura proteica, es utilizada para la
identificacin de las protenas por medio de la electroforesis o
cromatografa (esta ltima para diferenciar aminocidos y protenas).
Todas las reacciones para identificar aminocidos y protenas estn
basadas en la presencia de grupos qumicos, en los enlaces o en sus
propiedades fsico-qumicas. Las reacciones de reconocimiento pueden
dividirse en dos grupos independientes:
Reacciones de precipitacin: Que a su vez, pueden subdividirse en
dos grupos:
Precipitacin de protenas con desnaturalizacin que utilizan
temperatura mayor a 80C, cidos inorgnicos y orgnicos
Reacciones coloreadas: como la reaccin de Biuret, de la ninhidrina,
del cido perico, la xantoproteca, la Millon y muchas otras. Estas
reacciones permiten identificar a ciertos grupos de aminocidos de
acuerdo a los grupos funcionales que contengan. En la prctica
incidiremos en identificar aminocidos y protenas de diferentes
soluciones proteicas, por medio de estas tcnicas sencillas, que no
implican el uso de instrumentos sofisticados (hoy en da se disponen de
tcnicas de identificacin de aminocidos y protenas altamente
especializadas, como diversas formas de cromatografa automatizada, y
otras que pueden ser consultadas en libros de especializacin).
Las protenas son sustancias anfteras que pueden reaccionar con H2O
de una de estas 2 maneras: Protena - COO- + H2O Protena - COOH +
OH- Protena - COO- + H2O Protena - COOH + H3O Segn el nmero
relativo de grupos carboxilo y amino libres en la molcula, la protena en
solucin dar reaccin cida o bsica. En otras palabras, algunas
molculas de protena en solucin acuosa se cargan positivamente y
otras se cargan negativamente. Para hacer una protena elctricamente
neutra, en solucin acuosa es necesario generalmente aadir una
pequea cantidad de cido o base. El pH en el que una protena
determinada es elctricamente neutra se conoce como punto isoelctrico
de esa protena. Todas las protenas son menos solubles en el punto
isoelctrico y, algunas, como la casena, la meta protena, son
insolubles. Para la hidrlisis cida de una protena en los aminocidos
que la componen Se requiere una emisin de flujo muy prolongada. Son
macromolculas construidas a base de aminocidos, unidos por enlace
Peptdico.
Las protenas contienen C, H, O, N, casi siempre S. Actualmente hay
ms de 26 aminocidos reconocidos, de estos unos 10 se designa como
aminocidos esenciales, ya que no pueden ser sintetizados por el
organismo, sino que son: Arginina, histidina, leucina, isoleucina, lisina,
metionina, fenilalanina, triptfano, treonina, valina varan algo, segn la
especie animal. Tanto aminocidos como protenas tienen carcter
anftero, propiedad que deriva de la presencia de los grupos cidos
(carboxilo: -COOH); y bsicos (amino: -NH2), simultneamente en la
molcula, cuya interaccin intramolecular cido-base origina una forma
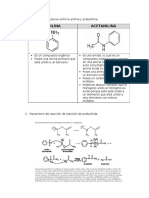
bipolar:
Cualquier variacin del pH del medio dar lugar a que predomine una de
las cargas, de aqu que se puede comportar como cido o base, segn
el pH del medio.
Las protenas pueden ser desdobladas para crear formas intermedias
de tamao y diferentes propiedades, y esto se logra por medio de
cidos, bases, enzimas: los productos de la degradacin proteica, en
orden decreciente de tamao y complejidad son: Protenas proteasas
peptonas polipticos - ppticos aminocidos amoniaco
nitrgeno elemental. Las desnaturalizacin de protenas est
relacionada con cualquier modificacin de su estructura, sin rompimiento
del enlace peptdico. Esta se puede lograr con el calor, sustancias
qumicas, alcoholes, bases, etc. Las reacciones cromticas son
reacciones coloreadas de reconocimiento de las protenas,
generalmente de las protenas conjugadas que presentan ciertos
aminocidos especficos. Por ejemplo: la reaccin Xantoproteica: sirve
para reconocer ncleos aromticos.
BIBLIOGRAFIA
Espaa, Devore, Muoz MENA, Morrison y Boyd. Qumica Orgnica G
2da. Edicin. Valencia. Pag 123 revista en Internet] 2003 septiembre-
diciembre. [acceso 19 de octubre de 2005]; 26(3). Disponible en:
https://www.ucm.es/data/cont/docs/458-2013-07-24-cap-5-proteinas.pdf
Moraga Llop FA. ngeles Carbajal Azcona. Departamento de Nutricin.
Facultad de Farmacia. Universidad Complutense de Madrid [monografa
en Internet]. Madrid: Asociacin Espaola de Quimico; 2003
[acceso 19 de diciembre de 2005].
Disponible en:https://www.ucm.es/nutricioncarbajal/
Josep Boatella Riera. Qumica y Bioqumica de los alimentos II. Edicion
Universitat Barcelona (2004). Biologa Molecular de la Clula [Libro en
Internet]. Alberts y col. Edit. Omega. Espaa (2004). Pag. 103-132 1
ediccion 2004 [acceso 19 de febrero de 2004].Disponible
en:http://www.nlm.nih.gov/medlineplus/spanish/ency/article/002222.htm
You might also like
- Clase1 Jerarquia de Las LeyesDocument7 pagesClase1 Jerarquia de Las LeyesJosemaria Cambillo MartinezNo ratings yet
- Clase2 - Ley SaludDocument8 pagesClase2 - Ley SaludJosemaria Cambillo MartinezNo ratings yet
- Clase1 Jerarquia de Las LeyesDocument7 pagesClase1 Jerarquia de Las LeyesJosemaria Cambillo MartinezNo ratings yet
- Diclofenaco 2Document12 pagesDiclofenaco 2Josemaria Cambillo MartinezNo ratings yet
- Anemia ApsDocument2 pagesAnemia ApsJosemaria Cambillo MartinezNo ratings yet
- Taller Cálculo de Dosis PDFDocument3 pagesTaller Cálculo de Dosis PDFAlux GomezNo ratings yet
- Ass Sintesis PurificacionDocument6 pagesAss Sintesis Purificacioncristian068No ratings yet
- Organica CuestionarioDocument2 pagesOrganica CuestionarioJosemaria Cambillo MartinezNo ratings yet
- Examen de Tecnicos de Farmacia de ClinicasDocument61 pagesExamen de Tecnicos de Farmacia de ClinicasJosemaria Cambillo Martinez100% (1)
- Manual BPMDocument107 pagesManual BPMJdaniel Gzr100% (1)
- S1 Semiología IntroduccionDocument54 pagesS1 Semiología IntroduccionJosemaria Cambillo MartinezNo ratings yet
- Anemia: causas, tipos y tratamientoDocument27 pagesAnemia: causas, tipos y tratamientoJosemaria Cambillo MartinezNo ratings yet
- Cuadro de Resultado de SolubilidadDocument1 pageCuadro de Resultado de SolubilidadJosemaria Cambillo MartinezNo ratings yet
- Faramcia Sala de OperacionesDocument3 pagesFaramcia Sala de OperacionesJosemaria Cambillo MartinezNo ratings yet
- Tamizaje FitoquímicoDocument1 pageTamizaje FitoquímicoJosemaria Cambillo MartinezNo ratings yet
- Tarea Excellll Josemaria UltimoDocument6 pagesTarea Excellll Josemaria UltimoJosemaria Cambillo MartinezNo ratings yet
- Uva y VinoDocument19 pagesUva y Vinojoaquinescobar911No ratings yet
- Excel CorregidoDocument5 pagesExcel CorregidoDAYANA JAZMIN MERINO ANDRADENo ratings yet
- BIO PCE T3 SolucionesDocument8 pagesBIO PCE T3 SolucionesAndrea ManziniNo ratings yet
- Determinación de la estructura primaria de péptidos mediante cromatografía y degradaciónDocument4 pagesDeterminación de la estructura primaria de péptidos mediante cromatografía y degradacióndarko_vNo ratings yet
- Clasificación de Las ProteínasDocument2 pagesClasificación de Las Proteínasadrián párraga0% (1)
- Grilla para Tarea de Ciencias NaturalesDocument3 pagesGrilla para Tarea de Ciencias NaturalesNaomi SenoskiNo ratings yet
- AminoácidosDocument3 pagesAminoácidosMontse BolañosNo ratings yet
- BIOMOLECULASDocument2 pagesBIOMOLECULASCamila EspinozaNo ratings yet
- Julio Rodriguez Tarea4 Morfo3 Josmi 2022Document3 pagesJulio Rodriguez Tarea4 Morfo3 Josmi 2022libith hurtadoNo ratings yet
- Solución Taller BioquimicaDocument5 pagesSolución Taller BioquimicaCarlos Calvache Bleicker WarrionNo ratings yet
- ADN ARN procesos vitalesDocument16 pagesADN ARN procesos vitalesLucas lucasNo ratings yet
- CITOESQUELETODocument47 pagesCITOESQUELETOcarolineNo ratings yet
- Cuales Son Las Etapas Del Proceso de TraduccionDocument10 pagesCuales Son Las Etapas Del Proceso de TraduccionLurbin J. RomeroNo ratings yet
- BioinformáticaDocument9 pagesBioinformáticaAndres SantiagoNo ratings yet
- Polimerasas Del ADNDocument2 pagesPolimerasas Del ADNAbril ChaviraNo ratings yet
- Fosforilacion Oxidativa PDFDocument44 pagesFosforilacion Oxidativa PDFMaira AriasNo ratings yet
- Reacciones de AminoacidosDocument5 pagesReacciones de AminoacidosJorge RamosNo ratings yet
- Biomoleculas OrganicasDocument5 pagesBiomoleculas OrganicasAntonio Cabrera SirlopúNo ratings yet
- Sección L Síntesis de ProteínasDocument16 pagesSección L Síntesis de ProteínasGian PolNo ratings yet
- Quimica Organica McMurry 8va Edicion-1090Document1 pageQuimica Organica McMurry 8va Edicion-1090Nicolas FajardoNo ratings yet
- 3 AMINOÁCIDOS y PeptidosDocument5 pages3 AMINOÁCIDOS y PeptidosGeorgina Cabrera100% (1)
- Citoesqueleto HDocument7 pagesCitoesqueleto HNahy Kelis ChingaliNo ratings yet
- Resu BQ AfDocument324 pagesResu BQ AfFabisol CastilloNo ratings yet
- Resumen CompiladoDocument104 pagesResumen CompiladoDanii VelezNo ratings yet
- Laboratorio ProteinasDocument12 pagesLaboratorio ProteinasSamuel Urueña Padron0% (1)
- Enzimas Parte 1Document47 pagesEnzimas Parte 1Renzo Daniel Stucchi RodriguezNo ratings yet
- TRANSCRIPCIÓNDocument21 pagesTRANSCRIPCIÓNDaniel CarpioNo ratings yet
- Ejercicio Con Tabla SmaeDocument15 pagesEjercicio Con Tabla SmaebelizondoNo ratings yet
- Tema 25Document8 pagesTema 25Elena ManchonNo ratings yet
- Regulación del operón trpDocument15 pagesRegulación del operón trpviri93No ratings yet
- Ciclo N y Biosintesis de AaDocument23 pagesCiclo N y Biosintesis de AaTahic PNo ratings yet