Professional Documents
Culture Documents
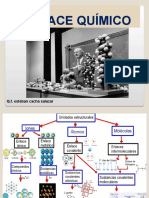
Enlaces Interatómicos
Uploaded by
AliciaMendezOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Enlaces Interatómicos
Uploaded by
AliciaMendezCopyright:
Available Formats
Enlaces interatmicos.
CLASIFICACIN:
Enlace inico o electrovalente.
Enlace covalente.
Enlace metlico.
Enlace inico:
El enlace inico es la fuerza de atraccin elctrica que existe entre los iones de cargas o puestas
(cationes aniones) que los mantienen juntos en una estructura cristalina. Resulta de la
transferencia de uno o ms electrones comnmente del metal hacia el no metal
Ejemplo: Cloruro de Sodio (NaCl)
por Karla Hernndez
Compuesto Inico:
Es aquel compuesto qumico donde existen enlaces inicos, por lo tanto no se presenta como
molcula.
Ejemplos: NaCl, CaCO3 , NH4Cl , NH4Br , Na2CO3 , KBr , MgCl2
Propiedades de los Compuestos Inicos:
1. A temperatura ambiental son slidos, cuya estructura est definida por lo que son cristalinos (la
atraccin de los iones es poli direccional)
2. Generalmente son solubles en agua y otros solventes polares como etanol, acetona, etc.
3. Tienen alta temperatura de fusin y ebullicin.
Enlace covalente:
Es la fuerza electromagntica que mantiene unidos a tomos que comparten electrones, los cuales
tienen espines o giros opuestos. Los tomos enlazados se encuentran neutros y generalmente son
no metlicos.
Ejemplo: Acido clorhdrico (HCl).
por Karla Hernndez
Propiedades de los Enlaces Covalentes:
A temperatura ambiental pueden ser slidos, lquidos o gaseosos.
Algunos pueden ser slidos cristalinos
Generalmente tienen baja temperatura de fusin y ebullicin.
Generalmente son insolubles en agua, pero si son solubles en solventes apolares
Son aislantes, es decir, son malos conductores elctricos.
Para su mejor estudio, estos enlaces se clasifican en:
Segn el nmero de pares electrnicos enlazantes
1. Enlace Simple: Cuando entre los tomos enlazados se comparten un par de electrones.
Ejemplo: Sulfuro de Hidrgeno (H2S)
por Karla Hernndez
2. Enlace Mltiple: Cuando los tomos enlazados comparten ms de un par de electrones, estos
pueden ser:
a) Enlace doble: Comparticin de dos pares de electrones.
Ejemplo: el oxgeno (O2)
por Karla Hernndez
b) Enlace triple: Comparticin de tres pares de electrones.
Ejemplo: Nitrgeno (N2)
por Karla Hernndez
Segn el nmero de electrones aportados para formar el par electrnico enlazante
1. Enlace Covalente Normal: Cada tomo aporta un electrn a la formacin del enlace.
2. Enlace Covalente Coordinado o Dativo: Solo uno de los tomos aporta el par electrnico
enlazante.
Enlace metlico:
El enlace metlico es la fuerza de atraccin producida por los cationes de un metal y el mar de
electrones de valencia deslocalizados a lo largo del slido.
En un metal los electrones de valencia estn deslocalizados (debido a su baja energa de
ionizacin) sobre el cristal entero. De hecho un metal se puede imaginar como una estructura de
cationes inmersos en un mar de electrones de valencia.
La fuerza de atraccin entre los iones y los electrones es muy fuerte lo cual explica la resistencia
mecnica de los metales, adems la movilidad de los electrones explica su conductividad elctrica.
El enlace Metlico se presenta en todos los metales si algunas aleaciones por ejemplo: latn (Cu
+Zn), bronce (Cu +Sn), etc.
CC por Wikimedia Commons
Propiedades de los metales
1) Temperaturas de fusin y ebullicin muy elevadas. Son slidos a
temperatura ambiente (excepto el mercurio que es lquido).
2) Buenos conductores de la electricidad (nube de electrones
deslocalizada) y del calor (facilidad de movimiento de electrones y de
vibracin de los restos atmicos positivos).
3) Son dctiles (facilidad de formar hilos) y maleables (facilidad de formar lminas) al aplicar
presin. Esto no ocurre en los slidos inicos ni en los slidos covalentes dado que al aplicar
presin en este caso, la estructura cristalina se rompe.
4) Son en general duros (resistentes al rayado).
5) La mayora se oxida con facilidad.
Todas estas propiedades pueden explicarse mediante el enlace metlico.
You might also like
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaFrom EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaRating: 5 out of 5 stars5/5 (1)
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseFrom EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseRating: 4.5 out of 5 stars4.5/5 (7)
- Tipos de Enlaces Interatómicos - 5to SecDocument5 pagesTipos de Enlaces Interatómicos - 5to SecFavio Mauricio GonzaNo ratings yet
- Enlace IónicoDocument5 pagesEnlace IónicoArianna PeñaNo ratings yet
- Enlaces Químicos en Los MineralesDocument7 pagesEnlaces Químicos en Los MineralesSaavedra Joe100% (1)
- Apuntes de Quimica Inorgánica Unidad 2Document33 pagesApuntes de Quimica Inorgánica Unidad 2Isidoro Valente Torres DiazNo ratings yet
- Enlaces Quimicos 1Document24 pagesEnlaces Quimicos 1Fernando SarayasiNo ratings yet
- Informe ENLACE QUMICODocument13 pagesInforme ENLACE QUMICOGuerrero AngelNo ratings yet
- Enlaces QuimicosDocument40 pagesEnlaces QuimicosMike FonsecaNo ratings yet
- Enlaces QuimicosDocument40 pagesEnlaces QuimicosSalvador Hernandez AlpizarNo ratings yet
- Enlaces QuimicosDocument40 pagesEnlaces QuimicosOscar SuarezNo ratings yet
- 1.5 Enlaces QuimicosDocument41 pages1.5 Enlaces QuimicosnikolaNo ratings yet
- Enlaces QuimicosDocument40 pagesEnlaces QuimicosKelly Roxana Peñas MoralesNo ratings yet
- Enlaces QuimicosDocument40 pagesEnlaces QuimicosjeanNo ratings yet
- Lectura 2 - Cyt - 3º Grado - Iii UnidadDocument5 pagesLectura 2 - Cyt - 3º Grado - Iii UnidadIsαbel A. Ɛspino ᑭaucarNo ratings yet
- Semana 04 Enlaces QuímicosDocument34 pagesSemana 04 Enlaces QuímicosKevin Eduardo Medina DiazNo ratings yet
- Enlaces QuimicosDocument40 pagesEnlaces QuimicosKarina LeyvaNo ratings yet
- Enlace IonicoDocument16 pagesEnlace IonicoJulia Natalia CamGz'No ratings yet
- 804 U1 - Uniones QuimicasDocument4 pages804 U1 - Uniones QuimicaswinxtexNo ratings yet
- Unidad IIIDocument8 pagesUnidad IIIRonanNo ratings yet
- I - Las Fuerzas de Enlace en Un CristalDocument28 pagesI - Las Fuerzas de Enlace en Un CristalDilan PeñaNo ratings yet
- Uniones QuìmicasDocument28 pagesUniones QuìmicasAlu AbadieNo ratings yet
- 5) B - Reporte Prác. Lab. 5 - (Sem. 6) - Enlace Qco - GHHJHKHJHDocument16 pages5) B - Reporte Prác. Lab. 5 - (Sem. 6) - Enlace Qco - GHHJHKHJHGINA FLOR HUAMANI NAJARRONo ratings yet
- Enlaces Químicos Cierre Del Módulo.Document17 pagesEnlaces Químicos Cierre Del Módulo.DANIELA SOLIS MARROQUINNo ratings yet
- Enlaces AtómicosDocument34 pagesEnlaces AtómicosBastian Alvarez Gübelin100% (19)
- Enlaces Químicos y Sus PropiedadesDocument50 pagesEnlaces Químicos y Sus PropiedadesPedro Goya100% (1)
- Enlace QuímicoDocument35 pagesEnlace QuímicoHilda Marizol Choque EstañaNo ratings yet
- Práctica N2Document2 pagesPráctica N2Freddy SojoNo ratings yet
- Enlaces Quimicos (13 Nov 13)Document32 pagesEnlaces Quimicos (13 Nov 13)Juan Juan CamaneyNo ratings yet
- 1 Enlaces y Estructura CristalinaDocument95 pages1 Enlaces y Estructura CristalinaWilmer CasnanzuelaNo ratings yet
- UnionesDocument19 pagesUnionesSandra HambergNo ratings yet
- Ejercicios TeóricosDocument22 pagesEjercicios TeóricosMar Carrasco CarrascoNo ratings yet
- Separata Enlace QuimicoDocument8 pagesSeparata Enlace QuimicoJuan MiguelNo ratings yet
- Enlaces InteratómicosDocument11 pagesEnlaces Interatómicosadrianatzec67% (6)
- QUIIMICADocument6 pagesQUIIMICAJOSUE MANUEL LOPEZ MENDOZANo ratings yet
- Uniones Químicas - Fisicoquímica 3°Document14 pagesUniones Químicas - Fisicoquímica 3°Silvia SianoNo ratings yet
- CLASE 7-Enlace QuímicoDocument59 pagesCLASE 7-Enlace Químicojhonnatan loyolaNo ratings yet
- Exposicion Enlaces QuimicosDocument34 pagesExposicion Enlaces QuimicosJorge CancinosNo ratings yet
- Enlace QuimicoDocument28 pagesEnlace QuimicoQUÍMICA33% (3)
- Enlace Iónico, Covalente y MetálicoDocument5 pagesEnlace Iónico, Covalente y MetálicoEdmundo CruzNo ratings yet
- Enlaces QuímicosDocument5 pagesEnlaces QuímicosLucia SalinasNo ratings yet
- Unidad 2 QuimicaDocument33 pagesUnidad 2 QuimicaJose ManuelNo ratings yet
- 5.1. - Apuntes Enlace QuimicoDocument5 pages5.1. - Apuntes Enlace QuimicoYuyunis De la cruzNo ratings yet
- Tema 2 B Enlace QuímicoDocument15 pagesTema 2 B Enlace QuímicoAselaNo ratings yet
- Qué Es Un Enlace IónicoDocument5 pagesQué Es Un Enlace IónicoBrithani MeraNo ratings yet
- Quimica I-Cap.4 - Enlace QuimicoDocument194 pagesQuimica I-Cap.4 - Enlace QuimicoLuis Alberto Chinchay ValverdeNo ratings yet
- Enlace QuimicoDocument28 pagesEnlace QuimicoRenzo Carrera SalasNo ratings yet
- Exposicion Enlaces QuimicosDocument34 pagesExposicion Enlaces QuimicosVicente MuñozNo ratings yet
- 2.7 Enlaces Quimicos 5Document34 pages2.7 Enlaces Quimicos 5Ismael IgnacioNo ratings yet
- Nomenclatura y Notación Química (2) - 1Document78 pagesNomenclatura y Notación Química (2) - 1LetiziaNo ratings yet
- Exposicion Enlaces Quimicos 45Document35 pagesExposicion Enlaces Quimicos 45Israel Malpica0% (3)
- IV-Enlace Quimico ADocument161 pagesIV-Enlace Quimico ABrayan Rivera ArgumedoNo ratings yet
- Q I - Lab 3-Enlace Quimico-23Document5 pagesQ I - Lab 3-Enlace Quimico-23Quimica IndustrialNo ratings yet
- 1.7 Enlaces QuímicosDocument57 pages1.7 Enlaces QuímicosEmi ZárateNo ratings yet
- Grupo 6 - Química General - Capitulo - 8Document13 pagesGrupo 6 - Química General - Capitulo - 8GabrielaNo ratings yet
- Quimica U2Document17 pagesQuimica U2Arturo A. RosalesNo ratings yet
- Imv5 Equipo 1 Practica 1Document19 pagesImv5 Equipo 1 Practica 1danielibaez155No ratings yet
- LABORATORIO SEMANA 6 ReparadoDocument25 pagesLABORATORIO SEMANA 6 ReparadoRosario aronesrengifoNo ratings yet
- Cuadro Comparativo (Tipos de Enlaces)Document5 pagesCuadro Comparativo (Tipos de Enlaces)adrielNo ratings yet
- Pesticidas Quimicos SheilaDocument37 pagesPesticidas Quimicos SheilaAliciaMendezNo ratings yet
- Pesticidas Quimico y OrganicosDocument28 pagesPesticidas Quimico y OrganicosAliciaMendezNo ratings yet
- Pesticidas QuimicosDocument41 pagesPesticidas QuimicosAliciaMendezNo ratings yet
- Tipos de Frutos y Su ClasificacionDocument7 pagesTipos de Frutos y Su ClasificacionAliciaMendezNo ratings yet
- Gasto VolumetricoDocument5 pagesGasto VolumetricoAliciaMendezNo ratings yet
- Que Es La Actitud Mental PositivaDocument4 pagesQue Es La Actitud Mental PositivaAliciaMendez33% (3)
- Principales Corrientes Filosofocos JuridicasDocument15 pagesPrincipales Corrientes Filosofocos JuridicasAliciaMendezNo ratings yet
- Que Es La AdolescenciaDocument2 pagesQue Es La AdolescenciaAliciaMendez100% (1)
- Claridad Es Un Adjetivo Que Singifica NitidezDocument5 pagesClaridad Es Un Adjetivo Que Singifica NitidezAliciaMendez0% (1)
- Glucemia CapilarDocument11 pagesGlucemia CapilarAliciaMendezNo ratings yet
- Modelo CorpuscularDocument2 pagesModelo CorpuscularAliciaMendezNo ratings yet
- Lista de Las 8 Regiones Naturales Del MundoDocument10 pagesLista de Las 8 Regiones Naturales Del MundoAliciaMendez0% (1)
- Como Saber Si Mis Argumentos Son AdecuadosDocument3 pagesComo Saber Si Mis Argumentos Son AdecuadosAliciaMendez50% (6)
- ADOLESCENCIADocument8 pagesADOLESCENCIAAliciaMendezNo ratings yet
- Características BiosocialesDocument3 pagesCaracterísticas BiosocialesAliciaMendezNo ratings yet
- Los Métodos de Tortura Que Practico La Iglesia Católica en La Edad MediaDocument9 pagesLos Métodos de Tortura Que Practico La Iglesia Católica en La Edad MediaAliciaMendezNo ratings yet
- Hoy Le He Querido CantarDocument1 pageHoy Le He Querido CantarAliciaMendezNo ratings yet
- Cáncer CervicalDocument2 pagesCáncer CervicalAliciaMendezNo ratings yet
- Hoy Le He Querido CantarDocument1 pageHoy Le He Querido CantarAliciaMendezNo ratings yet
- Reportes de Prácticas 3, 4. 5, 6 7ADocument17 pagesReportes de Prácticas 3, 4. 5, 6 7Anatalia alvarezNo ratings yet
- Actividad de Afianzamiento 7° RUTINA COMPARAR Y CONTRASTAR Abthony Herrera 7-BDocument2 pagesActividad de Afianzamiento 7° RUTINA COMPARAR Y CONTRASTAR Abthony Herrera 7-BINSTITUCION EDUCATIVA DISTRITAL LA LIBERTADNo ratings yet
- CUESTIONARIODocument4 pagesCUESTIONARIORonaldo GarzonNo ratings yet
- Unidad 4. Enlace Químico PDFDocument30 pagesUnidad 4. Enlace Químico PDFEstefania Ortiz AriasNo ratings yet
- 2093-Qm-Cuaderno de Ejercicios N°1-2016 Sa-7% PDFDocument37 pages2093-Qm-Cuaderno de Ejercicios N°1-2016 Sa-7% PDFdiegoNo ratings yet
- Planificación Quimica General 5 A y BDocument5 pagesPlanificación Quimica General 5 A y BFátima RieraNo ratings yet
- Ensayo 4° J.E.G. PAES Online-Biología 2022.pdf-5%Document42 pagesEnsayo 4° J.E.G. PAES Online-Biología 2022.pdf-5%Javier PerniaNo ratings yet
- Trabajo de Quimica (Carlos Castro)Document7 pagesTrabajo de Quimica (Carlos Castro)NANCY BRAVONo ratings yet
- Guía de Laboratorio Química Orgánica Ing PDFDocument49 pagesGuía de Laboratorio Química Orgánica Ing PDFReinaldo LizarazoNo ratings yet
- QUIMICA GuíaDocument175 pagesQUIMICA GuíaRomina Guardia100% (1)
- Practica1 ChemdrawDocument14 pagesPractica1 ChemdrawMario E. AnguianoNo ratings yet
- 2014-1 Quimica Gral. e Inorganica Prof. Isabel Ramirez Camac, Marcela Paz Plan 2013+Document4 pages2014-1 Quimica Gral. e Inorganica Prof. Isabel Ramirez Camac, Marcela Paz Plan 2013+jhonbananeroNo ratings yet
- Anexo 1 Planificación Microcurricular QuímicaDocument14 pagesAnexo 1 Planificación Microcurricular QuímicaAlejandro CalvaNo ratings yet
- Ley PeriódicaDocument29 pagesLey PeriódicaVviann Chávez GonzálezNo ratings yet
- Guia QuimicaDocument18 pagesGuia QuimicaJohan SolisNo ratings yet
- Ejercicios de Enlace Químico y Estructuras de Lewis. Gutiérrez Sánchez Oscar. BQD. 1102Document7 pagesEjercicios de Enlace Químico y Estructuras de Lewis. Gutiérrez Sánchez Oscar. BQD. 1102GUTIÉRREZ SÁNCHEZ OSCARNo ratings yet
- PDC BIOLOGIA 3er TRIMESTRE 2021Document53 pagesPDC BIOLOGIA 3er TRIMESTRE 2021WALTERNo ratings yet
- Teoría Del Enlace de ValenciaDocument3 pagesTeoría Del Enlace de ValenciamarianaNo ratings yet
- QUI - 2do TALLER - INTENSIVO 2024 - J. DÍAZ - LMDocument3 pagesQUI - 2do TALLER - INTENSIVO 2024 - J. DÍAZ - LMvasquezlimachemNo ratings yet
- Determinación IrDocument10 pagesDeterminación IrAngelo Molina100% (1)
- Tema 3 - Cuestiones y ProblemasDocument8 pagesTema 3 - Cuestiones y ProblemasDeme CueVerNo ratings yet
- AlquenosDocument19 pagesAlquenosAlonso GuilleNo ratings yet
- Tema 1. Bioelementos y El AguaDocument7 pagesTema 1. Bioelementos y El Aguapaulagp064No ratings yet
- Grado en Farmacia. Química (Curso 2015 2016) - UAX Universidad Alfonso X El SabioDocument11 pagesGrado en Farmacia. Química (Curso 2015 2016) - UAX Universidad Alfonso X El SabioLaura B.No ratings yet
- Unidad 3. Tabla PeriódicaDocument118 pagesUnidad 3. Tabla PeriódicaJilmer Alexi Caicedo BelloNo ratings yet
- Ruptura de EnlaceDocument19 pagesRuptura de EnlaceIliana FrancoNo ratings yet
- Ensayo A Las Llama y Uniones QuimicasDocument6 pagesEnsayo A Las Llama y Uniones QuimicasAguuss :DNo ratings yet
- Cuestionario Ácidos y Las BasesDocument5 pagesCuestionario Ácidos y Las BasesRuben Dario Lopez GomezNo ratings yet
- Enlaces AtomicosDocument63 pagesEnlaces AtomicosCristian Najar OcharanNo ratings yet
- BIOELEMENTOS - BIOMOLÉCULAS INORGÁNICAS - pdf1Document14 pagesBIOELEMENTOS - BIOMOLÉCULAS INORGÁNICAS - pdf1Johann HFNo ratings yet