Professional Documents
Culture Documents
Método Del Ion Electrón
Uploaded by
Agus RomeroOriginal Description:
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Método Del Ion Electrón
Uploaded by
Agus RomeroCopyright:
Available Formats
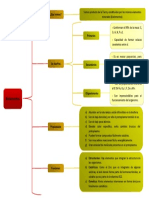
MTODO DEL ION-ELECTRN
Es un mtodo para balancear ecuaciones de xido-reduccin que ocurren en solucin acuosa.
Pasos a seguir:
1) Asignar los estados de oxidacin de cada elemento. Recordar que el estado de oxidacin de las
sustancias simples es cero.
2) a) Disociar hidrxidos y sales. Ionizar cidos.
NO se disocian ni se ionizan: xidos, sustancias simples, H2O, H2O2, NH3, PH3, AsH3
Para el caso en que se indiquen los iones presentes en solucin:
Observar y distinguir iones de especies insolubles
3) Separar la ecuacin en dos hemiecuaciones.
a) Hemiecuacin de oxidacin: aumenta el estado de oxidacin de algn elemento, se ceden
electrones. Esta ecuacin corresponde al agente reductor.
b) Hemiecuacin de reduccin: disminuye el estado de oxidacin de algn elemento, se aceptan
electrones. Esta ecuacin corresponde al agente oxidante.
4) En cada hemiecuacin: a) Balancear la masa si es necesario agregar los iones que permiten llegar a la
frmula de las especies insolubles, b) balancear la carga y c) verificar.
a) Balancear la masa
i) Igualar el nmero de moles de tomos del elemento cuyo estado de oxidacin vara.
ii) Igualar el nmero de moles de tomos de oxgeno:
En medio cido: se agregan tantos moles de agua de un lado de la hemiecuacin
como moles de tomos de oxgeno haya en exceso del otro. Luego se igualan los
moles de tomos de hidrgeno con iones hidrgeno (H+)
En medio bsico: se agregan del mismo lado de la hemiecuacin en el cual haya
exceso de moles de tomos de oxgeno, tantos moles de agua como moles de
tomos de oxgeno haya en exceso y del otro lado se agrega el doble de moles de
iones hidrxido (HO-). Si sobraran moles de hidrgeno se agregan moles de
hidrxido (HO-) del mismo lado y el mismo nmero de moles de agua del otro.
b) Balancear la carga compensando con moles de electrones.
c) Verificar que concuerde el cambio en el estado de oxidacin con los moles de electrones
agregados.
5) Igualar el nmero de moles de electrones para que el nmero de electrones cedidos sea igual al
nmero de electrones aceptados.
6) Sumar miembro a miembro ambas hemiecuaciones.
7) Simplificar las especies (electrones, HO-, H+, H O) que estn a ambas lados de la ecuacin.
2
8) Para el caso en que se indiquen las sustancias en la ecuacin (la expresin no es inica):
Agregar los iones no modificados (su estado de oxidacin permanece constante). Primero los que
sean necesarios a la izquierda, luego repetir a la derecha o viceversa.
9) Sumar las especies de manera de obtener las sustancias de la ecuacin original.
10) Verificar que la ecuacin haya quedado balanceada (el mismo nmero de moles de cada elemento
antes y despus de la reaccin qumica).
You might also like
- Taller 3 EstequiometriaDocument11 pagesTaller 3 EstequiometriaValentina ReyesNo ratings yet
- U 7 Reacciones QuímicasDocument8 pagesU 7 Reacciones QuímicasIgnacio LuceroNo ratings yet
- Método Del Ion ElectrónDocument4 pagesMétodo Del Ion Electróntatex27No ratings yet
- Reacciones Químicas - QuímicaDocument7 pagesReacciones Químicas - QuímicaElias CaleiNo ratings yet
- Balanceo de EcuacionesDocument4 pagesBalanceo de Ecuacionesmiguel OrtegaNo ratings yet
- Metodos de Igualaciones Quimicas PDFDocument5 pagesMetodos de Igualaciones Quimicas PDFHache ZG FernandoNo ratings yet
- S8Métodos de Igualación de ReaccionesDocument3 pagesS8Métodos de Igualación de ReaccionesstebDCNo ratings yet
- Quimica Balanceo de Reacciones de Oxido ReduccionDocument3 pagesQuimica Balanceo de Reacciones de Oxido ReduccionlucatoileanaNo ratings yet
- 07 Redox y Teoria Ácido BaseDocument10 pages07 Redox y Teoria Ácido BaseGabriel C. SalgadoNo ratings yet
- Tema 1 Química 4to AñoDocument37 pagesTema 1 Química 4to AñoRicardoNo ratings yet
- Métodos de BalanceoDocument19 pagesMétodos de BalanceoAndersonRoseroNo ratings yet
- PQ2Document25 pagesPQ2'Lau WeistNo ratings yet
- Métodos de Igualaciones QuímicasDocument5 pagesMétodos de Igualaciones QuímicasAlejandro Mendoza100% (3)
- Método Del Ion ElectronDocument2 pagesMétodo Del Ion ElectronMiguel Àngel David Marchena TelloNo ratings yet
- Guia Del Taller de Reacciones de Oxido Reduccion RedoxDocument8 pagesGuia Del Taller de Reacciones de Oxido Reduccion RedoxRobbie AcNo ratings yet
- Balanceo de Reacciones Redox Por El Método IónDocument1 pageBalanceo de Reacciones Redox Por El Método IónRodolfo BazánNo ratings yet
- Método Del Ión ElectrónDocument11 pagesMétodo Del Ión ElectrónlenzuhertzNo ratings yet
- Ion Electrón-Medio BásicoDocument3 pagesIon Electrón-Medio BásicoARIEL SEBASTIAN MARQUEZ GOMEZNo ratings yet
- Balance de Reacciones RedoxDocument5 pagesBalance de Reacciones RedoxARMY CARATNo ratings yet
- Unidad II-tema 1 y 2. Reacciones Químicas. Óxido-ReducciónDocument66 pagesUnidad II-tema 1 y 2. Reacciones Químicas. Óxido-ReducciónErick MontenegroNo ratings yet
- Método Ión-ElectrónDocument9 pagesMétodo Ión-ElectrónVanessa VargasNo ratings yet
- Reacciones QuímicasDocument7 pagesReacciones QuímicasAlejandro BaezaNo ratings yet
- Pasos A Seguir. Método Ion Electron Medio Acido BásicoDocument1 pagePasos A Seguir. Método Ion Electron Medio Acido BásicomarkoagustinNo ratings yet
- Agentes Oxidantes y ReductoresDocument2 pagesAgentes Oxidantes y ReductoresGabrielaNo ratings yet
- Instrucciones para Equilibrar Las Ecuaciones RedoxDocument4 pagesInstrucciones para Equilibrar Las Ecuaciones RedoxDaniel PadillaNo ratings yet
- Métodos de Balanceo de Ecuaciones QuímicasDocument3 pagesMétodos de Balanceo de Ecuaciones QuímicasMoyCoralNo ratings yet
- MÓDULO 24 - III BIM - CyT - 3ERODocument5 pagesMÓDULO 24 - III BIM - CyT - 3EROREBECA REYES QUISPENo ratings yet
- Balanceo de Ecuaciones Químicas - 091c01d3Document14 pagesBalanceo de Ecuaciones Químicas - 091c01d3KATHERYN SUESCUN GUEVARANo ratings yet
- Quimica U7Document5 pagesQuimica U7Paul Mijael Perez DiazNo ratings yet
- VIRTUAL JULIO 2020 - Balanceo Método Ion-ElectrónDocument30 pagesVIRTUAL JULIO 2020 - Balanceo Método Ion-ElectrónAlejandra VargasNo ratings yet
- Balance EcuacioneS ION ELECTRONDocument4 pagesBalance EcuacioneS ION ELECTRONhuguito17No ratings yet
- Balance y Estequiometria de Las Reacciones QuimicasDocument12 pagesBalance y Estequiometria de Las Reacciones QuimicasMichelle RodriguezNo ratings yet
- Cuadernillo Cuarto A EJE 1 Reacciones y SolucionesDocument74 pagesCuadernillo Cuarto A EJE 1 Reacciones y SolucionesCarina KriedelNo ratings yet
- Reacciones de Oxidación-ReducciónDocument3 pagesReacciones de Oxidación-ReducciónAlejandro BritoNo ratings yet
- Fuerzas IntermolecularesDocument13 pagesFuerzas IntermolecularesFlorencia RodriguezNo ratings yet
- Balanceo de Reacciones Redox Por El Método Del Ion-ElectrónDocument3 pagesBalanceo de Reacciones Redox Por El Método Del Ion-ElectrónM Paula LaaNo ratings yet
- Labquimica 5Document11 pagesLabquimica 5Kevin Correa alvarezNo ratings yet
- Lectura N°5 - Unidad III A Composición Cuantitativa de Los Compuestos y Estequiometría - P2Document15 pagesLectura N°5 - Unidad III A Composición Cuantitativa de Los Compuestos y Estequiometría - P2Samuel Camargo BauerNo ratings yet
- Resumen de Los Métodos de Balanceo de EcuacionesDocument5 pagesResumen de Los Métodos de Balanceo de EcuacionesJorge DurangoNo ratings yet
- Balanceo de Ecuaciones Químicas - 1Document18 pagesBalanceo de Ecuaciones Químicas - 1Jaime HernandezNo ratings yet
- Taller 3 EstequiometriaDocument9 pagesTaller 3 EstequiometriaMaría Ángel OHNo ratings yet
- Glosario de Reacciones Qulimicas (1) 6Document3 pagesGlosario de Reacciones Qulimicas (1) 6Alexis de LeonNo ratings yet
- Estequiometria ResumidaDocument32 pagesEstequiometria ResumidaLUZ KARIME TORRES LOZADANo ratings yet
- II. 5 Equilibrio RedoxDocument5 pagesII. 5 Equilibrio RedoxInés Rojas de LeónNo ratings yet
- Estequiometria ResumidaDocument32 pagesEstequiometria ResumidaTopografo Karin HormigaNo ratings yet
- Guía Teorica y Actividades 2022 (Recuperado)Document203 pagesGuía Teorica y Actividades 2022 (Recuperado)buly 10No ratings yet
- Unidad 4 Química. Unc BioDocument3 pagesUnidad 4 Química. Unc Biovalentina QuinterosNo ratings yet
- M14 - S1 - Reacciones y Ecuaciones Químicas - PDF PDFDocument4 pagesM14 - S1 - Reacciones y Ecuaciones Químicas - PDF PDFPatty CocomNo ratings yet
- Balanceo de Ecuaciones QuímicasDocument5 pagesBalanceo de Ecuaciones QuímicasMarybel HellsingNo ratings yet
- Materias Clases N°5, N°6 y N°7Document1 pageMaterias Clases N°5, N°6 y N°7Guillermo Córdova CastilloNo ratings yet
- Tanteo y RedoxDocument1 pageTanteo y RedoxAxel LopezNo ratings yet
- M14 - S1 - Reacciones y Ecuaciones Químicas - PDFDocument4 pagesM14 - S1 - Reacciones y Ecuaciones Químicas - PDFHosanna RuízNo ratings yet
- Ejercicios de EstequiometríaDocument32 pagesEjercicios de EstequiometríaMaddox Parra RoperoNo ratings yet
- Química Redox 3er. Curso Plan EspecíficoDocument9 pagesQuímica Redox 3er. Curso Plan Específicoeliasfidelmartinezesquivel11No ratings yet
- Guia de RedoxDocument4 pagesGuia de RedoxAntonella RiveloNo ratings yet
- Balanceo Ion ElectronDocument4 pagesBalanceo Ion ElectronJoelAnguianoNo ratings yet
- Balanceo Ión Electrón en Medio AcidoDocument7 pagesBalanceo Ión Electrón en Medio AcidoFrancis Drake Fernandez CastroNo ratings yet
- P0001-File-igualación de Ecuaciones Redox PDFDocument3 pagesP0001-File-igualación de Ecuaciones Redox PDFQuimica TecnologiaNo ratings yet
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaFrom EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaRating: 5 out of 5 stars5/5 (1)
- Proteinas Especificas IiDocument25 pagesProteinas Especificas IiAgus RomeroNo ratings yet
- Proteinas 1Document29 pagesProteinas 1Agus RomeroNo ratings yet
- DeshidrataciónDocument41 pagesDeshidrataciónAgus RomeroNo ratings yet
- NucleótidosDocument47 pagesNucleótidosAgus RomeroNo ratings yet
- Buffer FisiológicoDocument39 pagesBuffer FisiológicoAgus RomeroNo ratings yet
- Introduccion A La Bioquimica en Nutricion 2021Document88 pagesIntroduccion A La Bioquimica en Nutricion 2021Agus RomeroNo ratings yet
- OrinaDocument29 pagesOrinaAgus RomeroNo ratings yet
- Agua 2019Document37 pagesAgua 2019Agus RomeroNo ratings yet
- Estructura de LipidosDocument55 pagesEstructura de LipidosAgus RomeroNo ratings yet
- Membranas Biologicas 2021Document35 pagesMembranas Biologicas 2021Agus RomeroNo ratings yet
- Estructura de LipidosDocument57 pagesEstructura de LipidosAgus RomeroNo ratings yet
- Vitaminas-Hidrosolubles 2019Document65 pagesVitaminas-Hidrosolubles 2019Agus RomeroNo ratings yet
- Libro Resueltos Parte Ii-31082020Document28 pagesLibro Resueltos Parte Ii-31082020Agus RomeroNo ratings yet
- Composiciones Químicas Promedio 1Document3 pagesComposiciones Químicas Promedio 1Agus RomeroNo ratings yet
- Minerales 2019Document47 pagesMinerales 2019Agus RomeroNo ratings yet
- Clase - HB-MBDocument24 pagesClase - HB-MBAgus RomeroNo ratings yet
- Tabla Equivalencia Peso AlimentosDocument9 pagesTabla Equivalencia Peso AlimentosAgus RomeroNo ratings yet
- Hiperuricemia y GotaDocument42 pagesHiperuricemia y GotaAgus RomeroNo ratings yet
- Páginas de Robertis 114-115 PDFDocument1 pagePáginas de Robertis 114-115 PDFAgus RomeroNo ratings yet
- ENZIMASDocument61 pagesENZIMASAgus RomeroNo ratings yet
- Magnitudes y Unidades PDFDocument2 pagesMagnitudes y Unidades PDFAgus RomeroNo ratings yet
- CBC Matematica Primer ParcialDocument16 pagesCBC Matematica Primer ParcialAgus RomeroNo ratings yet
- Memoria Descriptiva Valorizada Cerco PerimetricoDocument7 pagesMemoria Descriptiva Valorizada Cerco PerimetricoVitto Gutierrez FrancoNo ratings yet
- Ficha General Powercem (V 2)Document1 pageFicha General Powercem (V 2)ciber360 JiquipilasNo ratings yet
- Taller Preparación de SolucionesDocument3 pagesTaller Preparación de Solucionesangie0% (1)
- Construcción y Diseño de Pilotes FrankiDocument67 pagesConstrucción y Diseño de Pilotes Frankijolis1796100% (1)
- 4 - Trabajo Práctico #4 - CementosDocument16 pages4 - Trabajo Práctico #4 - CementosEliana Fernandez BarrazaNo ratings yet
- Modulo2 YtsDocument109 pagesModulo2 YtsDanielNo ratings yet
- Colorimetros HachDocument4 pagesColorimetros HachCristobalNo ratings yet
- Tabla PeriódicaDocument22 pagesTabla Periódicabrenda isela suarez zentenoNo ratings yet
- Guia Grado Decimo Solo Con Actividades ServioDocument5 pagesGuia Grado Decimo Solo Con Actividades ServioerikaNo ratings yet
- Sistemas MaterialesDocument3 pagesSistemas MaterialesSandra Hamberg De GonzalesNo ratings yet
- Barrera de Vapor Según CTE HE1 - 03Document1 pageBarrera de Vapor Según CTE HE1 - 03Manuel Montesdeoca CalderinNo ratings yet
- Titulo Practica Termometria y DilatacionDocument9 pagesTitulo Practica Termometria y DilatacionFabu Pt100% (1)
- (Sesión 2) - Obtención - Definición - Acero Hierro FundidoDocument44 pages(Sesión 2) - Obtención - Definición - Acero Hierro FundidoJhon Alex Hinojosa FloresNo ratings yet
- Oze Tipo IvDocument2 pagesOze Tipo IvGladysNo ratings yet
- Ejercicios FyQ. 2º ESO. 1º EvDocument4 pagesEjercicios FyQ. 2º ESO. 1º EvSaraGFNo ratings yet
- EjercicioDocument7 pagesEjercicioMarisela Maytahuari manihuariNo ratings yet
- Informe de Rocas SedimentariasDocument28 pagesInforme de Rocas Sedimentariasgeologocusco83% (6)
- Obtención de OlefinaDocument55 pagesObtención de OlefinaYulitza Soar GalantonNo ratings yet
- Unidad 3 - Tarea 4 - Metales y MetalurgiaDocument11 pagesUnidad 3 - Tarea 4 - Metales y MetalurgiaJohn Jader Rico Benavides100% (1)
- Catálogo ..Document52 pagesCatálogo ..Fercho Careto BastarNo ratings yet
- Catalogo2020 Qapac RunaDocument15 pagesCatalogo2020 Qapac RunaSonia Chávez0% (1)
- Organizador VisualDocument1 pageOrganizador Visualestudio de tiempo UCV100% (2)
- Aguja de Vicat 02Document7 pagesAguja de Vicat 02JESUS RAMOS RIVERA100% (1)
- Lanko 750 AdilatexDocument2 pagesLanko 750 AdilatexAlex Hdz GNo ratings yet
- Manual de Practicas de Quimica Organica ItamDocument10 pagesManual de Practicas de Quimica Organica ItamSofia MirandaNo ratings yet
- Mano de Obra Precios OrientativosDocument8 pagesMano de Obra Precios OrientativosALGONo ratings yet
- Clinica API 1104 Pucp PDFDocument68 pagesClinica API 1104 Pucp PDFhenry307No ratings yet
- DMC Una Alternativa Verde para Solventes Convencionales.Document38 pagesDMC Una Alternativa Verde para Solventes Convencionales.floryguapoNo ratings yet
- Clase 1Document22 pagesClase 1carlosNo ratings yet