Professional Documents
Culture Documents
Dimitri
Uploaded by
Brayan Taboada PachecoOriginal Description:
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Dimitri
Uploaded by
Brayan Taboada PachecoCopyright:
Available Formats
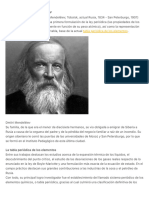
Dmitri Ivánovich Mendeléyev fue un químico ruso que nació el 8 de febrero de 1834 en Tobolsk y murió el 2 de febrero
de 1907 en San Petersburgo. Es famoso por el descubrimiento del patrón subyacente en lo que hoy en día se conoce
como tabla periódica de los elementos.
Dedicó gran parte de su vida a estudiar la expansión térmica de los
elementos, las desviaciones de de los gases reales de lo ya enunciado en la ley de Boyle-Mariotte. Asimismo también
logró el descubrimiento del punto crítico y realizó una formulación mucho más exacta de la ecuación de estado. Sin
embargo, su principal investigación fue la que concluyó con la enunciación de la ley periódica de los elementos químicos,
más conocida como Tabla Periódica, y que se basó en el sistema periódico que recibe su nombre. Con dicha tabla,
Dmitri Mendeléyev consiguió realizar una clasificación definitiva de los elementos. El sistema periódico clasifica todos los
elementos químicos, tanto naturales como creados, en base a su masa atómica de forma creciente. De esta forma, se
ubican en la misma columna aquellos elementos que tengan algo en común. Con ello logró que aquellos elementos con
un comportamiento químico parecido se localizaran en la misma columna. Asimismo, Dmitri Mendeléyev alteró el orden
de las masas para ordenarlos según sus propiedades cuando lo creyó necesario y, además, dejó huecos en blanco para
nuevos elementos que se descubrieran en el futuro Su sistema incorporaba múltiples mejoras en la clasificación de los
elementos existentes hasta entonces, como la combinación de pesos atómicos, o las semejanzas entre elementos. De
esta forma, demostró que las propiedades correspondientes a los elementos químicos son funciones periódicas de sus
pesos atómicos. Algunos años después, la tabla periódica de los elementos de Mendeléyev experimentó una última
ampliación en una de sus columnas con el descubrimiento de algunos gases nobles como el neón o el criptón, y que
ultimaron la actual versión de la tabla periódica. En Rusia nunca reconocieron sus méritos de forma oficial
debido a sus ideas liberales, por lo que no le admitieron en la Academia Rusa de las Ciencias. Sin
embargo se nombró mendelevio (Md) en su honor al elemento químico de número atómico 101,
en 1955.
La tabla periódica de Mendeleiev, estaba bastante elaborada y contenía a todos los
elementos conocidos hasta ese momento, ordenados en una tabla con entrada doble,
siguiendo los siguientes criterios:
Masa atómica de orden creciente: los elementos se clasifican de izquierda a derecha, siguiendo líneas horizontales.
Similitud entre las propiedades: Los elementos que tienen propiedades similares ( como por ejemplo, la valencia), se
colocan en columnas verticales.
En 1869 ya se conocían 63 elementos, de los 90 que hay en la naturaleza.
Mendeleiev, plantea que las propiedades de los elementos tenían que dar respuesta a una ley periódica que aun no
se conocía. Él se sentía convencido de sus pensamientos lo que lo llevó a realizar predicciones quizás algo
arriesgadas para aquella época, pero que con el tiempo resultaron ser ciertas:
-Dudó del valor de la masa atómica de algunos elementos, como el berilio y el uranio, y les dio otros valores que
consideraba más acertados.
– Cambiar el orden de las masas atómicas en algunos elementos, para que éstos se agrupasen de mejor manera, con
otros elementos de propiedades análogas, como puede ser el caso del teluro-yodo, o el cobalto-níquel.
-Dejar espacios en la tabla, que correspondían a elementos que aun no se conocían, llegando a predecir las
propiedades incluso antes de ser descubiertos. Este es el caso del galio, el germanio o el escandio.
Fue ésta última predicción su gran mérito, ya que pronosticó la existencia y correcta posición de elementos aun no
descubiertos, asignándoles un nombre provisional, como por ejemplo: el galio, al cual llamó eka-aluminio, por
encontrarse éste bajo el aluminio en la clasificación, o el germanio, llamado como eka-sicilio, por encontrarse bajo éste,
o incluso predijo la posición del tecnecio, que se convertiría posteriormente en el primer elemento sintetizado en
laboratorio (en 1937).
El primer ordenamiento que realizó Mendeleiev no tuvo buena aceptación, pero después de diversas modificaciones,
en 1872 hizo publica su nueva Tabla Periódica, que estaba formada por ocho columnas repartidas en dos grupos cada
una, que en años posteriores se les conoció como, familia A y familia B.
La nueva tabla contiene las fórmulas generales de óxidos e hidruros en todos los grupos, y por lo tanto, implícitamente,
también las valencias de los elementos.
La tabla se completó a finales del siglo XIX, con otro grupo más, llamado grupo cero, que estaba formado por los gases
nobles que habían sido descubiertos recientemente en el aire, aunque Mendeleiev al principio no aceptó dicho
descubrimiento, debido a que no sabía donde colocarlos en su tabla, pero finalmente, fueron los gases nobles,
formando el grupo cero (debido a la valencia cero), los que completaron la tabla.
La clasificación que Mendeleiev propuso, presentaba una dificultad que era tratar la masa atómica como criterio para
ordenar los elementos, ya que esto supondría que muchos elementos deberían estar colocados fuera del lugar que le
correspondía, para así poder quedar agrupado por similitud en cuando a propiedades.
Por lo
tanto,
se
deberían hacer compatibles tanto las propiedades químicas de los elementos que se repetían, como las masas
atómicas, pero aun así no parecía ser suficiente para obtener una ordenación coherente.
You might also like
- Antecedentes de La Tabla PeriódicaDocument5 pagesAntecedentes de La Tabla PeriódicareilitNo ratings yet
- El secreto de Prometeo y otras historias sobre la Tabla Periódica de los ElementosFrom EverandEl secreto de Prometeo y otras historias sobre la Tabla Periódica de los ElementosRating: 5 out of 5 stars5/5 (1)
- Dmitri Ivanovich MendeléievDocument3 pagesDmitri Ivanovich Mendeléiev5hqkbxwmjhNo ratings yet
- Johann Wolfgang DöbereinerDocument10 pagesJohann Wolfgang Döbereinercyber la joya catemacoNo ratings yet
- Clasificación de Los Elementos QuímicosDocument5 pagesClasificación de Los Elementos QuímicosKevin Tarrillo VásquezNo ratings yet
- Desarrollo de La Tabla PeriódicaDocument5 pagesDesarrollo de La Tabla PeriódicaGeovany ChangNo ratings yet
- Trabajo Práctico de Físico QuímicaDocument10 pagesTrabajo Práctico de Físico QuímicaKaren BordonNo ratings yet
- Dimitri Ivanovich MendeléievDocument3 pagesDimitri Ivanovich Mendeléievlizet50% (2)
- Dmitri Ivanovich MendeléievDocument2 pagesDmitri Ivanovich Mendeléieveduardo33340% (1)
- Creadores de La Tabla BiografiasDocument6 pagesCreadores de La Tabla BiografiasFallo Re DoNo ratings yet
- Tabla PeriodicaDocument23 pagesTabla PeriodicaGuilliane Silva Mino100% (2)
- Dmitri Ivanovich MendeléievDocument4 pagesDmitri Ivanovich MendeléievFernando MartinezNo ratings yet
- Antecedentes Históricos de La Tabla PeriódicaDocument10 pagesAntecedentes Históricos de La Tabla PeriódicaGabriel TorrucoNo ratings yet
- BIOGRAFIASDocument66 pagesBIOGRAFIASMaria Milagro Di Lorenzo FrancoNo ratings yet
- EL FÍSICO LOCO - Tabla PeriódicaDocument7 pagesEL FÍSICO LOCO - Tabla PeriódicaAdriana LorenzoNo ratings yet
- La Primera Clasificación de Elementos Conocida Fue Propuesta PorDocument6 pagesLa Primera Clasificación de Elementos Conocida Fue Propuesta PorJose Humberto Aragon AcostaNo ratings yet
- Tablla PeriodicaDocument49 pagesTablla PeriodicaMisael Peña FloresNo ratings yet
- Trabajo de Biologia - JeudyDocument7 pagesTrabajo de Biologia - JeudyJeudy MateoNo ratings yet
- Historia de La TablaDocument7 pagesHistoria de La TablaLeard Rafael Peralta MalaverNo ratings yet
- Taller 10 - Historia de La Tabla PeriodicaDocument5 pagesTaller 10 - Historia de La Tabla PeriodicaEsteban MoralesNo ratings yet
- Historia de La Tabla PeriódicaDocument4 pagesHistoria de La Tabla PeriódicaJose sanchezNo ratings yet
- QuímicaDocument4 pagesQuímicaSantisteban V HugoNo ratings yet
- La Tabla Periódica Es Un Esquema de Clasificación de Datos y de Todos Los Elementos QuímicosDocument7 pagesLa Tabla Periódica Es Un Esquema de Clasificación de Datos y de Todos Los Elementos QuímicosDul G Merino100% (1)
- MonografiaDocument20 pagesMonografiaMiriam Vega VidalNo ratings yet
- Tabla Periódica InvestigaciónDocument20 pagesTabla Periódica InvestigaciónKarina PeraltaNo ratings yet
- 5 Exposicion-QuimicaDocument20 pages5 Exposicion-QuimicaPaul Daniel Echeandia LamadridNo ratings yet
- Triadas de DöbereinerDocument8 pagesTriadas de DöbereinerRocio BetanzosNo ratings yet
- Actividad de Apoo Grado NovenoDocument4 pagesActividad de Apoo Grado NovenoMauricio MuñozNo ratings yet
- Tabla Periodica Clase 1 PDFDocument18 pagesTabla Periodica Clase 1 PDFMaria PucciniNo ratings yet
- La Tabla Periódica: Facultad de MedicinaDocument13 pagesLa Tabla Periódica: Facultad de MedicinaAna Fatecha CabreraNo ratings yet
- Antecedentes Históricos de La Tabla PeriódicaDocument25 pagesAntecedentes Históricos de La Tabla PeriódicaMargarita Glez60% (5)
- Historia de La Tabla PeriódicaDocument8 pagesHistoria de La Tabla PeriódicaEric RodríguezNo ratings yet
- Tabla Periódica EvoluciónDocument31 pagesTabla Periódica Evoluciónana palenciaNo ratings yet
- Evolucion de La Tabla Periodica - Aaron Misael Escobar CanDocument8 pagesEvolucion de La Tabla Periodica - Aaron Misael Escobar CanAaron Misael Escobar CanNo ratings yet
- Johann Wolfgang DöbereinerDocument9 pagesJohann Wolfgang DöbereinerDayana Brishit Alva ChavarryNo ratings yet
- Clase Virtual 4 - Tabla y Propiedades PeriodicasDocument6 pagesClase Virtual 4 - Tabla y Propiedades PeriodicasSofiaNo ratings yet
- Intentos de Sistematización de La Tabla PeriódicaDocument4 pagesIntentos de Sistematización de La Tabla PeriódicaMiguel Omaña0% (1)
- Historia de La Tabla PeriódicaDocument2 pagesHistoria de La Tabla Periódicagatorno1992No ratings yet
- Dmitri Ivanovich MendeléievDocument3 pagesDmitri Ivanovich MendeléievJeferson Jhair Saldaña SarabiaNo ratings yet
- Aporte Científico en La Elaboración de La Tabla Periódica de Los Elementos Desde El Inicio A La ActualidadDocument5 pagesAporte Científico en La Elaboración de La Tabla Periódica de Los Elementos Desde El Inicio A La ActualidadRolando AlmengorNo ratings yet
- TABLA PERIODICA Con Partes DivididasDocument10 pagesTABLA PERIODICA Con Partes DivididasJesus Alberto Agiuirre SanchezNo ratings yet
- TABLA PERIODICA ExpoDocument21 pagesTABLA PERIODICA ExpoAmérika Lin AmazonasNo ratings yet
- 2do1ra-10-08-CIENTÍFICOS DEL SGLO XIX-Parejas Pedagógicas. Prof - Paulina Silva Lenio.Document10 pages2do1ra-10-08-CIENTÍFICOS DEL SGLO XIX-Parejas Pedagógicas. Prof - Paulina Silva Lenio.totopra 014No ratings yet
- UNIDAD 2 Los Elementos Químicos y Su ClasificaciónDocument17 pagesUNIDAD 2 Los Elementos Químicos y Su ClasificaciónIttzeel CampossNo ratings yet
- Historia de La Tabla PeriódicaDocument11 pagesHistoria de La Tabla PeriódicaEddieMaczNo ratings yet
- Tabla PeriódicaDocument12 pagesTabla PeriódicaAlex ChoqueNo ratings yet
- Historia de La Tabla PeriódicaDocument5 pagesHistoria de La Tabla PeriódicaEdeli OrtegaNo ratings yet
- Apuntes 007 - Historia de La Tabla Periódica - ActualDocument27 pagesApuntes 007 - Historia de La Tabla Periódica - Actualrosa maria lopez duarteNo ratings yet
- Tabla PeriodicaDocument9 pagesTabla PeriodicaSergio TachackNo ratings yet
- PeridDocument9 pagesPeridgusman RomanNo ratings yet
- HISTORIA+DE+LA+TABLA+PERIÓDICA +1+resumenDocument2 pagesHISTORIA+DE+LA+TABLA+PERIÓDICA +1+resumenRosario de los Ángeles Sofía Macedo LlerenaNo ratings yet
- Historia de La Tabla PeriódicaDocument24 pagesHistoria de La Tabla PeriódicaNoéNo ratings yet
- Marco TeoricoDocument15 pagesMarco TeoricoErick Ntl TlvNo ratings yet
- Aporte Tabla PeriodicaDocument3 pagesAporte Tabla PeriodicaSoraya Carvajal C.No ratings yet
- TALLER de QUÍMICA, TABLA PERIÓDICADocument7 pagesTALLER de QUÍMICA, TABLA PERIÓDICAGuadalupe GirónNo ratings yet
- Bloque 1. - Enlace Químico y Estructura de La MateriaDocument25 pagesBloque 1. - Enlace Químico y Estructura de La Materiaainhoa.fmunNo ratings yet
- Reseña Tabla Periodica - FabianaDocument3 pagesReseña Tabla Periodica - Fabianaana lazoNo ratings yet
- RocioDocument4 pagesRocioVerónica RomeroNo ratings yet
- Lab TablaDocument24 pagesLab TablaJulio Campos ValenzuelaNo ratings yet
- Señalización VerticalDocument5 pagesSeñalización VerticalBrayan Taboada PachecoNo ratings yet
- Realidad Nacional-Punto 6Document2 pagesRealidad Nacional-Punto 6Brayan Taboada PachecoNo ratings yet
- Zapata AisladaDocument6 pagesZapata AisladaBrayan Taboada PachecoNo ratings yet
- Rapid AsDocument9 pagesRapid AsBrayan Taboada PachecoNo ratings yet
- Señalización VerticalDocument2 pagesSeñalización VerticalBrayan Taboada PachecoNo ratings yet
- Diseño de MezclaDocument2 pagesDiseño de MezclaBrayan Taboada PachecoNo ratings yet
- Estrategia de Diferenciación TerminadoDocument1 pageEstrategia de Diferenciación TerminadoBrayan Taboada PachecoNo ratings yet
- ANUNCIODocument1 pageANUNCIOBrayan Taboada PachecoNo ratings yet
- Caràtula de Luis Jose de OrbegosoDocument1 pageCaràtula de Luis Jose de OrbegosoBrayan Taboada PachecoNo ratings yet
- ÌNDICEDocument1 pageÌNDICEBrayan Taboada PachecoNo ratings yet
- Solicit UdDocument1 pageSolicit UdBrayan Taboada PachecoNo ratings yet
- Cimentación Sobre RellenosDocument2 pagesCimentación Sobre RellenosBrayan Taboada Pacheco100% (2)
- Diseño de MezclaDocument2 pagesDiseño de MezclaBrayan Taboada PachecoNo ratings yet
- Máximo San RománDocument1 pageMáximo San RománBrayan Taboada PachecoNo ratings yet
- Imagenes de Visita - c2Document3 pagesImagenes de Visita - c2Brayan Taboada PachecoNo ratings yet
- Estrategias Genéricas de PorterDocument1 pageEstrategias Genéricas de PorterBrayan Taboada PachecoNo ratings yet
- Estrategias Genéricas de PorterDocument1 pageEstrategias Genéricas de PorterBrayan Taboada PachecoNo ratings yet
- Estrategias Genéricas de PorterDocument1 pageEstrategias Genéricas de PorterBrayan Taboada PachecoNo ratings yet
- Señalización VerticalDocument5 pagesSeñalización VerticalBrayan Taboada PachecoNo ratings yet
- Señalización VerticalDocument5 pagesSeñalización VerticalBrayan Taboada PachecoNo ratings yet
- Sílabo Análisis de Estructuras I. Plan 1Document2 pagesSílabo Análisis de Estructuras I. Plan 1Giancarlos Marin PerfectoNo ratings yet
- CDocument2 pagesCBrayan Taboada PachecoNo ratings yet
- ADocument4 pagesACalos Ramirez CruzNo ratings yet
- Estrategias Genéricas de PorterDocument1 pageEstrategias Genéricas de PorterBrayan Taboada PachecoNo ratings yet
- AnuncioDocument1 pageAnuncioBrayan Taboada PachecoNo ratings yet
- Trabajo MsDocument2 pagesTrabajo MsBrayan Taboada PachecoNo ratings yet
- IncasDocument5 pagesIncasBrayan Taboada PachecoNo ratings yet
- Gestion Empresarial TrabajoDocument12 pagesGestion Empresarial TrabajoBrayan Taboada PachecoNo ratings yet
- Gestion EmpresarialDocument3 pagesGestion EmpresarialBrayan Taboada Pacheco60% (5)
- Mecanica de Suelos Muestra CDocument3 pagesMecanica de Suelos Muestra CBrayan Taboada PachecoNo ratings yet
- Semana 2Document5 pagesSemana 2Americka Karina Delgado ReyesNo ratings yet
- Student Guide CyberTeachers Platinum - ESDocument11 pagesStudent Guide CyberTeachers Platinum - ESChristian RubianoNo ratings yet
- DH y Del TrabajoDocument3 pagesDH y Del TrabajoAngie MartinezNo ratings yet
- Bielas, Pistones y AnillosDocument31 pagesBielas, Pistones y AnillosEnrique Ramirez HerreraNo ratings yet
- Taller Tamaño de La MuestraDocument1 pageTaller Tamaño de La MuestraBrainer Padilla OrozcoNo ratings yet
- Grupo 5. MedidasDocument32 pagesGrupo 5. MedidasAMELIA DEL ROCIO CANGO LACHIRANo ratings yet
- Zigmunt Bauman (2018) - Sobre La Fragilidad de Los Vínculos: Humanos. Amor Líquido. Barcelona: PaidósDocument7 pagesZigmunt Bauman (2018) - Sobre La Fragilidad de Los Vínculos: Humanos. Amor Líquido. Barcelona: PaidósSarah PeñaNo ratings yet
- Taller Norma Iso 14001Document3 pagesTaller Norma Iso 14001David Perez MontoyaNo ratings yet
- Roles Del Departamento de Diseño-1Document14 pagesRoles Del Departamento de Diseño-1Angie Tovar100% (1)
- Unidad2 Fase4Document9 pagesUnidad2 Fase4Juliana RojasNo ratings yet
- Ficha Tecnica HCL DiluidoDocument2 pagesFicha Tecnica HCL DiluidoDirector de Calidad SEILAM S.A.S.No ratings yet
- Sectores EconomicosDocument3 pagesSectores EconomicosChristian AriasNo ratings yet
- Posner 2004 Chewas y Tumbukas EspañolDocument17 pagesPosner 2004 Chewas y Tumbukas EspañolMatias Urra FuenzalidaNo ratings yet
- Examen Parcial de Filosofia 10 - 01 Primer PeriodoDocument3 pagesExamen Parcial de Filosofia 10 - 01 Primer PeriodoLuis Enrique Biblioteca Juan de Dios AmadorNo ratings yet
- Técnicas de Liberación EmocionalDocument6 pagesTécnicas de Liberación EmocionalLau Uri100% (1)
- El Proposito de La EscrituraDocument2 pagesEl Proposito de La EscrituraMilagros Herrera80% (5)
- Acta de Pactación de Precios - Santa CruzDocument3 pagesActa de Pactación de Precios - Santa CruzEdil Orlando Llajaruna LopezNo ratings yet
- Teoría de Orbitales Moleculares Frontera (FMO)Document25 pagesTeoría de Orbitales Moleculares Frontera (FMO)RUBY100% (1)
- Normalidad y Anormalidad PatológicaDocument33 pagesNormalidad y Anormalidad PatológicaCarmen JarolinNo ratings yet
- Informe Mtto de ApantallamientoDocument21 pagesInforme Mtto de ApantallamientoMantenimiento BiocicloNo ratings yet
- Practica Adicional UTEQ Transferencia de Material PLC MICROLOGIX1000Document1 pagePractica Adicional UTEQ Transferencia de Material PLC MICROLOGIX1000Eduardo HernandezNo ratings yet
- Cultivo Continuo T Oxig y EscalamDocument27 pagesCultivo Continuo T Oxig y EscalamPaola Vianey PortilloNo ratings yet
- Estructura ArancelariaDocument3 pagesEstructura ArancelariaJesus Hernandez De La CruzNo ratings yet
- Lista - Peritos Valuadores Autorizados en MéxicoDocument47 pagesLista - Peritos Valuadores Autorizados en MéxicoA Montes de OcaNo ratings yet
- Diseño SustentableDocument2 pagesDiseño SustentableJnthn M. PachecoNo ratings yet
- DR. WAINSTEIN Informe General Del SindicoDocument35 pagesDR. WAINSTEIN Informe General Del SindicoGime MondeloNo ratings yet
- Ejercicio 1Document5 pagesEjercicio 1Harold Rodríguez MazaNo ratings yet
- U4 - Equipo 8Document28 pagesU4 - Equipo 8Crystal PlataNo ratings yet
- Taller de Catedra Final Grado 6toDocument5 pagesTaller de Catedra Final Grado 6toFabian Pitre PatiñoNo ratings yet
- Hijo, Necesitas Ayuda 3Document13 pagesHijo, Necesitas Ayuda 3Sergio JaramaNo ratings yet
- Resetea tu mente. Descubre de lo que eres capazFrom EverandResetea tu mente. Descubre de lo que eres capazRating: 5 out of 5 stars5/5 (196)
- Recupera tu mente, reconquista tu vidaFrom EverandRecupera tu mente, reconquista tu vidaRating: 5 out of 5 stars5/5 (6)
- Tus Zonas Erroneas: Guía Para Combatir las Causas de la InfelicidadFrom EverandTus Zonas Erroneas: Guía Para Combatir las Causas de la InfelicidadRating: 4.5 out of 5 stars4.5/5 (1831)
- Yo Pude, ¡Tú Puedes!: Cómo tomar el control de tu bienestar emocional y convertirte en una persona imparable (edición revisada y expandida)From EverandYo Pude, ¡Tú Puedes!: Cómo tomar el control de tu bienestar emocional y convertirte en una persona imparable (edición revisada y expandida)Rating: 5 out of 5 stars5/5 (7)
- Psicología oscura: Una guía esencial de persuasión, manipulación, engaño, control mental, negociación, conducta humana, PNL y guerra psicológicaFrom EverandPsicología oscura: Una guía esencial de persuasión, manipulación, engaño, control mental, negociación, conducta humana, PNL y guerra psicológicaRating: 4.5 out of 5 stars4.5/5 (766)
- Tu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaFrom EverandTu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaRating: 5 out of 5 stars5/5 (2)
- Cómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaFrom EverandCómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaRating: 5 out of 5 stars5/5 (1870)
- El poder del optimismo: Herramientas para vivir de forma más positivaFrom EverandEl poder del optimismo: Herramientas para vivir de forma más positivaRating: 5 out of 5 stars5/5 (16)
- Homo antecessor: El nacimiento de una especieFrom EverandHomo antecessor: El nacimiento de una especieRating: 5 out of 5 stars5/5 (1)
- Cómo romper el ciclo de pensamientos negativosFrom EverandCómo romper el ciclo de pensamientos negativosRating: 4.5 out of 5 stars4.5/5 (273)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanFrom EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanRating: 4.5 out of 5 stars4.5/5 (64)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaFrom EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaRating: 5 out of 5 stars5/5 (201)
- No desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaFrom EverandNo desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaRating: 5 out of 5 stars5/5 (12)
- Influencia. La psicología de la persuasiónFrom EverandInfluencia. La psicología de la persuasiónRating: 4.5 out of 5 stars4.5/5 (14)
- ¿Por qué mis padres no me aman?: Empezando a sanarFrom Everand¿Por qué mis padres no me aman?: Empezando a sanarRating: 4.5 out of 5 stars4.5/5 (33)
- Cómo Acertar en tu Nueva Relación de Pareja: Todas las claves para saber si tu relación tiene futuro... o te conviene salir corriendo de ahí.From EverandCómo Acertar en tu Nueva Relación de Pareja: Todas las claves para saber si tu relación tiene futuro... o te conviene salir corriendo de ahí.Rating: 4.5 out of 5 stars4.5/5 (7)
- Cómo terminar lo que empiezas: El arte de perseverar, pasar a la acción, ejecutar los planes y tener disciplinaFrom EverandCómo terminar lo que empiezas: El arte de perseverar, pasar a la acción, ejecutar los planes y tener disciplinaRating: 4.5 out of 5 stars4.5/5 (6)
- Libro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRAFrom EverandLibro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRARating: 4 out of 5 stars4/5 (26)
- La violencia invisible: Identificar, entender y superar la violencia psicológica que sufrimos (y ejercemos) en nuestra vida cotidianaFrom EverandLa violencia invisible: Identificar, entender y superar la violencia psicológica que sufrimos (y ejercemos) en nuestra vida cotidianaRating: 4 out of 5 stars4/5 (2)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreFrom EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreRating: 5 out of 5 stars5/5 (3)
- Teoría polivagal práctica y terapiaFrom EverandTeoría polivagal práctica y terapiaRating: 5 out of 5 stars5/5 (4)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoFrom EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoRating: 5 out of 5 stars5/5 (2)
- Una mente en calma: Técnicas para manejar los pensamientos intrusivosFrom EverandUna mente en calma: Técnicas para manejar los pensamientos intrusivosRating: 4.5 out of 5 stars4.5/5 (142)
- Autismo: guía para padres sobre el trastorno del espectro autista En españolFrom EverandAutismo: guía para padres sobre el trastorno del espectro autista En españolRating: 4.5 out of 5 stars4.5/5 (4)