Professional Documents
Culture Documents
Proteínas
Uploaded by
Kimberly TorresCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Proteínas
Uploaded by
Kimberly TorresCopyright:
Available Formats
Instituto Politécnico Nacional
Escuela Nacional De Ciencias Biológicas
Prolongación Manuel Carpio y Plan de Ayala s/n, Miguel Hidalgo, Santo Tomás, 11350 Ciudad de México, CDMX.
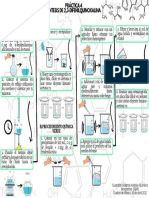
Precipitación, Separación y Punto Isoeléctrico de Proteínas
Objetivos:
- Analizar el efecto que produce la 3.- Precipitación por metales pesados
modificación de factores
fisicoquímicas sobre la solubilidad de Tabla 3.- Precipitación de proteínas
las proteínas. por metales pesados
- Determinar el punto isoeléctrico de la
insulina, basándose en sus
propiedades de solubilidad a
diferentes valores de pH.
Resultados:
1.- Separación de proteínas por
precipitación con sales (Salting out).
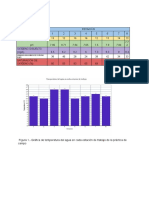
Tabla1. Resultados de prueba Salting out en
proteína. 4.- Determinación del punto
isoeléctrico de la insulina
Biuret Interpretación
Filtrado 1 + Presencia de proteínas Tubo Ácido Acetato Insulina pH Observaciones
Precipitado 1 + Presencia de proteínas No. acético de 40 U/ml
0.2M sodio
Filtrado 2 - Ausencia de proteínas (ml) 0.2M(ml)
Precipitado 2 + Presencia de proteínas
1 0.23 0.02 6U 3.67 Ausencia de
precipitado
2 0.15 0.10 6U 4.56 Ausencia de
2.- Precipitación por efecto del pH y de precipitado
solventes. 3 0.05 0.20 6U 5.34 Formación del
precipitado
1 2 3
HCl 0.1 N (ml) NaOH 0.1 N Regulador de
(ml) acetatos 0.1M,
pH 4.7 (ml)
Clara de huevo 3.0 3.0 3.0
filtrada, dil. 1:3
(ml)
La proteína se La proteína La proteína se
precipito se solubiliza, precipito
ligeramente, se observa ligeramente,
haciendo un totalmente haciendo un
poco turbia la transparente poco turbia la
solución, además . solución, en el
presentaba una fondo del tubo
viscosidad. una pequeña
acumulación de
precipitado.
Etanol 96° (ml) 3.0 3.0 3.0
Observaciones Se forma un La proteína Se forma un
precipitado color se solubilizó precipitado de la
blanco en el proteína color
tubo, además se blanco en la
hizo un poco más mayor parte del
viscoso tubo.
4 0.01 0.24 6U 6.12 Ausencia tienede la finalidad de poner en evidencia la
precipitado
5 0.00 0.25 6U 9.03 Ausencia presencia
de de proteínas. Nuestro
precipitadoresultado es positivo; al añadir el NaOH
al 40 % estamos proporcionando el
medio básico que requiere la reacción,
Discusión tomemos en cuenta que el OH- no
interviene. Una vez añadido el CuSO4, el
1. Separación de proteínas por Cu2+ forma un complejo por la interacción
precipitación con sales con los grupos –NH del péptido, dando la
coloración violeta que se observa.
Por otro lado al resto del filtrado 1 se
añadió hasta saturación sulfato de
amonio, donde a concentraciones altas
de sal, están solvatados tantos iones
que se reduce la actividad del solvente
aún más. Por tanto, las interacciones
entre solutos se vuelven más fuertes que
las que se producen entre solutos y
solvente, lo que genera la separación
Filtrado 1. – Izquierda (positivo)
total de la proteína. Por ello la prueba de
Precipitado 1.- Derecha (positivo)
Biuret aplicada al filtrado 2 es negativa,
presentando una coloración azul, lo que
indica que no había más proteína o que
no hubo grupos mayores de 3 enlaces
peptídicos necesarios para formas el
complejo; por otro lado, esta prueba
aplicada al precipitado 2 es positiva,
dando una coloración violeta, que indica
positivo a presencia de proteína.
2.- Precipitación por efecto de pH y
solvente.
Filtrado 2.
Precipitado
Negativo Efecto de pH
2.Positivo
Se reduce la solubilidad de la proteína al
añadir el sulfato de amonio, debido a que
la presencia de la sal en la dilución
genera una competencia por las
moléculas de solvatación entre lo iones
salinos agregados y la proteína disuelta.
La proteína tiene en su superficie
distintas cargas que quedan expuestas
cuando ésta rompe su interacción En los tubos 1 y 3 que contenían HCl y
hidrolítica con las moléculas polares del regulador de acetatos (pH 4.7)
agua, por ello comienza la interacción respectivamente se observa la
entre los grupos cargados de proteína. precipitación de proteínas y baja
solubilidad ya que el pH de estas
Esto es evidente al realizar la prueba de sustancias se encuentra cercano al punto
Biuret en el filtrado y precipitado 1, que isoeléctrico de una de las proteínas
predominantes en la clara de huevo: la hacen a un pH superior al isoeléctrico de
ovoalbúmina, con un pI de 4.9. cada proteína, porque a este pH la
proteína esta disociada como proteína
En el tubo 2 que contenía NaOH, la clara
de huevo se solubilizó debido a que las negativa, lo que ocurre a un pH básico
proteínas se encontraban en un pH ocasionado por añadir sal, por lo tanto,
básico, alejado del punto isoeléctrico, las proteínas con carga neta negativa
donde las moléculas tienen carga neta interaccionan con el ion metálico positivo
negativa y son capaces de moverse en el para dar un precipitado insoluble de
campo eléctrico. proteinato metálico. Este precipitado fue
Efecto de pH y solvente observado en la prueba que contenía Pb,
Ag y Hg. Con Ba se un observó un ligero
precipitado en la parte inferior del tubo.
Mientras que aquellas pruebas con Na y
agua sólo lograron solubilizar la proteína.
4.- Determinación del punto isoeléctrico
de la insulina
Al agregar un solvente orgánico como el
etanol, disminuye la constante dieléctrica
de la solución acuosa de proteínas y
aumenta la interacción proteína-proteína
favoreciendo la precipitación de éstas.
Dicho hecho se observa en el tubo 1 y 3.
En el tubo 2 no se observa precipitado ya
que las proteínas se encontraban
solubilizadas y la cantidad de etanol En el tubo 3 se observó la formación de
agregada no fue la suficiente para un precipitado a un pH de 5.3, por lo que
disminuir la constante dieléctrica y podemos decir que este es el punto
acercar las moléculas de proteínas. isoeléctrico de la insulina, pues a este pH
la carga neta de esta proteína es igual a
3.- Precipitación por metales pesados
cero y sus moléculas pueden formar
agregados que precipitan.
En el resto de los tubos no hay presencia
de precipitado porque la proteína se
encuentra pura.
Conclusión
- Las proteínas pueden precipitar o
solubilizarse dependiendo de la
Los metales pesados son iones positivos
carga que tengan sus moléculas,
que tienden a precipitar las proteínas, lo
la constante dieléctrica del medio
y el pH del mismo.
- El punto isoeléctrico de la insulina
fue de 5.34.
Bibliografía
Libros electrónicos:
- Macarulla, J. M., Goñi, F. M.
“Biomoléculas: lecciones de
bioquímica estructural” 3ª. Ed.
Reverté, pp. 115-116, (1984).
- Quesada, S. M. “Manual de
experimentos de laboratorio para
bioquímica” Ed. Universidad
Estatal a Distancia, pp. 26-31,
(2007).
- Rivera, J. M., Garrido, A.
“Bioquímica estructural” Ed.
Tébar, pp. 84-87, (2001).
- Vasudevan, D. M., Sreekuman, S.
“Texto de bioquímica para
estudiantes de medicina” 6ª. Ed.
Cuéllar Ayala, pp. 35-38, (2011).
- Voet, D., Voet, J. G. “Bioquímica”
3ª. Ed. Medica Panamericana, pp.
135-141, (2006).
You might also like
- Reporte de Practica 1 FisiologiaDocument7 pagesReporte de Practica 1 FisiologiaHugoNo ratings yet
- Equipos Automatizados y SemiautomatizadosDocument8 pagesEquipos Automatizados y SemiautomatizadosKimberly Torres100% (2)
- Síntesis de Cloruro de Ter-ButiloDocument16 pagesSíntesis de Cloruro de Ter-ButiloKimberly TorresNo ratings yet
- Extracción MecánicaDocument40 pagesExtracción MecánicaAntonela Garibay Rubio60% (5)
- Practica No. 3 "Análisis de La Calidad Del Agua II. Determinación Microbiológica"Document4 pagesPractica No. 3 "Análisis de La Calidad Del Agua II. Determinación Microbiológica"Brenda M.No ratings yet
- Bitácora-Efecto de La Concentración de Enzima Sobre La Velocidad de Reacción-Efecto Del PH Sobre La Velocidad de ReacciónDocument5 pagesBitácora-Efecto de La Concentración de Enzima Sobre La Velocidad de Reacción-Efecto Del PH Sobre La Velocidad de ReacciónDynarko RuizNo ratings yet
- DNADocument2 pagesDNALi ClementeNo ratings yet
- Practica 9 BorradorDocument2 pagesPractica 9 BorradorMiguel Medina100% (1)
- Pract 3 Metodo de SangerDocument3 pagesPract 3 Metodo de SangerRay torresNo ratings yet
- Bitacora 4. Curva Tipo Azucares ReductoresDocument3 pagesBitacora 4. Curva Tipo Azucares ReductoresJavier AnguianoNo ratings yet
- Practica 2 Ecologia MicrobianaDocument5 pagesPractica 2 Ecologia MicrobianaMiguel LunaNo ratings yet
- Practica AutonomoDocument2 pagesPractica AutonomoHéctor BalmoriNo ratings yet
- Practica 2 Report eDocument10 pagesPractica 2 Report eEdson GonzalezNo ratings yet
- Determinación de Aminoácidos Terminales Con Grupo Alfa Amino Libre.Document1 pageDeterminación de Aminoácidos Terminales Con Grupo Alfa Amino Libre.Gonzalo UribeNo ratings yet
- Metodo de SangerDocument3 pagesMetodo de SangerBlankita AguirreNo ratings yet
- Practica DNADocument2 pagesPractica DNASyg Delgado100% (1)
- Efecto de Concentración de Sustrato e Inhibición Enzimática.Document2 pagesEfecto de Concentración de Sustrato e Inhibición Enzimática.H VandortNo ratings yet
- Practica Determinacion de Especies Alcalinas - Q. AnaliticaDocument6 pagesPractica Determinacion de Especies Alcalinas - Q. AnaliticaYoali Asiain LeconaNo ratings yet
- Bioquimica Reacciones de Aminoacidos y ProteinasDocument2 pagesBioquimica Reacciones de Aminoacidos y ProteinasEvelyn Jim 3295No ratings yet
- Gutiérrez - Ramírez - Erick - 7QV1 - Eq4 - 06-09-2021 - Reporte Práctica 2Document5 pagesGutiérrez - Ramírez - Erick - 7QV1 - Eq4 - 06-09-2021 - Reporte Práctica 2Erick GutierrezNo ratings yet
- Curva Tipo Azucares ReductoresDocument2 pagesCurva Tipo Azucares ReductoresJeeniffer CookieeNo ratings yet
- PRACTICANITROGENODocument9 pagesPRACTICANITROGENOBrenda M.No ratings yet
- Introduccion: ResultadosDocument3 pagesIntroduccion: ResultadosLuis RojasNo ratings yet
- SUCCÍNILDocument3 pagesSUCCÍNILMarcos Jhoan OrtizNo ratings yet
- Sustancias de ReservaDocument4 pagesSustancias de ReservaAlma KilmisterNo ratings yet
- Regulacion GlucemiaDocument4 pagesRegulacion GlucemiaJulieta Muñoz100% (1)
- Discusion Metodo de SangerDocument4 pagesDiscusion Metodo de SangerSandra MorenoNo ratings yet
- Deshidrogena SuccínicaDocument1 pageDeshidrogena SuccínicaAngel BeltranNo ratings yet
- Práctica 2Document4 pagesPráctica 2Nelly Aidee Avila LagunaNo ratings yet
- Reacciones de Proteínas IDocument3 pagesReacciones de Proteínas IEmriel96100% (1)
- Bradford Lowry SubDocument10 pagesBradford Lowry SubDanaé CruzNo ratings yet
- ConjugaciónDocument56 pagesConjugaciónOmar PopocaNo ratings yet
- DnaDocument2 pagesDnaSteele-GreyNo ratings yet
- Practica 5 Potencial de Accion y Simulacion Por ComputadoraDocument22 pagesPractica 5 Potencial de Accion y Simulacion Por ComputadoraAndresDuranNo ratings yet
- Oxido-Reductasas 2Document2 pagesOxido-Reductasas 2luis3felipe3lara3ortNo ratings yet
- P. Inhibición Por Aceites Esenciales de PlantasDocument17 pagesP. Inhibición Por Aceites Esenciales de PlantasMartha Aleida DelNo ratings yet
- Practica 5Document18 pagesPractica 5Gonzalo UribeNo ratings yet
- Discusion SuelosDocument60 pagesDiscusion SuelosVickyCervantesNo ratings yet
- Separacionde Una Mezcla de Azul de MetilenoDocument6 pagesSeparacionde Una Mezcla de Azul de MetilenogusNo ratings yet
- Reporte Práctica 1 - Método de SangerDocument3 pagesReporte Práctica 1 - Método de SangerAndy AldamaNo ratings yet
- Gama GlobulinaDocument17 pagesGama GlobulinaPamelaNo ratings yet
- Bitacora Bioquimica Practica 3 Reacciones ProteinasDocument3 pagesBitacora Bioquimica Practica 3 Reacciones ProteinasDiego AmrNo ratings yet
- Riboflavina ReporteDocument5 pagesRiboflavina ReporteBertario Ríos GarcíaNo ratings yet
- Práctica Aislamiento de Dna PlásmidicoDocument2 pagesPráctica Aislamiento de Dna PlásmidicoLuis RojasNo ratings yet
- Metodo de SangerDocument2 pagesMetodo de SangerggggggNo ratings yet
- LDHDocument2 pagesLDHENriqueNo ratings yet
- Práctica 5 AuxinasDocument4 pagesPráctica 5 AuxinasKenia AvilaNo ratings yet
- Reacción de Transaminación y Su Reconocimiento Por Medio de Cromatogafía en Papel 1Document4 pagesReacción de Transaminación y Su Reconocimiento Por Medio de Cromatogafía en Papel 1karla0% (1)
- Yema de Huevo Bioquimica Colesterol EncnbDocument3 pagesYema de Huevo Bioquimica Colesterol EncnbFabian KuronoNo ratings yet
- Oxido Reduccion 2Document5 pagesOxido Reduccion 2Adriana BuendíaNo ratings yet
- Practica 12 EcoDocument4 pagesPractica 12 EcoZuri ManriqueNo ratings yet
- DNA Guayaba - Identificación Bases NitrogenadasDocument3 pagesDNA Guayaba - Identificación Bases NitrogenadasRosalba Hernández100% (1)
- Separacion de FosfolipidosDocument2 pagesSeparacion de Fosfolipidosironspidey10No ratings yet
- Practica 11Document4 pagesPractica 11Hector0% (1)
- Induccion de Mutantes en Escherichia Coli 1Document84 pagesInduccion de Mutantes en Escherichia Coli 1Encb IpnNo ratings yet
- GlocogenoDocument3 pagesGlocogenoAngel Jimenez GalvanNo ratings yet
- Prueba de SuperoxolDocument7 pagesPrueba de SuperoxolFeer GomezNo ratings yet
- Diagrama - Síntesis de 2,3-DifenilquinixalinaDocument1 pageDiagrama - Síntesis de 2,3-DifenilquinixalinaAndy AldamaNo ratings yet
- Practica 1 Sanger BioquimicaDocument2 pagesPractica 1 Sanger BioquimicaYosafat Gutierrez67% (3)
- Bioquímica Reacciones Óxido-Reducción de La LDHDocument1 pageBioquímica Reacciones Óxido-Reducción de La LDHPaoli Ruiz100% (1)
- Reporte Practica 8 FosfolípidosDocument2 pagesReporte Practica 8 FosfolípidosAlex DVNo ratings yet
- An - Lisis de La Calidad Del Agua I Determinaciones Fisicoqu - MicasDocument7 pagesAn - Lisis de La Calidad Del Agua I Determinaciones Fisicoqu - MicasEdwin CruzNo ratings yet
- Práctica 1 S-1 E-2Document2 pagesPráctica 1 S-1 E-2Karla MedinaNo ratings yet
- SCC 7Document6 pagesSCC 7Kimberly TorresNo ratings yet
- EXAMENDocument2 pagesEXAMENKimberly Torres100% (1)
- Reacción HillDocument8 pagesReacción HillKimberly Torres100% (1)
- Reporte ReceptoresDocument13 pagesReporte ReceptoresKimberly Torres100% (1)
- Adicion Electrofilica de AlquinosDocument25 pagesAdicion Electrofilica de AlquinosKimberly TorresNo ratings yet
- Aislamiento de FagosDocument7 pagesAislamiento de FagosKimberly TorresNo ratings yet
- P.11 EspirometriaDocument13 pagesP.11 EspirometriaKimberly TorresNo ratings yet
- Obtención de GlucógenoDocument3 pagesObtención de GlucógenoKimberly TorresNo ratings yet
- Reporte 2 SCCDocument12 pagesReporte 2 SCCKimberly TorresNo ratings yet
- Reacciones Enzimáticas de Óxido-ReducciónDocument4 pagesReacciones Enzimáticas de Óxido-ReducciónKimberly Torres100% (1)
- SeparacionDocument4 pagesSeparacionKimberly TorresNo ratings yet
- Reporte 2 SCCDocument12 pagesReporte 2 SCCKimberly TorresNo ratings yet
- MicetomasDocument4 pagesMicetomasKimberly Torres100% (1)
- Técnicas de AislamientoDocument2 pagesTécnicas de AislamientoKimberly TorresNo ratings yet
- Técnicas de MicrocultivoDocument6 pagesTécnicas de MicrocultivoKimberly Torres100% (2)
- Morfología ColonialDocument10 pagesMorfología ColonialKimberly TorresNo ratings yet
- ¿Qué Es La Terbinafina?Document2 pages¿Qué Es La Terbinafina?Kimberly TorresNo ratings yet
- Practica 10Document3 pagesPractica 10Kimberly Torres50% (4)
- Practica 5Document2 pagesPractica 5Kimberly TorresNo ratings yet
- Reacción de Claisen SchmidtDocument3 pagesReacción de Claisen SchmidtKimberly TorresNo ratings yet
- Practica 11Document3 pagesPractica 11Kimberly TorresNo ratings yet
- T3.3 El Magnesio y Sus AleacionesDocument31 pagesT3.3 El Magnesio y Sus AleacionesOswaldo GomezNo ratings yet
- Informe de Laboratorio 1 Corte ConducciónDocument11 pagesInforme de Laboratorio 1 Corte ConducciónAndres MartinezNo ratings yet
- Taller Densidad, Masa y VolumenDocument2 pagesTaller Densidad, Masa y VolumenMaría AntoniaNo ratings yet
- Módulo IV. Fundamentos Teóricos y TécnicosDocument153 pagesMódulo IV. Fundamentos Teóricos y TécnicosDavid S. Fornés Mas100% (3)
- Termoterapia PDFDocument8 pagesTermoterapia PDFIvania Carolina Broca Bermudez0% (1)
- Docsity Solucion de Equilibrio QuimicoDocument15 pagesDocsity Solucion de Equilibrio QuimicocaritoNo ratings yet
- Titanio Grado 2Document2 pagesTitanio Grado 2AlvialvarezNo ratings yet
- Capacidad de Campo y Punto de Marchitez PermanenteDocument16 pagesCapacidad de Campo y Punto de Marchitez PermanenteJessica Herazo Aguas100% (1)
- 400dis 1Document11 pages400dis 1Yuriko ArakakiNo ratings yet
- Tectosilicatos - Grupo de La SiliceDocument10 pagesTectosilicatos - Grupo de La SilicePatricia Arancibia SimpertigueNo ratings yet
- Teoría de Osmosis InversaDocument27 pagesTeoría de Osmosis InversaAlan BlancoNo ratings yet
- Linea Del Tiempo BioDocument3 pagesLinea Del Tiempo BioFedra MendezNo ratings yet
- Elementos de Máquinas - J. ViñolasDocument133 pagesElementos de Máquinas - J. ViñolasJuan Sánchez Rosas100% (2)
- Cómo Pintar Un BarcoDocument24 pagesCómo Pintar Un BarcoJoan Garau SerraNo ratings yet
- 04 Ecologia 2do ParcialDocument76 pages04 Ecologia 2do ParcialJaime MKNo ratings yet
- Tarea 4 - Cinetica y Superficies - Individual1Document24 pagesTarea 4 - Cinetica y Superficies - Individual1CARMENZA100% (1)
- Póster Científico Grupo 4Document1 pagePóster Científico Grupo 4Gary Vicenzo Rivera LeivaNo ratings yet
- Cns-nt-11-13 - Especificaciones Técnicas de Ductos, Curvas y Accesorios Metálicos.Document13 pagesCns-nt-11-13 - Especificaciones Técnicas de Ductos, Curvas y Accesorios Metálicos.Cleider DayanNo ratings yet
- Metabolism de Nucleotidos ADocument26 pagesMetabolism de Nucleotidos AJhojan Derlis QZNo ratings yet
- Dosificacion de Cloro para Agua PotableDocument4 pagesDosificacion de Cloro para Agua PotableAndresArrauthNo ratings yet
- Diversidad de Líquenes Cortícolas y Calidad de Aire en El Distrito de HuancayoDocument127 pagesDiversidad de Líquenes Cortícolas y Calidad de Aire en El Distrito de HuancayoRuben SierraNo ratings yet
- Catálogo de BaratisimoDocument97 pagesCatálogo de BaratisimoAriana Leon VerasteguiNo ratings yet
- Tesis MetodologiaDocument108 pagesTesis Metodologialeonarditopoe binbinpinNo ratings yet
- Mono Etsi Gongora - Hernandez PDFDocument50 pagesMono Etsi Gongora - Hernandez PDFfreddy.sucuytanaNo ratings yet
- Intruccion Del JinchanDocument3 pagesIntruccion Del JinchanMercedes Guillermina Godoy BarbosaNo ratings yet
- TubingDocument5 pagesTubingAntonio LantiguaNo ratings yet
- Enlace Covalente e IonicoDocument2 pagesEnlace Covalente e IonicoKa TherineNo ratings yet
- La Materia y Sus Estados (Soluciones)Document1 pageLa Materia y Sus Estados (Soluciones)zemborizadoscribdNo ratings yet