Professional Documents
Culture Documents
Sem Crist
Uploaded by
Christian Valencia0 ratings0% found this document useful (0 votes)
807 views3 pagesEste documento fornece exemplos de cálculos de cristalização envolvendo várias substâncias químicas como sulfato de sódio, sulfato de potássio, sulfato de magnésio, carbonato de sódio, sacarose e nitrato de sódio. Os exemplos cobrem cálculos de peso de cristais formados, rendimento de cristalização, percentagem de sal cristalizado e quantidade de água evaporada para atingir a saturação.
Original Description:
ejercicios reactores
Copyright
© © All Rights Reserved
Available Formats
PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentEste documento fornece exemplos de cálculos de cristalização envolvendo várias substâncias químicas como sulfato de sódio, sulfato de potássio, sulfato de magnésio, carbonato de sódio, sacarose e nitrato de sódio. Os exemplos cobrem cálculos de peso de cristais formados, rendimento de cristalização, percentagem de sal cristalizado e quantidade de água evaporada para atingir a saturação.
Copyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
807 views3 pagesSem Crist
Uploaded by
Christian ValenciaEste documento fornece exemplos de cálculos de cristalização envolvendo várias substâncias químicas como sulfato de sódio, sulfato de potássio, sulfato de magnésio, carbonato de sódio, sacarose e nitrato de sódio. Os exemplos cobrem cálculos de peso de cristais formados, rendimento de cristalização, percentagem de sal cristalizado e quantidade de água evaporada para atingir a saturação.
Copyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
You are on page 1of 3
LABORATORIO DE OPERACIONES UNITARIAS
UNIVERSIDAD DE CHILE
GUIA DE EJERCICIOS DE OPERACIONES UNITARIAS II
CRISTALIZACION
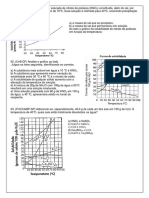
1.- 1000 Kg de una disolución saturada a 40°C de sulfato sódico en
agua se enfrían hasta 10°C. Calcular:
a) El peso de cristales separados en la operación.
( R: 679 Kg )
b) El rendimiento de cristalización. (
R: 92% )
Datos: La solubilidad del sulfato sódico, en mol-g de Na2SO4, por
1000 g de agua es la siguiente:
Na2SO4 ·10 H2O Na2SO4
Temperatura °C 0 10 20 30 32,4 35 40
Solubilidad 0,3 0,6 1,33 2,8 3,50 3,4 3,4
4 6 8 5 0
2.- Por evaporación a 60°C, se ha concentrado hasta saturación una
disolución de K2SO4. Calcular la temperatura a que habrá de ser
enfriada en el cristalizador para que precipite el 55% de sulfato
potásico.
Datos : Solubilidad K2SO4, en mol-g/100 g de agua.
Temperatura 0 10 20 30 40 60
°C
Solubilidad 0,423 0,53 0,67 0,74 0,85 1,040
0 0 0 0
( R: 4-5°C )
3.- 800 Kg de solución de MgSO4 al 32% en agua se calienta suavemente
a 25°C. Debido al calentamiento la quinta parte del agua presente
originalmente se evapora. Parte de la sal se precipita en forma de
cristales de MgSO4 ·7 H2O.
Si la solubilidad del MgSO4 anhidro a 25°C es de 17 g/100 g de
agua.
a) ¿Qué peso de MgSO4 ·7 H2O cristaliza? ( R: 454
Kg )
b) ¿Qué % en peso del MgSO4 cristaliza? (
R: 86,54% )
4.- 2000 lb de solución de Na2CO3 al 30% en agua se calienta
suavemente a 20°C. Durante el calentamiento el 10% del agua
presente originalmente se evapora. Parte del carbonato de sodio se
precipita en forma de cristales Na2CO3 ·10 H2O. Si la solubilidad
del Na2CO3 anhidro a 20°C es de 21,5 lb/100 lb agua. i) ¿Qué peso
de Na2CO3 ·10 H2O cristaliza?. ii) ¿Cómo comprueba los resultados
obtenidos?. Verifíquelo.
( R: i) 1403 )
( R: ii) por balance
de agua )
5.- Una solución consistente de 30% MgSO4 y 70% agua es enfriada a
60°F. Durante el enfriamiento el 5% del agua total es evaporada.
i) ¿Cuántos Kg de cristales (MgSO4 ·7 H2O) son obtenidos por Kg de
alimentación si la solución saturada a 60°F contiene 24,5 %
MgSO4?.
ii) ¿Qué % del MgSO4 inicial logra cristalizar?.
( R: i) 0,26 Kg cristal/Kg
alimentación )
( R: ii) 43% )
6.- En la etapa final de la obtención de la sacarosa en una planta
de la IANSA se tienen 10.000 Kg de solución acuosa al 20% la cual
se concentra por evaporación a 100°C hasta la saturación. Esta
solución saturada es luego enfriada a 20°C. Los cristales de
sacarosa se separan por centrifugación. 0,05 Kg de solución se
adhieren a cada Kg de cristales. Cuando los cristales se secan la
sacarosa de la solución adherida se deposita sobre aquellos.
La solubilidad de la sacarosa a 100°C es de 5 Kg/Kg de agua y de 2
Kg/Kg de agua a 20°C. Calcule:
a) La cantidad de agua evaporada para conseguir la saturación a
100°C.
b) El peso total de sacarosa obtenida
( R: a)
7000 Kg agua )
( R: b)
1240 Kg )
7.- Una tonelada corta (2000 lb) de solución NaNO3 al 25% se
concentra por evaporación a 100°C hasta la saturación. Esta
solución saturada es luego enfriada a 20°C. Los cristales de NaNO3
se separan por filtración. Un décimo de lb de solución se adhiere
a cada lb de cristales. Cuando los cristales se secan, el NaNO3 de
la solución adherida se deposita sobre aquellos.
La solubilidad del NaNO3 a 100°C es de 1,75 lb/lb de agua y de
0,88 lb/lb de agua a 20°C.
Calcule:
a) La cantidad de agua evaporada para conseguir la saturación a
100°C
b) El peso total de NaNO3 obtenido.
( R: a) 1216 lb
agua )
( R: b) 261,7 lb NaNO3 )
You might also like
- No IsotermicoDocument10 pagesNo IsotermicoYaiser PeñaNo ratings yet
- Ejercicios Unidad 3 - 2Document31 pagesEjercicios Unidad 3 - 2Masiel ChuraNo ratings yet
- Actividades, TareasDocument120 pagesActividades, TareasAdriana Estefania Tomalá GómezNo ratings yet
- 4ListadoEnergia Gibbs HelmholtzDocument2 pages4ListadoEnergia Gibbs Helmholtzgustav23450% (2)
- Constantes AntoineDocument13 pagesConstantes AntoineAnthony Rizzo LombardiNo ratings yet
- METODOSNUMERICOSTERCERAEDICIONANTONIONIEVESDocument174 pagesMETODOSNUMERICOSTERCERAEDICIONANTONIONIEVESMarco Antonio CQ100% (1)
- Sistemas Unifasicos Parte 1Document62 pagesSistemas Unifasicos Parte 1Laura SanchezNo ratings yet
- Tabela AletasDocument1 pageTabela Aletasdemolish89No ratings yet
- Lista+de+exercícios+para+1 +prova+Quimica+AnalíticaDocument5 pagesLista+de+exercícios+para+1 +prova+Quimica+Analíticabenedito.nasaNo ratings yet
- Exercícios de Revisão para 2 AvaliaçãoDocument1 pageExercícios de Revisão para 2 AvaliaçãoNazareno BragaNo ratings yet
- Solubilidade PDFDocument1 pageSolubilidade PDFelaineNo ratings yet
- Aula01 Quimica2 ExercíciosDocument4 pagesAula01 Quimica2 ExercíciosMarko Aurelio Ferreira Da CostaNo ratings yet
- Coeficiente de SolubilidadeDocument5 pagesCoeficiente de SolubilidadeRubia MariathNo ratings yet
- Lista de Exercicios de SolucoesDocument2 pagesLista de Exercicios de SolucoesGraciano ComboioNo ratings yet
- Quimica 2 Ano 2 ParteDocument19 pagesQuimica 2 Ano 2 ParteJoão PauloNo ratings yet
- Fisico Quimica Solubilidade Exercicios GabaritoDocument10 pagesFisico Quimica Solubilidade Exercicios GabaritoLuana GregórioNo ratings yet
- Arquivo de Soluções Do Prof° VieiraDocument9 pagesArquivo de Soluções Do Prof° VieiravieirasalesNo ratings yet
- C4 Cursob Quimica 30aulas ProfDocument12 pagesC4 Cursob Quimica 30aulas ProfTiago RodriguesNo ratings yet
- Atividade 5 de Abril - Pré ProvaDocument5 pagesAtividade 5 de Abril - Pré ProvaAlfredo Sahade VespaNo ratings yet
- Lista de Exercícios - SoluçõesDocument3 pagesLista de Exercícios - SoluçõesJeane Rodrigues BrederNo ratings yet
- Gama - Módulo 19Document23 pagesGama - Módulo 19Koelho CoelhoNo ratings yet
- Lista Execicios Soluções BoaDocument2 pagesLista Execicios Soluções BoadanzootecNo ratings yet
- LAB 08 - Determinação Do Cloro Livre Numa Lexívia ComercialDocument3 pagesLAB 08 - Determinação Do Cloro Livre Numa Lexívia Comercialaamorim2No ratings yet
- Exercicios de Coeficiente de SolubilidadeDocument4 pagesExercicios de Coeficiente de SolubilidadeCleber SerafinNo ratings yet
- Fisico Quimica Solubilidade ExerciciosDocument10 pagesFisico Quimica Solubilidade ExerciciosRubia MariathNo ratings yet
- Solubilidade Das Soluções PDFDocument10 pagesSolubilidade Das Soluções PDFreykonpalNo ratings yet
- Fisico Quimica Solubilidade Exercicios Gabarito PDFDocument10 pagesFisico Quimica Solubilidade Exercicios Gabarito PDFEmerson JuniorNo ratings yet
- DispersõeDocument5 pagesDispersõeHelton ClistenesNo ratings yet
- 16 SolubilidadeDocument7 pages16 SolubilidadeFRANKE MERO TESTENo ratings yet
- Gabarito Lista 1 - SoluçõesDocument5 pagesGabarito Lista 1 - Soluçõesbrigida.lucinNo ratings yet
- Folha de Problemas 1Document6 pagesFolha de Problemas 1DeboraECarlaCastelbrancoNo ratings yet
- CE Quimica 2 Ano 1 BimDocument12 pagesCE Quimica 2 Ano 1 Bimguilhermestadlerdefreitas1No ratings yet
- Curva de SolubilidadeDocument5 pagesCurva de Solubilidadealexchacal100% (2)
- Exercicios de SolubilidadeDocument6 pagesExercicios de Solubilidadesua mae de 4No ratings yet
- Lista de Exercícios-1° Bimestre Prof. AndersonDocument3 pagesLista de Exercícios-1° Bimestre Prof. AndersondankRN100% (1)
- Atividade 02 PDFDocument3 pagesAtividade 02 PDFCassio RezendeNo ratings yet
- Aula Química - Soluções PDFDocument2 pagesAula Química - Soluções PDF27.marcos9521No ratings yet
- Folha 3Document4 pagesFolha 3Pedro FerreiraNo ratings yet
- Exercicios de Revisao ReavaliaçãoDocument3 pagesExercicios de Revisao ReavaliaçãoMarcelo NazarioNo ratings yet
- Exerc Coef SolubilidadeDocument2 pagesExerc Coef Solubilidadelopesqui1766No ratings yet
- Jan2024 - Apostila de Exercícios QuímicaDocument4 pagesJan2024 - Apostila de Exercícios Químicagabrieleduardo20066No ratings yet
- Exercícios de Revisão - 2 AnoDocument2 pagesExercícios de Revisão - 2 AnoJonathan AraújoNo ratings yet
- Lista de Exercícios - SoluçõesDocument4 pagesLista de Exercícios - SoluçõesWellington SantosNo ratings yet
- Lista de Exercc3adcio Soluc3a7c3b5esDocument5 pagesLista de Exercc3adcio Soluc3a7c3b5esAna Ester CavalcanteNo ratings yet
- A) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Document5 pagesA) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Ágata Ferreira S.1.T.10No ratings yet
- Aula 7 - Exercícios - Soluções 2018.2Document1 pageAula 7 - Exercícios - Soluções 2018.2Tiago ReisNo ratings yet
- Química III - Prof. Vanderlei Rodrigo Bettiol Exercícios Propriedades ColigativasDocument2 pagesQuímica III - Prof. Vanderlei Rodrigo Bettiol Exercícios Propriedades ColigativasVr BettiolNo ratings yet
- 16 SolubilidadeDocument6 pages16 SolubilidadeEverton FisicoNo ratings yet
- Exercícios de Soluções - P CasaDocument2 pagesExercícios de Soluções - P CasaMatheus HenriqueNo ratings yet
- Lista SoluçoesDocument2 pagesLista SoluçoesVitor GabrielNo ratings yet
- Lista 2 Maio 2013 PDFDocument7 pagesLista 2 Maio 2013 PDFLorena CezarNo ratings yet
- 11FQ SolubilidadeDocument9 pages11FQ SolubilidadeJoana GulamhussenNo ratings yet
- Lista de Exercício - SoluçõesDocument3 pagesLista de Exercício - SoluçõesNathalia Muniz Distik100% (1)
- Exercício de SoluçõesDocument2 pagesExercício de SoluçõesRodrigo TadeuNo ratings yet
- Lista de Exercício de Soluções QuímicaDocument3 pagesLista de Exercício de Soluções QuímicaEduarda CoelhoNo ratings yet
- Primeira Lista Exercícios Resolvida - BME - 2021-1Document45 pagesPrimeira Lista Exercícios Resolvida - BME - 2021-1Hugo LuizNo ratings yet
- Titulação de Oxirredução.Document2 pagesTitulação de Oxirredução.Paulo XavierNo ratings yet
- LISTA 4 - CristalizaçãoDocument2 pagesLISTA 4 - Cristalizaçãomari_afonso_xpNo ratings yet
- Qui MicaDocument7 pagesQui MicawggonzagaNo ratings yet
- Exp 8 - Síntese Oxalato de Cobalto HidratadoDocument5 pagesExp 8 - Síntese Oxalato de Cobalto HidratadoNando KissNo ratings yet
- FB FBI Tecnal Sist BatenteDocument2 pagesFB FBI Tecnal Sist BatentegiselarodriguesNo ratings yet
- Eletrostática: BCJ-0203 Fenômenos Eletromagnéticos Experimento 1Document9 pagesEletrostática: BCJ-0203 Fenômenos Eletromagnéticos Experimento 1Thiago OmenaNo ratings yet
- "Introdução Às Microtecnologias" MicrofabricaçãoDocument68 pages"Introdução Às Microtecnologias" MicrofabricaçãoPedro TeixeiraNo ratings yet
- Detergentes Catálogo-EspDocument7 pagesDetergentes Catálogo-EspPaola Andrea Del Rio RuizNo ratings yet
- 9 Aula - Amalgama DentalDocument34 pages9 Aula - Amalgama DentalOtrebor HtimazNo ratings yet
- Boas Práticas Na Manutenção Da Arma de FogoDocument25 pagesBoas Práticas Na Manutenção Da Arma de FogoDanilo Silva100% (1)
- Aços MaragingDocument101 pagesAços MaragingferrergioNo ratings yet
- Estudo de Caso Com A Reutilização de Material Fresado Como Revestimento Primário Nas Vias. Alessandro Moschetta 2016 PDFDocument104 pagesEstudo de Caso Com A Reutilização de Material Fresado Como Revestimento Primário Nas Vias. Alessandro Moschetta 2016 PDFgustavo henrique0% (1)
- Universidade PúnguèDocument44 pagesUniversidade Púnguèclube de inteligência e desenvolvimento coletivoNo ratings yet
- Aula 02 Pedras NaturaisDocument49 pagesAula 02 Pedras NaturaisRicardo RochaNo ratings yet
- Aula 2 - Sistemas de Abastecimento de ÁguaDocument72 pagesAula 2 - Sistemas de Abastecimento de Águanefek evilantNo ratings yet
- Flávio Roberto - Trabalho de PilhaDocument4 pagesFlávio Roberto - Trabalho de PilhaFlávio JúniorNo ratings yet
- Solos Ensaio Tátil VisualDocument35 pagesSolos Ensaio Tátil VisualDayane FerreiraNo ratings yet
- Trabalho Acidos BasesDocument29 pagesTrabalho Acidos BasesCaroline SantosNo ratings yet
- Gas Catalogo RESULDocument108 pagesGas Catalogo RESULAntonio VazNo ratings yet
- Catálogo PromachDocument11 pagesCatálogo PromachHENKO7659No ratings yet
- Cimentos e Concretos-Engenharia CivilDocument25 pagesCimentos e Concretos-Engenharia CivilsrtalopezNo ratings yet
- Análise de Ferro E Umidade Do Sal de Cozinha Por GravimetriaDocument7 pagesAnálise de Ferro E Umidade Do Sal de Cozinha Por GravimetriaIgor Botelho De AlmeidaNo ratings yet
- Guia Mecanismo de DanosDocument172 pagesGuia Mecanismo de DanosWyllton CandidoNo ratings yet
- Resmatii Lista01Document2 pagesResmatii Lista01Thiago RomaniniNo ratings yet
- Operações Unitárias de Laboratório - EquipamentosDocument11 pagesOperações Unitárias de Laboratório - EquipamentosLuan GabrielNo ratings yet
- Trabalho de QuimicaDocument8 pagesTrabalho de QuimicaLeonilde Domingos Poteiro MUFUMENo ratings yet
- Metodos CromatograficosDocument20 pagesMetodos CromatograficosPatricia Lopes LealNo ratings yet
- Teoria Das Bandas em MetaisDocument12 pagesTeoria Das Bandas em MetaisDiêgo MarcosNo ratings yet
- MC Aula 7 Classificacao AbntDocument4 pagesMC Aula 7 Classificacao AbntMileine Cristine MarinNo ratings yet
- Como Fazer Adubo Com o Lixo Orgânico Que Você Produz em CasaDocument4 pagesComo Fazer Adubo Com o Lixo Orgânico Que Você Produz em CasaTigre CuboNo ratings yet
- CM - Aula 01 - Classificação Dos Materiais PDFDocument47 pagesCM - Aula 01 - Classificação Dos Materiais PDFCacá PimentelNo ratings yet
- Química - Pré-Vestibular Impacto - Exercícios Extras - Ligações Químicas 02Document2 pagesQuímica - Pré-Vestibular Impacto - Exercícios Extras - Ligações Químicas 02Química Qui100% (6)
- Curso Básico Mecânica Dos Solos - Carlos de Souza Pinto. 3 Ed PDFDocument363 pagesCurso Básico Mecânica Dos Solos - Carlos de Souza Pinto. 3 Ed PDFCarolina López100% (1)
- Introdução e Fenomenologia Da Transferência de MassaDocument26 pagesIntrodução e Fenomenologia Da Transferência de MassaSara FariaNo ratings yet