Professional Documents
Culture Documents
Term Odin A Mica
Uploaded by
angellyOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Term Odin A Mica
Uploaded by
angellyCopyright:
Available Formats
Dimas Cordero Gualdron 1511025886
Julian Rodriguez Bohorquez 1621982003
Jose Gabriel Franco Castaño 1621982285
Francy Yazmin Caicedo Diaz
1-
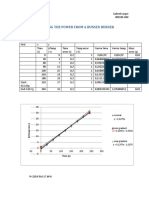
Cp solido Cp solido Cp solido Cp solido Cp solido Cp solido
INTEGRANTE A B C D E F
225.35 126.92 384.92 451.44 621.03 896.06
Julian Rodriguez
233.06 127.89 384.43 450.54 621.68 896.95
227.41 124.09 385.00 449.96 621.35 895.39
Jose G. Franco
233.94 127.86 384.80 451.44 621.04 896.35
233.92 127.21 384.83 452.00 621.97 896.35
Francy Y. Caicedo
233.72 127.64 383.33 451.80 621.18 896.36
234.00 128.00 383.00 452.00 621.00 896.00
Dimas Cordero
234.00 127.00 384.00 452.00 622.00 895.00
PROMEDIO 231.93 127.08 384.29 451.40 621.41 896.06
3- Compare nuevamente los resultados entre las configuraciones de un mismo sólido.
¿Son iguales?, varían? ¿De qué depende?
Recopilando el ejercicio de cada uno de nosotros tenemos los siguientes datos
Cp solido Cp solido Cp solido Cp solido Cp solido Cp solido
INTEGRANTE A B C D E F
225.35 126.92 384.92 451.44 621.03 896.06
Julian Rodriguez
233.06 127.89 384.43 450.54 621.68 896.95
227.41 124.09 385.00 449.96 621.35 895.39
Jose G. Franco
233.94 127.86 384.80 451.44 621.04 896.35
233.92 127.21 384.83 452.00 621.97 896.35
Francy Y. Caicedo
233.72 127.64 383.33 451.80 621.18 896.36
234.00 128.00 383.00 452.00 621.00 896.00
Dimas Cordero
234.00 127.00 384.00 452.00 622.00 895.00
PROMEDIO 231.93 127.08 384.29 451.40 621.41 896.06
Vemos en la tabla que realmente la variación mas grande solo la tenemos en el solido "A"
pero no supera un 3% la diferencia. Entonces la variación no es significativa debido a que el
calor suministrado es a una misma sustancia en este caso para todos los sólidos la sustancia
es el agua; es decir sabemos que es necesario una cantidad de calor de una caloría para
aumentar en un grado centigrado un gramo de agua .
Que solido tiene el 𝑐" mas alto? Que significa que un material tenga una capacidad
calorífica más alta o más baja en términos de transferencia de calor.
EL solido con el Cp mas alto, es el F, allí vemos como la temperatura final aumenta en un
gran porcentaje. Si un material tiene una capacidad calorífica mas alta o baja quiere decir que
habrá sustancias que necesitaran menor o mayor cantidad de calor para elevar la temperatura
en un grado.
Intervalos
Cp solido A: [221.48, 242.37]
Cp solido B: [123.25, 130.91]
Cp solido C: [381.98, 386.60]
Cp solido D: [449.11, 453.68]
Cp solido E: [620.14, 622.67]
Cp solido F: [894.22, 897.90]
¿considerando el intervalo [𝑥 − 3𝜇, 𝑥 + 3𝜇] es necesario descartar valores en
cada caso?
R/ Considerando el intervalo de Cp para cada solido no se encuentran valores extremos así
que se llega a la conclusión de que no es necesario descartar ningún valor.
¿Considera que debe ser usado el factor de corrección t de Student en cada
caso?
R/ Sí se considera necesario usar el factor de corrección de t de student pues el numero de
mediciones que tenemos no es muy grande. Tuvimos 8 mediciones para cada solido; como
en este caso N-1= 7 no estaba en nuestra tabla de valores de t de student se utilizó la siguiente
escogiendo un nivel de confianza del 99%
6- la madera de la sartén tiene una mayor capacidad calorífica, pues aunque tenemos una
cantidad de calor similar tanto en la madera como en el metal la temperatura de la madera no
aumenta tato como en el metal y es posible tomarla sin quemarnos, esto debido a su alta
capacidad calorífica entonces tiene un aumento de temperatura menor que el metal si se
exponen al mismo calor.
ANALISIS DE LOS RESULTADOS
7-El calor específico del cobre es de aproximadamente 0.4 J/g°C. ¿Cuánto calor se necesita para
cambiar la temperatura de una muestra de 30 gramos de cobre de 20 °C a 60 °C?
ΔT = 60 − 20 = 40°c = 40k
La capacidad calorífica molar es la capacidad calorífica de 1 mol de sustancia.
Empleando los pesos atómicos del hidrógeno y el oxígeno, tenemos 1 mol cu
=63.5 g de cu. A partir del calor específico dado en la parte (a), tenemos:
𝑞 = (0.4 J/g°C)*(63,5g/mol)= 25.4 J/mol*°k*40k= 1016j/mol
7. Un vaso contiene 200 g=0,2kg de H2O a 20 °C, si el agua gana 11.7 KJ=11700j y
alcanza una temperatura constante. Cual será esa nueva temperatura ? El calor
especifico del agua es 1 cal/g*°C.= 4180j/kg*°C
𝑞
𝑐𝑝 =
𝑚 ∗ tf − ti)
(
𝑞
(𝑡𝑓 − 𝑡𝑖) =
𝑚 ∗ 𝑐𝑝
𝑞 11700j
𝑡𝑓 = + 𝑡𝑖 = + 20°𝑐 = 33.99°𝑐
𝑚 ∗ 𝑐𝑝 0,2kg ∗ 4180j/kg ∗ °C
You might also like
- A Heartbreaking Work Of Staggering Genius: A Memoir Based on a True StoryFrom EverandA Heartbreaking Work Of Staggering Genius: A Memoir Based on a True StoryRating: 3.5 out of 5 stars3.5/5 (231)
- The Sympathizer: A Novel (Pulitzer Prize for Fiction)From EverandThe Sympathizer: A Novel (Pulitzer Prize for Fiction)Rating: 4.5 out of 5 stars4.5/5 (119)
- Never Split the Difference: Negotiating As If Your Life Depended On ItFrom EverandNever Split the Difference: Negotiating As If Your Life Depended On ItRating: 4.5 out of 5 stars4.5/5 (838)
- Devil in the Grove: Thurgood Marshall, the Groveland Boys, and the Dawn of a New AmericaFrom EverandDevil in the Grove: Thurgood Marshall, the Groveland Boys, and the Dawn of a New AmericaRating: 4.5 out of 5 stars4.5/5 (265)
- The Little Book of Hygge: Danish Secrets to Happy LivingFrom EverandThe Little Book of Hygge: Danish Secrets to Happy LivingRating: 3.5 out of 5 stars3.5/5 (399)
- Grit: The Power of Passion and PerseveranceFrom EverandGrit: The Power of Passion and PerseveranceRating: 4 out of 5 stars4/5 (587)
- The World Is Flat 3.0: A Brief History of the Twenty-first CenturyFrom EverandThe World Is Flat 3.0: A Brief History of the Twenty-first CenturyRating: 3.5 out of 5 stars3.5/5 (2219)
- The Subtle Art of Not Giving a F*ck: A Counterintuitive Approach to Living a Good LifeFrom EverandThe Subtle Art of Not Giving a F*ck: A Counterintuitive Approach to Living a Good LifeRating: 4 out of 5 stars4/5 (5794)
- Team of Rivals: The Political Genius of Abraham LincolnFrom EverandTeam of Rivals: The Political Genius of Abraham LincolnRating: 4.5 out of 5 stars4.5/5 (234)
- Shoe Dog: A Memoir by the Creator of NikeFrom EverandShoe Dog: A Memoir by the Creator of NikeRating: 4.5 out of 5 stars4.5/5 (537)
- The Emperor of All Maladies: A Biography of CancerFrom EverandThe Emperor of All Maladies: A Biography of CancerRating: 4.5 out of 5 stars4.5/5 (271)
- The Gifts of Imperfection: Let Go of Who You Think You're Supposed to Be and Embrace Who You AreFrom EverandThe Gifts of Imperfection: Let Go of Who You Think You're Supposed to Be and Embrace Who You AreRating: 4 out of 5 stars4/5 (1090)
- Her Body and Other Parties: StoriesFrom EverandHer Body and Other Parties: StoriesRating: 4 out of 5 stars4/5 (821)
- The Hard Thing About Hard Things: Building a Business When There Are No Easy AnswersFrom EverandThe Hard Thing About Hard Things: Building a Business When There Are No Easy AnswersRating: 4.5 out of 5 stars4.5/5 (344)
- Hidden Figures: The American Dream and the Untold Story of the Black Women Mathematicians Who Helped Win the Space RaceFrom EverandHidden Figures: The American Dream and the Untold Story of the Black Women Mathematicians Who Helped Win the Space RaceRating: 4 out of 5 stars4/5 (890)
- Residential Duct SystemsDocument66 pagesResidential Duct Systemssundarhvac90% (10)
- Elon Musk: Tesla, SpaceX, and the Quest for a Fantastic FutureFrom EverandElon Musk: Tesla, SpaceX, and the Quest for a Fantastic FutureRating: 4.5 out of 5 stars4.5/5 (474)
- The Unwinding: An Inner History of the New AmericaFrom EverandThe Unwinding: An Inner History of the New AmericaRating: 4 out of 5 stars4/5 (45)
- The Yellow House: A Memoir (2019 National Book Award Winner)From EverandThe Yellow House: A Memoir (2019 National Book Award Winner)Rating: 4 out of 5 stars4/5 (98)
- On Fire: The (Burning) Case for a Green New DealFrom EverandOn Fire: The (Burning) Case for a Green New DealRating: 4 out of 5 stars4/5 (73)
- Data Center Best PracticesDocument28 pagesData Center Best Practicesmnt617683% (6)
- Taurus super cool R410A ducted unitsDocument4 pagesTaurus super cool R410A ducted unitsSrinivasan ThyagarajanNo ratings yet
- Bunsen Burner LabDocument6 pagesBunsen Burner LabGabriel Luque100% (1)
- (BS en 13190-2001) - Dial Thermometers.Document22 pages(BS en 13190-2001) - Dial Thermometers.boborg8792100% (1)
- BOQ - Bill of Quantities and Cost Sheets For MEP ProjectsDocument21 pagesBOQ - Bill of Quantities and Cost Sheets For MEP ProjectsChaithanya100% (5)
- Step by Step For ButtJoint - NEWDocument26 pagesStep by Step For ButtJoint - NEWMuhammad Luqman100% (1)
- High Tech WaermepumpenDocument24 pagesHigh Tech WaermepumpenManea GrosuNo ratings yet
- Auha 36 LatnDocument28 pagesAuha 36 LatnJuan Antonio Martinez MarinNo ratings yet
- Freeze Dryuer Configuration PDFDocument8 pagesFreeze Dryuer Configuration PDFMuhammad AminNo ratings yet
- Physics Notes 1 To 11 by Tariq SaeedDocument7 pagesPhysics Notes 1 To 11 by Tariq SaeedTariq SaeedNo ratings yet
- Temperature Pressure Chart PDFDocument2 pagesTemperature Pressure Chart PDFJoel Flores100% (1)
- R&ac - 2023 C20Document3 pagesR&ac - 2023 C20CALVARY NIBANDHANANo ratings yet
- Hydro Kit Data SheetDocument1 pageHydro Kit Data SheetPedro QuintalNo ratings yet
- Tutorial 2 KKEE1133Document2 pagesTutorial 2 KKEE1133AimanKPGNo ratings yet
- Aquathermal Pressuring: How Temperature Increases Pressure in Isolated FormationsDocument4 pagesAquathermal Pressuring: How Temperature Increases Pressure in Isolated FormationsOluwatoyin AjayiNo ratings yet
- Nota Padat HeatDocument10 pagesNota Padat Heatjesunathan44@yahoo.comNo ratings yet
- Chemistry-States of Matter Part 1Document3 pagesChemistry-States of Matter Part 1aditi kNo ratings yet
- Student Exploration: Boyle's Law and Charles' LawDocument8 pagesStudent Exploration: Boyle's Law and Charles' LawjzbNlka0% (1)
- Fan Coil Terminal RangeDocument24 pagesFan Coil Terminal RangeridNo ratings yet
- York Affinity BrochureDocument4 pagesYork Affinity BrochureAlberto NavarroNo ratings yet
- GPI-Rhoss Chiller LC Y-PAck SE and Y-Pack HEDocument2 pagesGPI-Rhoss Chiller LC Y-PAck SE and Y-Pack HEDamian OvidiuNo ratings yet
- Determination of Coefficient of Linear Expansion of A Metal Rod - Lab DescriptionDocument2 pagesDetermination of Coefficient of Linear Expansion of A Metal Rod - Lab Descriptionoğuzhan çelikNo ratings yet
- Bucker - Wagner - Reference Equation of State For The Thermodynamic Properties of Fluid Phase N-Butane and Isobutane - 2004 PDFDocument91 pagesBucker - Wagner - Reference Equation of State For The Thermodynamic Properties of Fluid Phase N-Butane and Isobutane - 2004 PDFAlexanderNo ratings yet
- TYPES OF DEHUMIDIFIER AND RECOMMENDED MODELDocument22 pagesTYPES OF DEHUMIDIFIER AND RECOMMENDED MODELshubham mhatreNo ratings yet
- Ah-Polypropylene Case Pressure GaugeDocument3 pagesAh-Polypropylene Case Pressure Gaugepankaj doshiNo ratings yet
- Mitsubishi Electric MSZ-FH VE Remote Controller Eng PDFDocument1 pageMitsubishi Electric MSZ-FH VE Remote Controller Eng PDFShadi MattarNo ratings yet
- VOLTAS CHILLERS – ENERGY EFFICIENT SOLUTIONS FOR ALL PROJECT NEEDSDocument36 pagesVOLTAS CHILLERS – ENERGY EFFICIENT SOLUTIONS FOR ALL PROJECT NEEDSkamalmuraNo ratings yet
- Heat Capacity and Specific HeatDocument17 pagesHeat Capacity and Specific Heatapi-237073553No ratings yet
- Cricket ThermometerDocument1 pageCricket ThermometerS. SpencerNo ratings yet