Professional Documents
Culture Documents
ST Terminale Exerciceschimie Corrigecinetique Ex6.htm PDF
Uploaded by
d'ALMEIDAOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
ST Terminale Exerciceschimie Corrigecinetique Ex6.htm PDF
Uploaded by
d'ALMEIDACopyright:
Available Formats
Exercice n°6
On veut étudier la cinétique de la réaction de
saponification de l’acétate d’éthyle par la soude.
CH3COOC2H5 + OH- = CH3COO- + C2H5OH
A t=0 le mélange réactionnel a un volume de 1 litre et
contient nester = 5.10-2 mol et nsoude = 5.10-2 mol.
Toutes les 4 minutes, on prélève 5 mL de mélange, on le
dilue afin d’arrêter la réaction et on le dose par de l’acide
chlorhydrique de concentration 1.00 10-2 mol.L-1 pour
déterminer la concentration restante d’ions OH-.
On obtient le tableau suivant :
t(min) 0 4 8 12 16 20 24 28 32 36 40 44
VHCl 25 22 19.8 18 16.5 15 13.8 12.8 12 11.5 11 10.5
(mL)
1. Calculer la concentration d’ester contenue dans chaque
prélèvement.
2. Calculer la vitesse moyenne de disparition de l’ester entre
les instants t1 = 4 min et t2 = 8 min, puis entre les instants t3
= 24 min et t4 = 28 min.
Comment varie la vitesse moyenne de réaction ? Interpréter
cette variation.
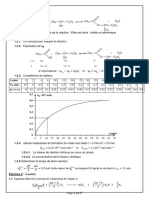
3. Représenter graphiquement l’évolution de la concentration
d’ester en fonction du temps.
4. Déterminer la vitesse instantanée initiale V0 et la vitesse
instantanée à t=12 min, V12.
Corrigé
1. Réaction simplifiée et tableau d’avancement :
CH3CO2C2H5 + OH- = CH3CO2- + C2H5OH
Etat initial 5.10-2 5.10-2 0 0
Etat 5.10-2-x 5.10-2-x x x
intermédiaire
L’état intermédiaire correspond à l’état à l’instant t. x est
une fonction de t.
On peut remarquer que d’après le tableau d’avancement, à
tout instant, nCH3CO2C2H5 = n OH- donc CCH3CO2C2H5 = C OH-.
On peut déterminer la concentration restante de soude,
donc C OH-, à l’aide du dosage :
H3O+ + OH- = 2 H2O
Ce qui amène à C OH- =. CHCl VHCl / VOH-. On peut donc
déterminer à chaque instant la concentration de soude
restante et donc la concentration d’ester à chaque instant en
appliquant cette formule.
Cester = C OH- = en exprimant VHCl en mL.
1.
t V HCl C ester
(min) (mL) (mol/L)
0 25 0,05
4 22 0,044
8 19,8 0,0396
12 18 0,036
16 16,5 0,033
20 15 0,03
24 13,8 0,0276
28 12,8 0,0256
32 12 0,024
36 11,5 0,023
40 11 0,022
42 10,5 0,021
2. Vmoy1 =
= 1.1 10-3 mol.L-1.min-1.
Vmoy2 = = 5 10-4 mol.L-1.min-1.
On a mis un signe negatif devant les formules puisqu’il s’agit
de vitesses de disparitions et qu’une vitesse est toujours
positive.
3. Evolution de l’ester en fonction du temps :
4. La vitesse instantanée de disparition de l’ester initiale
correspond à l’opposé du coefficient directeur de la
tangente à l’origine T0.
a= (Yb-Ya) / (Xb-Xa) = (0-0.05)/ (32-0) =-1.5 10-3 donc V0 = 1.5
10-3 mol.L-1.min-1.
La vitesse instantanée de disparition de l’ester à t = 12 min
correspond à l’opposé du coefficient directeur de la
tangente à la courbe lorsque t = 12 min (droite T12).
a'= (Yb-Ya) / (Xb-Xa) = (0.008-0.026)/(46-24)= -8 10-4 donc V’ = 8
10-4 mol.L-1.min-1.
You might also like
- RéacteurDocument7 pagesRéacteurABDELALI SASSIOUINo ratings yet
- TP GR 1 Trinome N°7Document14 pagesTP GR 1 Trinome N°7Mohamed TaaneNo ratings yet
- C2Chim Suivi Cinetique ExercicesDocument8 pagesC2Chim Suivi Cinetique ExercicesMohamed El OuahdaniNo ratings yet
- TP2 RéacteurDocument9 pagesTP2 RéacteurÄyyoüb El-BchiriNo ratings yet
- Etude de La Réaction de Saponification de LDocument11 pagesEtude de La Réaction de Saponification de Lselmi nourelhouda100% (2)
- TP N° 02 ThermodynamiqueDocument6 pagesTP N° 02 ThermodynamiquemutraceNo ratings yet
- Exercices Estérification CorrigésDocument5 pagesExercices Estérification CorrigésSeif Souid95% (22)
- C.P 22-23 CinetiqueDocument2 pagesC.P 22-23 CinetiquediarratogsibNo ratings yet
- SérieDocument5 pagesSérieBenmohamed ibtihelNo ratings yet
- Corrigé Épreuve 2 Compo 1sem TS2 IEASNDocument5 pagesCorrigé Épreuve 2 Compo 1sem TS2 IEASNt87d4jyrqkNo ratings yet
- ch9 Hydrolyse Basique EsterDocument2 pagesch9 Hydrolyse Basique EstermohamedNo ratings yet
- ILEPHYSIQUE Phys 1s Controle2-CorrectionDocument4 pagesILEPHYSIQUE Phys 1s Controle2-CorrectionBa MamadouNo ratings yet
- Bac D PCDocument118 pagesBac D PCtanjiaNo ratings yet
- Correction Du TP - Suivi Temporel D'une Transformation Chimique Par ...Document3 pagesCorrection Du TP - Suivi Temporel D'une Transformation Chimique Par ...WaliD MerabeT0% (1)
- TP7 Cinétique Chimique Du Premier Ordre.Document14 pagesTP7 Cinétique Chimique Du Premier Ordre.Sellam Anis100% (1)
- TP Chimie PhysiqueDocument19 pagesTP Chimie Physiquemeriem.bouaouda7102No ratings yet
- TSP2SP2Ch9T4-exos Resolus p245n11 246n15 250n25Document5 pagesTSP2SP2Ch9T4-exos Resolus p245n11 246n15 250n25mohNo ratings yet
- Suivi Activité Et Exercices 2016Document9 pagesSuivi Activité Et Exercices 2016Mohamed El OuahdaniNo ratings yet
- Série 1 Cinétique 2020 2021Document4 pagesSérie 1 Cinétique 2020 2021Li Na0% (1)
- Srie Dexos Cintique L3-GPDocument6 pagesSrie Dexos Cintique L3-GPFatima YahiaNo ratings yet
- Exercice Corrigé CinétiqueDocument13 pagesExercice Corrigé Cinétiquejakobslimani02No ratings yet
- Exo Cinetique Corrige AmmadoucheDocument82 pagesExo Cinetique Corrige AmmadouchetalebNo ratings yet
- Génie de RéacteursDocument11 pagesGénie de RéacteursMarwa HociniNo ratings yet
- Chimie Bac - Transformations Chimiques - SpectrophotométrieDocument1 pageChimie Bac - Transformations Chimiques - SpectrophotométrieMohammed NiaguiNo ratings yet
- 2005 AmSud Correction Exo3 Cinetique Sapo 6 5ptsDocument3 pages2005 AmSud Correction Exo3 Cinetique Sapo 6 5ptsZakaria AsbaiNo ratings yet
- ConducDocument4 pagesConducaissarahmelissaNo ratings yet
- TD-cinetique Chimique 2024-lsllDocument4 pagesTD-cinetique Chimique 2024-lsllbibos8318No ratings yet
- Cinétique ChimiqueDocument2 pagesCinétique ChimiqueOumar TraoréNo ratings yet
- TD2 Correction PDFDocument8 pagesTD2 Correction PDFKhadija LakhdiriNo ratings yet
- Solution Exercices de Suivi Temporeldune Transformation Vitesse DereactionDocument13 pagesSolution Exercices de Suivi Temporeldune Transformation Vitesse DereactionTsu BakiNo ratings yet
- Compte Rendu Module GRDocument16 pagesCompte Rendu Module GRReda Farouk ELaidiNo ratings yet
- Cinétique Chimique TD Corrigé 05Document8 pagesCinétique Chimique TD Corrigé 05elie mij kisaleNo ratings yet
- 08 09 Devoir N 01Document3 pages08 09 Devoir N 01anon-280479100% (3)
- Compte Rendu Cinitique 2Document4 pagesCompte Rendu Cinitique 2Rahmanov DzNo ratings yet
- Bac Blanc N1 Corr Ex1Document2 pagesBac Blanc N1 Corr Ex1la physique selon le programme FrançaisNo ratings yet
- TP ConductiemetrieDocument7 pagesTP ConductiemetrieSellam AnisNo ratings yet
- C10Chim - Esterification - Hydrolyse - Equilibre - Exos - Fischer - 2 PDFDocument7 pagesC10Chim - Esterification - Hydrolyse - Equilibre - Exos - Fischer - 2 PDFAzizElheniNo ratings yet
- Exercices de Révision C132Document18 pagesExercices de Révision C132abraham LincolnNo ratings yet
- TP .Avancement .4sc - Exp.2022Document6 pagesTP .Avancement .4sc - Exp.2022Med Brini100% (1)
- TD Revision CinetiqueDocument9 pagesTD Revision CinetiqueMy ProofNo ratings yet
- Killian - 2022 - Tp1Document9 pagesKillian - 2022 - Tp1amandine gaianiNo ratings yet
- Série 1Document4 pagesSérie 1Lamia ALACHAHER100% (1)
- Cin PBDocument8 pagesCin PBYoussef FarjallahNo ratings yet
- TP Cinétique de La SaponificationDocument2 pagesTP Cinétique de La SaponificationLeila ChimieNo ratings yet
- 1cm3usujd 504803Document4 pages1cm3usujd 504803sowpapagora444No ratings yet
- 2005 09 Antilles Correction Exo3 Menthe 4ptsDocument3 pages2005 09 Antilles Correction Exo3 Menthe 4ptsAnthea MallaNo ratings yet
- Travaux DirigesDocument3 pagesTravaux DirigesLina alikhNo ratings yet
- Tp02oute2 Ghi AboDocument11 pagesTp02oute2 Ghi AboNoro GhiloubiNo ratings yet
- Ob S2-Cin-ChimiqueDocument3 pagesOb S2-Cin-ChimiqueManar Bahi100% (2)
- Nothing To DoDocument9 pagesNothing To DomugiNo ratings yet
- 1ère CD - APC - Estérification Et Hydrolyse D'un EsterDocument6 pages1ère CD - APC - Estérification Et Hydrolyse D'un EsterLAWSON NICOLASNo ratings yet
- TD de CinétiqueDocument14 pagesTD de CinétiqueDieu-donné Akin100% (2)
- S Rie D Exercices Corrig S Cin TiqueDocument6 pagesS Rie D Exercices Corrig S Cin Tiqueanie KheliliNo ratings yet
- SERIE 2 Avec SlutionDocument23 pagesSERIE 2 Avec Slutionbouraiou nabilaNo ratings yet
- 2-Cinetique ChimiqueDocument5 pages2-Cinetique ChimiqueAnis Dahnen0% (1)
- Dev Cont 1 4T 2022 - 2023Document3 pagesDev Cont 1 4T 2022 - 2023Hamza RezguiNo ratings yet
- TDcinét Chim.17-18 Fiche2Document2 pagesTDcinét Chim.17-18 Fiche2Joseph AmondNo ratings yet
- PDFDocument22 pagesPDFd'ALMEIDANo ratings yet
- Induction Magn PDFDocument5 pagesInduction Magn PDFd'ALMEIDA100% (1)
- ERCC 04 2reactifs PDFDocument2 pagesERCC 04 2reactifs PDFd'ALMEIDANo ratings yet
- TDmagnetVF2 PDFDocument37 pagesTDmagnetVF2 PDFd'ALMEIDANo ratings yet
- PDFDocument22 pagesPDFd'ALMEIDANo ratings yet
- Oxydo-Reduction Et Piles Electrochimiques SMPC2 Fsr. 2015Document13 pagesOxydo-Reduction Et Piles Electrochimiques SMPC2 Fsr. 2015Djilali Morsli100% (2)
- Siou 2017 - Classement Etablissements 2017 D PDFDocument15 pagesSiou 2017 - Classement Etablissements 2017 D PDFd'ALMEIDANo ratings yet
- Siou 2017 - Classement Etablissements 2017 D PDFDocument15 pagesSiou 2017 - Classement Etablissements 2017 D PDFd'ALMEIDANo ratings yet
- Pivot PDFDocument10 pagesPivot PDFd'ALMEIDANo ratings yet
- Pivot PDFDocument10 pagesPivot PDFd'ALMEIDANo ratings yet
- Szymanowska Le MurmureDocument10 pagesSzymanowska Le MurmureBARNIKOLNo ratings yet
- Elysun Kit 1800wDocument14 pagesElysun Kit 1800wChakchouk MED WALIDNo ratings yet
- MedjourDocument16 pagesMedjournadaNo ratings yet
- Les 10 Cles Du Developpement Personnel 1Document28 pagesLes 10 Cles Du Developpement Personnel 1TAKAMNo ratings yet
- Dosgae Etalonnage Permanganate CorrigeDocument2 pagesDosgae Etalonnage Permanganate CorrigeFERONNo ratings yet
- Bilan Aphasie 2012 01Document2 pagesBilan Aphasie 2012 01Chiali Kawther100% (3)
- R2AM - PDF Version 1 PDFDocument5 pagesR2AM - PDF Version 1 PDFÉlia BylkaNo ratings yet
- Questionnaire 2017Document85 pagesQuestionnaire 2017toto TOTOROTONo ratings yet
- BenchmarkingDocument47 pagesBenchmarkingJean-Paul LEGERNo ratings yet
- M'Hamed IssiakhemDocument257 pagesM'Hamed IssiakhemAdel BenzemaNo ratings yet
- Webanalyse - Des Donnees A L'action - Antoine DenoixDocument218 pagesWebanalyse - Des Donnees A L'action - Antoine Denoixelric NoirtinNo ratings yet
- GeomDocument28 pagesGeomIlyasse LemezaliNo ratings yet
- 16094361327Document2 pages16094361327Amadou Kamafily DialloNo ratings yet
- Contribution À L'étude de La Gestion Des Ressources Humaines Et de L'intégration de La FormationDocument194 pagesContribution À L'étude de La Gestion Des Ressources Humaines Et de L'intégration de La FormationAmal Ben TaherNo ratings yet
- S1Document3 pagesS1Mawoussi AfekeNo ratings yet
- Systemes Electriques: Fascicule de Travaux PratiquesDocument27 pagesSystemes Electriques: Fascicule de Travaux PratiquesMouna Ben SmidaNo ratings yet
- Hyphotheses de La RDMDocument6 pagesHyphotheses de La RDMallaouiNo ratings yet
- Prob3-Ondes EM Plasma1 CorrigéDocument15 pagesProb3-Ondes EM Plasma1 CorrigéAymane ESSALIMNo ratings yet
- CRM en B To BDocument41 pagesCRM en B To BechnagesecrNo ratings yet
- Plan Detaille ReseauDocument1 pagePlan Detaille ReseaulaomatteoNo ratings yet
- Initiation À La Prospection Aut2019Document4 pagesInitiation À La Prospection Aut2019Ali GuelmamiNo ratings yet
- 1-Terre Dans Le Système SolaireDocument35 pages1-Terre Dans Le Système SolaireSohaib SfNo ratings yet
- Chasse ShotshellsDocument12 pagesChasse Shotshells873258No ratings yet
- TP1 Transformations Lentes Ou Rapides 2-Correction PDFDocument5 pagesTP1 Transformations Lentes Ou Rapides 2-Correction PDFIkram ChamixoNo ratings yet
- Presentation Entree en RelationDocument36 pagesPresentation Entree en RelationIsmael NguetsopNo ratings yet
- POO en PHP5Document3 pagesPOO en PHP5Bash SumerNo ratings yet
- BENJILALIDocument77 pagesBENJILALIelhageNo ratings yet
- Cours Réseaux MobilesDocument94 pagesCours Réseaux MobilesTig IkrNo ratings yet
- M GM - Ene 2021 03Document92 pagesM GM - Ene 2021 03akrimabdssamedNo ratings yet
- CT1 CHAPITRE 1 Le MATERIAU TERREDocument15 pagesCT1 CHAPITRE 1 Le MATERIAU TERREGiser TakoustNo ratings yet