Professional Documents
Culture Documents
Lab Química, Práctica #9. - "Equilibrio Químico"
Uploaded by
Carlos GutiérrezOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Lab Química, Práctica #9. - "Equilibrio Químico"
Uploaded by
Carlos GutiérrezCopyright:
Available Formats
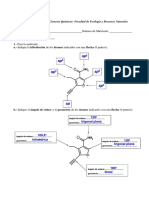
CUESTIONARIO PREVIO #9.
- “Equilibrio químico”
1. ¿Qué es una reacción reversible?
Las reacciones reversibles son aquellas en las que los reactivos no se transforman
totalmente en productos, ya que éstos vuelven a formar los reactivos, dando lugar así a un
proceso de doble sentido que desemboca en equilibrio químico.
2. ¿Cuáles son los factores que afectan al equilibrio químico?
1. Efecto de la concentración en equilibrio:
2. Efecto de la temperatura en equilibrio:
3. Efecto de la presión sobre el equilibrio:
3. ¿Qué establece el principio de Le Chatelier?
Se refiere a que un estado de equilibrio químico es mantenido en tanto no se alteren las
condiciones del sistema. Cuando se modifica algún parámetro, como por ejemplo, la
presión, la temperatura o la concentración de algunas de las especies en equilibrio, este se
traslada en cierta dirección (hacia los reactivos o hacia los productos) hasta alcanzar un
nuevo estado de equilibrio.
4. Suponiendo que la reacción reversible siguiente se lleva a cabo en un sistema
cerrado: A(g) + B(g)⇄⇄ C(l) + D(l) Indique hacia dónde se desplaza el equilibrio si:
a) Hay una disminución de presión.
A(g) + B(g) ⇄ C(l) + D(l)
b) Se adiciona A(g) a la mezcla de reacción.
A(g) + B (g) ⟶ C(l) + D(l)
5. ¿Cuál es la expresión matemática para calcular el pH de un ácido débil?
Cuando se tiene un ácido débil disuelto en agua, este se disocia parcialmente,
estableciendo un equilibrio:
+
H A (ac) ↔ H (ac) + A − (ac)
Dicho equilibrio está caracterizado por una constante:
[H + ][A − ]
Ka= [HA]
Pero si se considera que la concentración inicial del ácido HA es C [M], se pueden
establecer entonces las relaciones siguientes:
+
H A (ac) ↔ H (ac) + A − (ac)
Tiempo inicial ( t o ) C 0.0 0.0
Tiempo de equilibrio ( t eq ) C-X X X
Dado que [ A− ] = [ H + ] = X, la expresión de la constante de equilibrio puede expresarse:
[H + ][A − ] X2
Ka= [HA]
⇒ Ka= C−X
+
Como la concentración de iones H es despreciable frente a C, tenemos:
X2
Ka= C
Dado que X corresponde a la concentración de H + en el equilibrio, puede determinarse la
+
concentración de H si se mide el pH de la disolución en el equilibrio:
pH = − log[H + ]
+
Conociendo la concentración de H se puede determinar el valor de la constante de acidez
Ka.
6. ¿Qué es un ácido monoprótico?
Los Ácidos Monopróticos son ácidos que en una disolución acuosa donan un protón por
cada molécula. Los Ácidos Monopróticos pueden ser tanto ácidos orgánicos como ácidos
inorgánicos.
7. Investigue cuál es el valor de la constante de acidez del ácido acético en
condiciones estándar.
La constante es igual a:
● 1.8 X 10^-5
Práctica# 9.- “Equilibrio químico”
OBJETIVOS EL ALUMNO:
1. Comprobará experimentalmente la existencia del equilibrio químico.
2. Verificará experimentalmente el principio de Le Chatelier.
3. Determinará experimentalmente la constante de equilibrio del ácido acético.
Diagrama de flujo del procedimiento:
- Se verificó con detenimiento cada parte del contenido teórico necesario.
- Se etiquetaron los tres vasos de precipitados de 30 [ml] con las diferentes disoluciones
de ácido acético y se transfirió aproximadamente 20 [ml] en cada uno de estos.
- Se retiró la cubierta protectora de la celda del medidor de pH y la introducimos en la
disolución de 0.001 [M] y después se agitó ligeramente el electrodo para desalojar las
burbujas de aire que hayan quedado retenidas en la punta.
- Una vez hecha la medición del pH, se apagó el medidor, y se sacó el electrodo el cual
enjuágamos con agua destilada.
- Se repitió el paso 2 y 3 para determinar el pH de las otras dos disoluciones de ácido
acético.
- Al vaso de precipitados, empleado en la actividad 2 se le agregó con la punta de la
espátula una pequeña cantidad de acetato de sodio sólido y se agitó hasta una total
disolución.
- Con ayuda de la pipeta y propipeta, se adicionó 2 [ml] de la disolución de CuSO4 en un
tubo de ensayo y con la otra, también adicionamos 0.5 [ml] de la disolución de KBr.
- Se colocó la disolución anterior en un baño de hielo y agua (aproximadamente 5 minutos)
y la agitamos.
- En uno de los vasos de precipitados, agregamos aproximadamente 20 [ml] de agua de la
llave y lo colocamos sobre la parrilla para obtener un baño de agua caliente.
- Se anotaron observaciones de esto
- Al final de la clase la profesora dió paso a como explicar todos los cálculos necesarios
para realizar cada una de las actividades indicadas tanto en la actividades 2, 3 y 4.
Tabla de mediciones (encabezados con unidades en el SI):
ACTIVIDAD 2
5. Con los datos de pH, llene la tabla siguiente:
Disolución de ácido pH [H+] Ka
acético
0.001 [M] 5.9 1.2589x10-6 1.59x10-9
0.01 [M] 3.72 1.9054x10-4 3.7010x10-6
0.1 [M] 3.02 9.5499x10-4 9.2079x10-6
Operaciones con unidades en el SI:
Actividad #2
6.- Cálculos que se deberán realizar para determinar la constante de equilibrio del
ácido acético.
CH3COOH(ac) ↔ CH3COO- (ac) + H+ (ac)
Actividad #3
1. Al vaso de precipitados, empleado en la actividad 2, que contiene la disolución 0.1
[M] de ácido acético, se le agrega con la punta de la espátula una pequeña cantidad
de acetato de sodio sólido; se agita hasta la total disolución. Determine el pH y
calcule la concentración molar del ion H+.
pH experimental: 4.15
Con base en el pH obtenido, la concentración molar de iones H+ es:
[H + ] = 10 −pH
[H + ] 0.1[M ] = 10 −4.15 [H + ] = 7.0794x10 −5 [M ]
2. Compárelo con el obtenido en el punto 4 de la actividad 2 e indique hacia dónde se
desplaza el equilibrio.
CH3COOH(ac) ↔ CH3COO- (ac) + H+ (ac)
CH3COONa(s) ↔ CH3COO- (ac) + Na+ (ac)
⇩
ión común
El pH 0.1[M ] = 3.02 sin acetato
El pH 0.1[M ] = 4.15 con acetato
[H ] = 9.5499x10 −4 [M ] (concentración de iones H+ sin acetato)
+
[H + ] = 7.0794x10 −5 [M ] (concentración de iones H+ con acetato)
Cuando se agregó la pequeña cantidad de acetato de sodio a la disolución de 0.1 [M]
de ácido acético, con un pH de 3.02, ésta aumentó su pH a 4.15, haciendo que la
concentración de iones CH3COO- (siendo este el ión común) también aumentará,
desplazándose así hacia los reactivos, disminuyendo la concentración de iones H +
debido a que el acetato los atrae, además de que la solubilidad de los reactivos
disminuyó.
Resultados (cuando aplique y con encabezados con unidades en el SI)
ACTIVIDAD 2 (Resultados de operaciones)
ACTIVIDAD 3 (Resultados de operaciones)
1. [H + ] = 7.0794x10 −5 [M ] (concentración de iones hidrógeno)
ACTIVIDAD 4 (observaciones obtenidas experimentalmente)
2. Coloque la disolución anterior en un baño de hielo y agua (aproximadamente 5
minutos) y agítela. Anote sus observaciones e indique hacia dónde se desplaza el
equilibrio en la reacción.
La disolución siguió con una tonalidad azul constante, por lo que inferimos que el
equilibrio se desplazó hacia los reactivos.
4. Con ayuda de las pinzas, ponga el tubo de ensayo en el baño de agua caliente y
anote sus observaciones. Indique hacia dónde se desplaza el equilibrio en la
reacción.
La disolución ahora cambió a una tonalidad verdosa, por lo tanto, eso nos indica que
el equilibrio de la reacción se desplazó hacia los productos.
Análisis de resultados con base en los objetivos, en el orden del manual (Se copian
cada uno de los resultados y enseguida se interpretan en equipo):
Análisis de resultados obtenidos tanto en actividad #2
#3 y #4
Actividad #4: En base a los resultados y observaciones obtenidas en el laboratorio
llegamos a la conclusión de que la formación de CuBr y K2SO4 son ambas
endotérmicas, ya que la disolución no reaccionó hasta que se sometió a una
temperatura alta, en comparación de cuando se sometió al baño de hielo donde no
reaccionó.
Conclusión:
Al término de la práctica se pudieron cumplir con los objetivos respectivos, ya que se
pudo comprobar y observar de manera clara el concepto de equilibrio químico y lo
que representa experimentalmente sin que se presentara alguna dificultad durante el
proceso que se llevó a cabo.
Bibliografía:
1. Ander, P y Sonnessa, A. J., “Principios de Química”; 14a ed, Limusa, México, 1992.
2. Cruz, D., Chamizo, J. A. y Garritz, A.; “Estructura Atómica”, Addison-Wesley
Iberoamericana, México, 1997.
3. Sears, F. W., Zemansky, M. W. & Young, H. D. and Freedman R. A.; “Física
Universitaria”, 13ª ed., PEARSON EDUCACIÓN, 2013.
You might also like
- Practica 9 QuímicaDocument6 pagesPractica 9 QuímicaManu IniestaNo ratings yet
- Lab Química, Práctica #10. - ELECTROQUÍMICA. ELECTRÓLISIS DE DISOLUCIONES ACUOSAS Y CONSTANTE DE AVOGROADDocument7 pagesLab Química, Práctica #10. - ELECTROQUÍMICA. ELECTRÓLISIS DE DISOLUCIONES ACUOSAS Y CONSTANTE DE AVOGROADCarlos Gutiérrez67% (3)
- Practica 7Document7 pagesPractica 7javier100% (1)
- Cuestionario Previo, Equilibrio Químico.Document2 pagesCuestionario Previo, Equilibrio Químico.Victor Samaniego100% (4)
- Reporte de Práctica Preparación y Conductividad de DisolucionesDocument11 pagesReporte de Práctica Preparación y Conductividad de DisolucionesRichard Parkin Starkey33% (3)
- Practica 8Document7 pagesPractica 8javierNo ratings yet
- Practica 5 Laboratorio de Química UNAMDocument3 pagesPractica 5 Laboratorio de Química UNAMROBERTO50% (2)
- Practica #6Document10 pagesPractica #6Gutierrez Garcia Luis Fernando100% (1)
- Práctica #6 Preparacion y Conductividad de DisolucionesDocument16 pagesPráctica #6 Preparacion y Conductividad de DisolucionesYahir Uriarte OrtizNo ratings yet
- Cuestionario Previo 7Document3 pagesCuestionario Previo 7Josué Oropeza Garcia100% (1)
- Practica 4 Laboratorio de Química UNAMDocument4 pagesPractica 4 Laboratorio de Química UNAMROBERTONo ratings yet
- Lab Química, Práctica #3. - "Determinación de La Densidad de Disoluciones y Sólidos"Document9 pagesLab Química, Práctica #3. - "Determinación de La Densidad de Disoluciones y Sólidos"Carlos GutiérrezNo ratings yet
- Cálculo Del Rendimiento Porcentual de Una Reacción QuímicaDocument6 pagesCálculo Del Rendimiento Porcentual de Una Reacción QuímicaFernanda García100% (1)
- Lab Química, Práctica #2. - "Experimento de J. J. Thomson" FI UNAMDocument10 pagesLab Química, Práctica #2. - "Experimento de J. J. Thomson" FI UNAMCarlos Gutiérrez100% (1)
- Lab Química, Práctica #11. - CONSTRUCCIÓN DE UNA PILADocument6 pagesLab Química, Práctica #11. - CONSTRUCCIÓN DE UNA PILACarlos Gutiérrez0% (1)
- Cuestionario Previo No.6Document4 pagesCuestionario Previo No.6Bryan MNo ratings yet
- CUESTIONARIO PREVIO ElectrolisisDocument1 pageCUESTIONARIO PREVIO ElectrolisisLaura Marquez0% (7)
- Cuestionario Previo Quimica Facultad Ingenieria UnamDocument2 pagesCuestionario Previo Quimica Facultad Ingenieria UnamLaura Marquez71% (7)
- Cuestionario Previo 10 Química FiDocument5 pagesCuestionario Previo 10 Química FiJimena MarquezNo ratings yet
- Cuestionario Previo El Ciclo Del Sulfato de Cobre PentahidratadoDocument2 pagesCuestionario Previo El Ciclo Del Sulfato de Cobre PentahidratadoLaura Marquez100% (1)
- Previo Conductividad de DisolucionesDocument5 pagesPrevio Conductividad de DisolucionesJorge Luis Lopez MeloNo ratings yet
- Practica 3 Laboratorio de Química UNAMDocument7 pagesPractica 3 Laboratorio de Química UNAMROBERTO67% (3)
- Medición de Dimensiones FundamentalesDocument12 pagesMedición de Dimensiones FundamentalesAdriana SeguraNo ratings yet
- Practica #8 Termoquimica, Entalpia de DisolucionDocument7 pagesPractica #8 Termoquimica, Entalpia de DisolucionYahir Uriarte OrtizNo ratings yet
- Practica 9Document5 pagesPractica 9javier100% (1)
- Practica 2 Laboratorio de Química UNAMDocument9 pagesPractica 2 Laboratorio de Química UNAMROBERTONo ratings yet
- Previo EntalpiaDocument2 pagesPrevio EntalpiaDaniel_Hdz_GNo ratings yet
- Práctica 8Document12 pagesPráctica 8Canchola Cruz FernandoNo ratings yet
- Cuestionario Previo #9 Enlace QuimicoDocument3 pagesCuestionario Previo #9 Enlace QuimicoMario Castilla RgNo ratings yet
- Cuestionario Previo - 13 Ley de La Conservación de La Materia y SolubilidadDocument3 pagesCuestionario Previo - 13 Ley de La Conservación de La Materia y SolubilidadLaura Marquez0% (1)
- Practica de Quimica 6Document6 pagesPractica de Quimica 6Armando VnNo ratings yet
- Practica #10 ElectroquimicaDocument13 pagesPractica #10 ElectroquimicaYahir Uriarte OrtizNo ratings yet
- Practica 10Document15 pagesPractica 10javier100% (1)
- Practica 2 EstaticaDocument8 pagesPractica 2 EstaticaVíctor Manuel PiñaNo ratings yet
- Previo 3 Experimento de ThomsonDocument2 pagesPrevio 3 Experimento de ThomsonFernando Montes de OcaNo ratings yet
- PRACTICA-4-Movimiento y Energía en Un Plano Inclinado FIDocument12 pagesPRACTICA-4-Movimiento y Energía en Un Plano Inclinado FICuahtepitzi Cuatlapantzi Citlali0% (1)
- Practica 9 Laboratorio de TermodinamicaDocument10 pagesPractica 9 Laboratorio de TermodinamicaCarlos FraustoNo ratings yet
- Practica 3 DensidadDocument8 pagesPractica 3 DensidadLeonardo Regulus MuñozNo ratings yet
- Practica - 5 - Propiedades - Elementos-Oxidos (1) - I - 2020-1Document3 pagesPractica - 5 - Propiedades - Elementos-Oxidos (1) - I - 2020-1Christopher MorenoNo ratings yet
- Practica 3 EstaticaDocument13 pagesPractica 3 EstaticaCaradecacaPendejoNo ratings yet
- Práctica 4 Momentos EstáticaDocument4 pagesPráctica 4 Momentos EstáticaManuel Mannuelittho DurancitthoNo ratings yet
- Previo Practica 10Document4 pagesPrevio Practica 10Alfonso hernandezNo ratings yet
- PRACTICA-7-Algunas Propiedades Térmicas Del Agua FIDocument12 pagesPRACTICA-7-Algunas Propiedades Térmicas Del Agua FICuahtepitzi Cuatlapantzi CitlaliNo ratings yet
- Practica 2 J.J ThomsonDocument3 pagesPractica 2 J.J ThomsonFelipe D. FlouriteNo ratings yet
- OXIMERCURACIONDocument4 pagesOXIMERCURACIONNalleli JaimeNo ratings yet
- Mecánica Práctica 2 Determinación Del Coeficiente de Fricción EstáticaDocument14 pagesMecánica Práctica 2 Determinación Del Coeficiente de Fricción EstáticaJuan Carlos Aleman40% (5)
- Practica 8 Termodinamica FIDocument9 pagesPractica 8 Termodinamica FIJoel Ramos100% (1)
- Sesion B4 2Document13 pagesSesion B4 2Raquel SastreNo ratings yet
- 4 Equilibrio Quimico Equilibrio Ionico Soluciones Amortiguadoras PDFDocument64 pages4 Equilibrio Quimico Equilibrio Ionico Soluciones Amortiguadoras PDFjojolilloNo ratings yet
- FINAL Articulo Docente 4 Disoluciones Reguladoras de PH PDFDocument10 pagesFINAL Articulo Docente 4 Disoluciones Reguladoras de PH PDFCristian RozoNo ratings yet
- Guía de Autoaprendizaje N°3 Equilibrio Ácido-Base y PH y pOHDocument5 pagesGuía de Autoaprendizaje N°3 Equilibrio Ácido-Base y PH y pOHfrancisco muñoz quintanaNo ratings yet
- Ejercicios de Laboratorio 3Document5 pagesEjercicios de Laboratorio 3Rembert MorenoNo ratings yet
- Problemas Se Equilibrio IonicoDocument8 pagesProblemas Se Equilibrio IonicoElvis ÁlvarezNo ratings yet
- Clase 3 - Equilibrio Químico Parte 2Document61 pagesClase 3 - Equilibrio Químico Parte 2tomibosch98No ratings yet
- Equilibrio Quimico Homogeneo en La Fase LiquidaDocument9 pagesEquilibrio Quimico Homogeneo en La Fase LiquidaMelissa RivaNo ratings yet
- Ut 3 Volumetrías de NeutralizaciónDocument10 pagesUt 3 Volumetrías de Neutralizaciónmario tiradoNo ratings yet
- Constante ÁcidaDocument5 pagesConstante ÁcidaJuanse ParoliNo ratings yet
- Equilibrio QuímicoDocument6 pagesEquilibrio QuímicoMariana ZambranoNo ratings yet
- ObjetivosDocument4 pagesObjetivosBeatriz HinojosaNo ratings yet
- Capítulo 16-Equilibrio Acido-BaseDocument75 pagesCapítulo 16-Equilibrio Acido-BaseMariela VargasNo ratings yet
- Lab Química, Práctica #1. - Equipo de Laboratorio y Medidas de SeguridadDocument3 pagesLab Química, Práctica #1. - Equipo de Laboratorio y Medidas de SeguridadCarlos GutiérrezNo ratings yet
- Lab Química, Práctica #11. - CONSTRUCCIÓN DE UNA PILADocument6 pagesLab Química, Práctica #11. - CONSTRUCCIÓN DE UNA PILACarlos Gutiérrez0% (1)
- Lab Química, Práctica #3. - "Determinación de La Densidad de Disoluciones y Sólidos"Document9 pagesLab Química, Práctica #3. - "Determinación de La Densidad de Disoluciones y Sólidos"Carlos GutiérrezNo ratings yet
- Lab Química, Práctica #2. - "Experimento de J. J. Thomson" FI UNAMDocument10 pagesLab Química, Práctica #2. - "Experimento de J. J. Thomson" FI UNAMCarlos Gutiérrez100% (1)
- Dependencia de H Con La TDocument7 pagesDependencia de H Con La TDaniel MeloNo ratings yet
- Desorción de Carbón ActivadoDocument29 pagesDesorción de Carbón ActivadoJuan Diego Falcon ChuraNo ratings yet
- PA1 A ResueltaDocument2 pagesPA1 A ResueltaAroa FernándezNo ratings yet
- Punto Triple Del AguaDocument9 pagesPunto Triple Del AguadennislanchNo ratings yet
- Trabajo de Atomización-ArregladoDocument46 pagesTrabajo de Atomización-ArregladoElvis TrejoNo ratings yet
- 05 - Normativa Amb - YGE - Rec. Adicionales - Anexo 5 - Conceptos Funadmantales para La Aplicación de Eficiencia EnergéticaDocument4 pages05 - Normativa Amb - YGE - Rec. Adicionales - Anexo 5 - Conceptos Funadmantales para La Aplicación de Eficiencia EnergéticaBARBARANo ratings yet
- QUIMISORCIONDocument46 pagesQUIMISORCIONJanifer CastilloNo ratings yet
- Determinación Gravimétrica de HierroDocument1 pageDeterminación Gravimétrica de HierroAdriana SantacruzNo ratings yet
- Procesos de Reducción TérmicaDocument8 pagesProcesos de Reducción TérmicaGattuso TuroNo ratings yet
- Enlaces Interatomicos PDFDocument61 pagesEnlaces Interatomicos PDFoscarche9250% (2)
- Ex InoDocument2 pagesEx InoPatricio RosalinNo ratings yet
- Pautas P Química Orgánica IDocument53 pagesPautas P Química Orgánica IIgnacio ZamudioNo ratings yet
- Formación de EspumaDocument3 pagesFormación de EspumaluisinhoNo ratings yet
- Evaluacion de Columnas de Fraccionamiento Con Platos PerforadosDocument12 pagesEvaluacion de Columnas de Fraccionamiento Con Platos PerforadosChiaraGrassoNo ratings yet
- Apunte Rafael CobeñasDocument13 pagesApunte Rafael CobeñasAntonio EspitiaNo ratings yet
- Cristales LiquidosDocument20 pagesCristales Liquidosshery salazarNo ratings yet
- Practica 4 - Obtención de Un PolímeroDocument6 pagesPractica 4 - Obtención de Un PolímeroMarco Ruiz100% (2)
- Informe 4 Fotorreduccion de BenzofenonaDocument9 pagesInforme 4 Fotorreduccion de BenzofenonaJuan Diego TrujilloNo ratings yet
- Gases Ideales y RealesDocument18 pagesGases Ideales y RealesAlexter 1601100% (1)
- Apuntes Biologia 1Document150 pagesApuntes Biologia 1NiiLu MtaNo ratings yet
- Equilibrios y VolumetriasDocument30 pagesEquilibrios y VolumetriasAnthony AyalaNo ratings yet
- Instalaciones para FloriculturaDocument70 pagesInstalaciones para Floriculturagusaltc0% (1)
- Inv. de Sust. Quimicas. TECPROSDocument2 pagesInv. de Sust. Quimicas. TECPROSteam mecatronicNo ratings yet
- TP 2 Revisi-N 2023Document7 pagesTP 2 Revisi-N 2023lucerococ22No ratings yet
- Energía Ionización y Afinidad ElectrónicaDocument8 pagesEnergía Ionización y Afinidad ElectrónicaGEOVANNINo ratings yet
- Practica 1 - EquipoGDocument12 pagesPractica 1 - EquipoGFELIPE CCNo ratings yet
- Intercambiadores de Calor - Edgar GutiérrezDocument68 pagesIntercambiadores de Calor - Edgar GutiérrezWalter E. PinillosNo ratings yet
- Taller Quimica Inorganica 1Document2 pagesTaller Quimica Inorganica 1Jeison JaraNo ratings yet
- Informe N1 - Combustion y Ensayo A La LlamaDocument8 pagesInforme N1 - Combustion y Ensayo A La LlamaFabiana Gonzales JaureguiNo ratings yet
- Enlace Quimico - PDF'Document47 pagesEnlace Quimico - PDF'Widen LeonNo ratings yet