Professional Documents
Culture Documents
Temario de QGII (Relación Teoría-Laboratorio)
Uploaded by
Leion Uchiha0 ratings0% found this document useful (0 votes)
9 views3 pagesRelación Teoría-laboratorio
Original Title
Temario de QGII (Relación Teoría-laboratorio)
Copyright
© © All Rights Reserved
Available Formats
PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentRelación Teoría-laboratorio
Copyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
9 views3 pagesTemario de QGII (Relación Teoría-Laboratorio)
Uploaded by
Leion UchihaRelación Teoría-laboratorio
Copyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
You are on page 1of 3
CALENDARIO DE PRÁCTICAS DE QUÍMICA GENERAL II
SEMESTRE 2019-1
SEMANA DIA NÚMERO Y NOMBRE DE LA PRÁCTICA PROGRAMA DE TEORÍA
1 06 - 10 / agosto PRESENTACIÓN, ENTREGA DE GAVETAS Y 1. ESTEQUIOMETRÍA EN REACCIONES
PLÁTICAS DE SEGURIDAD E HIGIENE EN EL COMPLETAS
LABORATORIO
2 13 - 17 / agosto 1.- PREPARACIÓN DE DISOLUCIONES Y 1.1.Balances de materia en reacciones químicas. Balances en la
DETERMINACIÓN DE LA CONCENTRACIÓN DE equivalencia. Balances en la no equivalencia. Reactivo
UNA DISOLUCIÓN POR MEDIO DE UNA limitante. Rendimiento en los procesos químicos.
VALORACIÓN (TITULACIÓN)
3 20 - 24 / agosto 2.- DETERMINACIÓN DE CONCENTRACIONES Y
*24 viernes LAS DIVERSAS MANERAS DE EXPRESARLA.
PRIMERA PARTE: TRES ÁCIDOS DISTINTOS. 1.2 Solubilidad y reglas de solubilidad. Disoluciones y
24 – 26 / agosto Examen de seguridad en el diluciones.
laboratorio (1ra oportunidad)
4 27 - 31 / agosto 3.- APLICACIÓN DE LAS TITULACIONES ACIDO-
BASE
5 03 - 07 / 4.- DETERMINACIÓN DE CONCENTRACIONES Y 1.3 Caracterización y clasificación. Preparación de los
septiembre LAS DIVERSAS MANERAS DE EXPRESARLA. diferentes tipos de disoluciones. Expresiones de la
SEGUNDA PARTE: TITULACIONES REDOX. concentración en unidades físicas y químicas (% en masa,
07 -- 09 / septiembre Examen de seguridad en el molaridad y normalidad). Cálculos para la preparación de
laboratorio (2da oportunidad) disoluciones
6 10 - 14 / 5.- EQUIVALENTES Y NORMALIDAD
septiembre 14 / septiembre (10 a 14 h)
Curso de seguridad en el laboratorio
7 17 - 21 / 6.- REACTIVO LIMITANTE
septiembre
8 24 - 28 / 7.- REACCIONES REVERSIBLES. INTRODUCCIÓN 2. EQUILIBRIO QUÍMICO
septiembre AL EQUILIBRIO. LEY DE ACCIÓN DE MASAS
28 / septiembre (15 a 19 h) 2.1 Reacciones cuantitativas. Reacciones no cuantitativas y
Curso de seguridad en el laboratorio reversibilidad.
2.2 Orígenes cinéticos de la Ley de Acción de masas. Ley de
Acción de Masas. Cociente de reacción y la constante de
equilibrio, Keq, Kc, Kp.
2.3 Sistemas homogéneos (gaseosos). Sistemas heterogéneos.
Sistemas en disolución.
9 01 - 05 / 8.- INFLUENCIA DE LA TEMPERATURA EN EL 2.4 Alteración de la condición de equilibrio. Aspectos
octubre EQUILIBRIO QUÍMICO cualitativos y tendencia al equilibrio químico. Temperatura,
concentración, volumen, presión. Aspectos cuantitativos.
2.5 Aplicación de la Keq a la predicción o cálculo de
concentraciones al equilibrio (problemas). Aplicación de Keq
cuando se altera la condición de equilibrio, para los cálculos de
la nueva situación de equilibrio. Problemas numéricos.
10 08 - 12 / 9.- ÁCIDOS Y BASES FUERTES Y DÉBILES 3. EQUILIBRIO ÁCIDO-BASE EN SOLUCIÓN
octubre 12 / octubre (10 a 14 h) ACUOSA
*12 viernes Curso de seguridad en el laboratorio
3.1 Definiciones de ácido y de base según Arrhenius,
11 15 - 19 / 10.- CURVAS DE TITULACIÓN ÁCIDO-BASE. Bronsted-Lowry y Lewis.
octubre TITULACIÓN DE UN ÁCIDO FUERTE Y UN ÁCIDO 3.2 Fuerza relativa de ácidos y bases
DÉBIL, CON UNA BASE FUERTE. en disolución acuosa
3.3 Constantes Ka y Kw.
3.4 Concepto de pH. Ácidos fuertes y débiles. Uso de los
diagramas de Flood.
3.5 Disoluciones amortiguadoras. Ecuación de Charlot.
12 22 - 26 / 11.- DISOLUCIONES AMORTIGUADORAS 3.6 Predicción cualitativa de las reacciones ácido base
octubre
13 29 / octubre 12.- SOLUBILIDAD DE SALES EN AGUA 4. SOLUBILIDAD Y PRECIPITACIÓN
02 / noviembre
*01 jueves y 02 4.1 Solubilidad de sales poco solubles.
viernes 4.2 Expresión de la constante de equilibrio Ks y pKs.
14 05 - 09 / 13.-EQUILIBRIO DE SOLUBILIDAD 4.3 Factores que afectan la solubilidad. Efecto de pH y ion
noviembre común en la solubilidad. Condiciones para que ocurra la
precipitación.
4.4 Precipitación selectiva.
4.5 Grupo I y III de cationes en la Marcha de Bunsen
15 12 - 16 / 14.- ELECTROLISIS DEL AGUA 5. OXIDORREDUCCIÓN
noviembre
5.1 Conceptos básicos: oxidante, reductor, oxidación,
16 19 - 23 / 15.- EQUILIBRIOS DE OXIDO-REDUCCIÓN reducción, par redox conjugado.
noviembre Devolución de gavetas por los alumnos y entrega de 5.2 Fuerza relativa de oxidantes y reductores.
*19 lunes calificaciones por el profesor 5.3 Potenciales de reducción.
5.4 Reacción química y electroquímica. Ecuación de Nerst.
5.5 Predicción cualitativa de reacciones de óxido-reducción.
Prácticas comodín
Exámenes y curso de seguridad en el laboratorio, Examen Departamental (fecha por confirmar)
*Día feriado
* Día de asueto de trabajadores (STUNAM)
You might also like
- Matematicas para Primero de Ciencias PDFDocument235 pagesMatematicas para Primero de Ciencias PDFGeorge ThekingNo ratings yet
- T de Los Circuitos II PDFDocument12 pagesT de Los Circuitos II PDFMarcOs SimbronNo ratings yet
- Cap 8 Forces Intermol-Def-3662Document7 pagesCap 8 Forces Intermol-Def-3662Alexandra Melissa Reto SabaNo ratings yet
- Nomenclatura Enantiómeros R y S PDFDocument1 pageNomenclatura Enantiómeros R y S PDFLeion UchihaNo ratings yet
- Practica 6 Conocimiento de Técnicas AnalíticasDocument7 pagesPractica 6 Conocimiento de Técnicas Analíticasthenightfly081No ratings yet
- Practica No9 Aislamiento de Un Producto NaturalL.-.Document3 pagesPractica No9 Aislamiento de Un Producto NaturalL.-.Leion UchihaNo ratings yet
- Temple de Los AcerosDocument9 pagesTemple de Los AcerosLeion UchihaNo ratings yet
- Practica 7 Fundamentos de EspectofometriDocument10 pagesPractica 7 Fundamentos de EspectofometriSaid RodríguezNo ratings yet
- Resolución de Ecuaciones Diferenciales Homogéneas de Segundo Orden Con Coeficientes ConstantesDocument1 pageResolución de Ecuaciones Diferenciales Homogéneas de Segundo Orden Con Coeficientes ConstantesLeion UchihaNo ratings yet
- Practica 4 Cinetica Enzimatica de La Fosfatasa Alcalina.-.Document9 pagesPractica 4 Cinetica Enzimatica de La Fosfatasa Alcalina.-.Leion UchihaNo ratings yet
- Practica No6 Actividad Mecanica Del Intestino Delgado de Rata PeristaltismoO.-.Document11 pagesPractica No6 Actividad Mecanica Del Intestino Delgado de Rata PeristaltismoO.-.Leion UchihaNo ratings yet
- Cineticapractica6 19764Document19 pagesCineticapractica6 19764Catalino de la MNo ratings yet
- EyC Electrolitos FuertesDocument10 pagesEyC Electrolitos FuertesLeion UchihaNo ratings yet
- CUESTIONARIODocument2 pagesCUESTIONARIOLeion UchihaNo ratings yet
- Practica4 17309Document11 pagesPractica4 17309Rafael LópezNo ratings yet
- Momentos de Inercia.-.Document8 pagesMomentos de Inercia.-.Leion UchihaNo ratings yet
- Cart A Ingres Os No Com ProbablesDocument1 pageCart A Ingres Os No Com ProbablesgusNo ratings yet
- TFG CHRORBEN Part03 PDFDocument219 pagesTFG CHRORBEN Part03 PDFLeion UchihaNo ratings yet
- Cap5 Maunal.-.Document18 pagesCap5 Maunal.-.Leion UchihaNo ratings yet
- Practica 1 Grafica PropiedadesDocument2 pagesPractica 1 Grafica PropiedadesLeion UchihaNo ratings yet
- IntroducciónDocument13 pagesIntroducciónLeion UchihaNo ratings yet
- Electrodos para Soldadura Por ArcoDocument2 pagesElectrodos para Soldadura Por ArcoLeion UchihaNo ratings yet
- Introducción A La InstrumentaciónDocument20 pagesIntroducción A La InstrumentaciónJorge Luis Alavarez PérezNo ratings yet
- MCP16 Intlinea W PDFDocument47 pagesMCP16 Intlinea W PDFLeion UchihaNo ratings yet
- ProyectoDocument3 pagesProyectoLeion UchihaNo ratings yet
- Cap7-Momentos Estáticos PDFDocument22 pagesCap7-Momentos Estáticos PDFiTzRomHs100% (1)
- Cap7-Momentos Estáticos PDFDocument22 pagesCap7-Momentos Estáticos PDFiTzRomHs100% (1)
- Manual de Diseno para Angulos Estructurales L-AZADocument43 pagesManual de Diseno para Angulos Estructurales L-AZAmauricioveracorreaNo ratings yet
- Escenario PrevistosDocument14 pagesEscenario PrevistosJohnnie Guillen0% (1)
- Admon y Produccion Chase Aquilano-2Document16 pagesAdmon y Produccion Chase Aquilano-2NelssAndresPaNaNo ratings yet
- Quiz ModeloDocument6 pagesQuiz Modeloviviana hernandezNo ratings yet
- La-Era-del-Guano - MATERIAL DE LECTURADocument2 pagesLa-Era-del-Guano - MATERIAL DE LECTURAAngel Lizano Tejada100% (2)
- Casos Tipos de ClientesDocument2 pagesCasos Tipos de ClientesDECYELY JOSE PINTO ARMASNo ratings yet
- El Patrimonio Cultural y La Experiencia Educativa Del Visitante - Lauro ZavalaDocument34 pagesEl Patrimonio Cultural y La Experiencia Educativa Del Visitante - Lauro ZavalaRt de MexicoNo ratings yet
- Estado de Resultado Proyectado - Casos PracticosDocument6 pagesEstado de Resultado Proyectado - Casos PracticosDoris Castro MuñozNo ratings yet
- CADENA DE VALOR ColantaDocument1 pageCADENA DE VALOR ColantaCristina Alfonso Montoya50% (4)
- Revista Emprendedores - No 221 - Febrero de 2016Document124 pagesRevista Emprendedores - No 221 - Febrero de 2016Andrea Alvarez100% (1)
- Escuela - Distribuidor (Fundamentos Del Distribuidor)Document42 pagesEscuela - Distribuidor (Fundamentos Del Distribuidor)Nicolás Mora100% (1)
- Identificación de la posición arancelaria y requisitos asociados para exportar leche y productos lácteosDocument6 pagesIdentificación de la posición arancelaria y requisitos asociados para exportar leche y productos lácteoslorena piragautaNo ratings yet
- Guia 11Document13 pagesGuia 11LAURA ANDREA ROJAS QUINTERO50% (2)
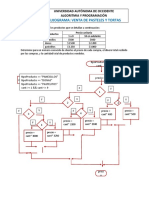
- Flujograma Venta de Tortas y PastelesDocument2 pagesFlujograma Venta de Tortas y PastelesJuan Manuel Espitia CastañoNo ratings yet
- Senati Plantilla Power PointDocument20 pagesSenati Plantilla Power PointLeito Alvarado CarranzaNo ratings yet
- Actividad #4 MercadeoDocument4 pagesActividad #4 Mercadeoerika solanoNo ratings yet
- Actividad 3 Contabilidad Financiera IIDocument12 pagesActividad 3 Contabilidad Financiera IIJohn Esneider FORERO RICONo ratings yet
- Compraventa MotoDocument2 pagesCompraventa MotoYussan ZuñigaNo ratings yet
- Marketing - 4 P - Cerveza KrossDocument32 pagesMarketing - 4 P - Cerveza KrossPamela SeguelNo ratings yet
- Ejemplo Plan de NegociosDocument8 pagesEjemplo Plan de NegociosPilar Vanessa Alférez VélezNo ratings yet
- Evidencia 1 BavariaDocument7 pagesEvidencia 1 BavariaCamilo RuizNo ratings yet
- Plan de Negocios Unidad 2Document34 pagesPlan de Negocios Unidad 2Neri PinachoNo ratings yet
- AP14-AA2 - Evidencia 14.9 Propuesta de NegociaciónDocument9 pagesAP14-AA2 - Evidencia 14.9 Propuesta de NegociaciónCarolina MedinaNo ratings yet
- Marketing Mix Banano OrgánicoDocument5 pagesMarketing Mix Banano OrgánicoRONALDNo ratings yet
- NatumaltaDocument2 pagesNatumaltanathaliaNo ratings yet
- Caso Carsa FinalDocument17 pagesCaso Carsa FinalROBINSON GUERRERO SEGURANo ratings yet
- PP A3 Berber Sanchez Del VillarDocument11 pagesPP A3 Berber Sanchez Del VillarRafael BerberNo ratings yet
- WFM estrategia diferenciación calidad clientesDocument4 pagesWFM estrategia diferenciación calidad clientesJosep FernandezNo ratings yet
- Modelo de Contrato de Compraventa InmuebleDocument6 pagesModelo de Contrato de Compraventa Inmueblezuzetty mariella aguilar lazo100% (1)
- Fundamentos de Contabilidad Administrativa y CostosDocument62 pagesFundamentos de Contabilidad Administrativa y CostosDeyanire JamilethNo ratings yet