Professional Documents
Culture Documents
Planteamiento Del Sistema en Estudio
Uploaded by
yaye_lopezCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Planteamiento Del Sistema en Estudio
Uploaded by
yaye_lopezCopyright:
Available Formats
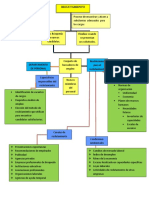
Planteamiento del sistema en estudio
Se electrogenera yodo, en condiciones convectivas y por imposición de potencial directo, en
medio yodurado el cual se aprovecha para titular ácido ascórbico directamente en jugo de algún
cítrico. La serie de reacciones que ocurren al imponer un pulso de potencial son las siguientes:
La reacción de electro-oxidación del yoduro en exceso (1) es la reacción que desencadena el
mecanismo completo del electroanálisis hasta la reacción de monitoreo (4) visual del fin de
reacción de titulación (3):
ANODO (mecanismo ErCrCr): 2I- - 2e- I2 (1) I2 + I- = I3 - (2)
El principio de la cuantificación está basado en el hecho de que la reacción (1) es
electroquímicamente rápida, las reacciones químicas (2-3) acopladas a la reacción (1) son de
cinética química rápida y la agitación vigorosa constante garantiza que la transferencia de masa se
efectúe bajo condiciones difusivas convectivas rápidas. Al potencial constante aplicado y en
presencia de electrolito soporte interte (KNO3 0.1 mol/L) la corriente de electrólisis es
prácticamente constante y faradaica. En tales condiciones se cumplen las leyes de Faraday
directamente: Q = nFN = It
Donde: Q = carga en coulombios [C] n = mol de electrones
F = constante de Faraday 96 485 C N = mol electrolizada
I = intensidad de corriente de electrólisis en amperios [A]
t = tiempo de electrólisis [s]
La cuantificación se basa en determinar el tiempo de electrólisis al vire del indicador en soluciones
estándar, ts , y para una muestra, tx , y comparar:
operaciones analíticas a realizar:
Análisis del estándar
1.0 En una celda de 10 mL de capacidad introducir 5 mL de H2O y cristales en exceso de KNO3 y KI.
Agregar una gota ( 50 µL) de ácido acético concentrado (F = 17). Disolver.
2.0 Agregar 0.1 mL de ácido ascórbico 0.1 mol/L y una gota de indicador de almidón. Mezclar.
3.0 Introducir los electrodos de acero inoxidable.
4.0 Bajo microagitación magnética constante conectar los electrodos al eliminador de baterías de
12 V DC. En el momento de conectar los electrodos tomar el tiempo hasta el vire del indicador.
Análisis de la muestra
5.0 En una celda de 10 mL de capacidad introducir 5 mL de H2O y cristales en exceso de KNO3 y KI.
Agregar una gota ( 50 µL) de ácido acético concentrado (F = 17). Disolver.
6.0 Agregar 1 mL de jugo de limón y una gota de indicador de almidón. Mezclar.
7.0 Introducir los electrodos de acero inoxidable.
8.0 Bajo microagitación magnética constante conectar los electrodos al eliminador de baterías de
12 V DC. En el momento de conectar los electrodos tomar el tiempo hasta el vire del indicador.
Repetir con diferente volumen de muestra de ser necesario.
You might also like
- Gestion AmbientalDocument4 pagesGestion Ambientalyaye_lopezNo ratings yet
- SÍNTESIS-De-cloruro de Plomo IIDocument3 pagesSÍNTESIS-De-cloruro de Plomo IIyaye_lopez0% (1)
- Sintesis de Hidroxido de Cobre 1Document5 pagesSintesis de Hidroxido de Cobre 1yaye_lopezNo ratings yet
- Inorganica AluminioDocument3 pagesInorganica Aluminioyaye_lopezNo ratings yet
- Inf. Lab. Inorganica 2 Practica 5Document3 pagesInf. Lab. Inorganica 2 Practica 5yaye_lopezNo ratings yet
- Sintesis de Compuestos de CoordinacionnDocument4 pagesSintesis de Compuestos de Coordinacionnyaye_lopezNo ratings yet
- Sintesis de Cloruro de IsopropiloDocument8 pagesSintesis de Cloruro de Isopropiloyaye_lopezNo ratings yet
- Evangelista TorricelliDocument1 pageEvangelista Torricelliyaye_lopezNo ratings yet
- Masa (Tema)Document5 pagesMasa (Tema)yaye_lopezNo ratings yet
- Tratamiento de Aguas para El Consumo HumanoDocument20 pagesTratamiento de Aguas para El Consumo Humanoyaye_lopezNo ratings yet
- Evangelista TorricelliDocument1 pageEvangelista Torricelliyaye_lopezNo ratings yet
- Calor de NeutralizaciónDocument12 pagesCalor de Neutralizaciónyaye_lopezNo ratings yet
- RECICLAJEDocument5 pagesRECICLAJEyaye_lopezNo ratings yet
- Ejemplo 1Document5 pagesEjemplo 1yaye_lopezNo ratings yet
- Sintesis de Benzoato de SS NaftiloDocument10 pagesSintesis de Benzoato de SS Naftiloyaye_lopezNo ratings yet
- Talco Desengrasante para CabelloDocument1 pageTalco Desengrasante para Cabelloyaye_lopezNo ratings yet
- Ejercicios de Compuestos FenolicosDocument2 pagesEjercicios de Compuestos Fenolicosyaye_lopezNo ratings yet
- Info 2 Lab Ana 2017Document8 pagesInfo 2 Lab Ana 2017yaye_lopezNo ratings yet
- Ciclo Del CobreDocument9 pagesCiclo Del Cobreyaye_lopezNo ratings yet
- Reclutamiento LopezDocument1 pageReclutamiento Lopezyaye_lopezNo ratings yet
- INTRODUCCIÒN - Obtencion de ColesterolDocument5 pagesINTRODUCCIÒN - Obtencion de Colesterolyaye_lopezNo ratings yet
- Formulación de PlaguicidadDocument10 pagesFormulación de Plaguicidadyaye_lopezNo ratings yet
- Citrato BiotecDocument2 pagesCitrato Biotecyaye_lopezNo ratings yet
- Tratamiento de Aguas para El Consumo HumanoDocument2 pagesTratamiento de Aguas para El Consumo Humanoyaye_lopezNo ratings yet
- AgricolaDocument3 pagesAgricolayaye_lopezNo ratings yet
- Expo 3Document3 pagesExpo 3yaye_lopezNo ratings yet
- Determinación de Fosfatos en Aguas Por EspectrofotometríaDocument8 pagesDeterminación de Fosfatos en Aguas Por Espectrofotometríayaye_lopezNo ratings yet
- Densidad AparenteDocument4 pagesDensidad Aparenteyaye_lopezNo ratings yet
- Fcoqca Info 1Document3 pagesFcoqca Info 1yaye_lopezNo ratings yet
- 5 Antitrombticos 1216286328501938 9Document41 pages5 Antitrombticos 1216286328501938 9Jose Antonio Marrasquin LujanoNo ratings yet
- AlcaloidesDocument3 pagesAlcaloidesKarina Esveidy Cortez HdezNo ratings yet
- Trmodinamica 2017 Practica N°3Document3 pagesTrmodinamica 2017 Practica N°3kaesar66No ratings yet
- Cinetica EnzimaticaDocument35 pagesCinetica Enzimaticajiavgr_357965222No ratings yet
- P5 Propiedades de Los Compuestos Iónicos y Covalentes SCRIBDDocument3 pagesP5 Propiedades de Los Compuestos Iónicos y Covalentes SCRIBDChema CastilloNo ratings yet
- Baterias y PilasDocument7 pagesBaterias y PilasJhon SarauzNo ratings yet
- Curso: Gestión de Residuos: Unidad 3: Residuos Industriales (Residuos No Municipales)Document44 pagesCurso: Gestión de Residuos: Unidad 3: Residuos Industriales (Residuos No Municipales)Brigitt chumpitazNo ratings yet
- Antecedent EsDocument2 pagesAntecedent EsBrian Montaño FernandezNo ratings yet
- Hoja Calculo Pdcaas MezclasDocument8 pagesHoja Calculo Pdcaas MezclasAaron Quispe ChambiNo ratings yet
- Anexo 4 - Solidez de Los Agregados Frente A La Acción de Soluciones de Sulfato de Sodio o de Magnesio (I.n.v. E - 220)Document4 pagesAnexo 4 - Solidez de Los Agregados Frente A La Acción de Soluciones de Sulfato de Sodio o de Magnesio (I.n.v. E - 220)Liliana PaezNo ratings yet
- Biologia 8B S3 GuiaDocument3 pagesBiologia 8B S3 GuiaAlba Rocio Rayon NavarroNo ratings yet
- LasDocument4 pagesLasIgnacio Joel HerreraNo ratings yet
- Formas Farmacéuticas LíquidasDocument4 pagesFormas Farmacéuticas LíquidasCynthia GonzalesNo ratings yet
- Panorama de Farmacovigilancia en Las Am RicasDocument38 pagesPanorama de Farmacovigilancia en Las Am RicasJean AntoineNo ratings yet
- Alimentos FuncionalesDocument13 pagesAlimentos Funcionalesmarc0scp100% (1)
- Informe de Lab 4Document4 pagesInforme de Lab 4RENZO RENATO VELASQUEZ LOLINo ratings yet
- Planteamiento Del Problema PlaguicidasDocument30 pagesPlanteamiento Del Problema PlaguicidasALBER YELANo ratings yet
- CLF Q Productos LimpiezaDocument4 pagesCLF Q Productos LimpiezaEzequiel RodríguezNo ratings yet
- Características GeneralesDocument5 pagesCaracterísticas GeneralesMarcelo GonzalezNo ratings yet
- Ficha - Tecnica - MAP SENSUS 405 - S - 13-19Document2 pagesFicha - Tecnica - MAP SENSUS 405 - S - 13-19piper123123123100% (3)
- Anexo 1 - Guia para El Desarrollo de La Tarea 2Document9 pagesAnexo 1 - Guia para El Desarrollo de La Tarea 2Natalia Paola ZuñigaNo ratings yet
- Produccion y Optimización de Alfa AmilasaDocument11 pagesProduccion y Optimización de Alfa AmilasaDome VillavicencioNo ratings yet
- Elementos AlotrópicosDocument11 pagesElementos AlotrópicosJhan Diaz Rubio0% (1)
- Libro Ambiente para El Cultivo de PecesDocument20 pagesLibro Ambiente para El Cultivo de Pecesjob88264629No ratings yet
- Laboratorio AdnDocument5 pagesLaboratorio AdnJesus RodriguezNo ratings yet
- Los SilicatosDocument7 pagesLos SilicatosJoel JelambiNo ratings yet
- Sensor de Cloro LibreDocument4 pagesSensor de Cloro LibreRoger Osorio GuillenNo ratings yet
- Fotosintesis 1Document8 pagesFotosintesis 1María Alejandra García BoveaNo ratings yet
- Compuestos OxigenadoDocument11 pagesCompuestos OxigenadoDionell RodriguezNo ratings yet
- Examen Recuperatorio Pet 216 TeoricoDocument2 pagesExamen Recuperatorio Pet 216 TeoricoCesar AlvarezNo ratings yet