Professional Documents
Culture Documents
Problemas7 Hornos2 PDF
Uploaded by
Felipe Romario Hilario QuispeOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Problemas7 Hornos2 PDF
Uploaded by
Felipe Romario Hilario QuispeCopyright:
Available Formats
72.
02 INDUSTRIAS I
Metodología problemas: AH – LD - HE Fecha: 2/2010
Problema: Balance de Materiales Alto Horno
Enunciado:
Se carga un alto horno con mineral de hierro, caliza y coque con los siguientes
análisis:
Análisis en % (Peso)
Material Fe2O3 SiO2 MnO Al2O3 H2O C CaCO3
Mineral hierro 80 12 1 3 4
Caliza 4 1 95
Coque 10 90
El análisis del arrabio producido es:
C: 4%
Si: 1,2 %
Mn: 1 %
Fe: 93,8%
Se utilizan 1750 Kg. de mineral de hierro y 500 Kg. de piedra caliza por cada
tonelada de arrabio producido.
El volumen de los gases de salida por tonelada de arrabio es 4200 m³. Su
composición es:
Gases de salida:
CO: 26%
CO2: 12%
H2O: 4%
N2: 58%
Calcular:
A) La cantidad de coque utilizado por tonelada de arrabio
B) Composición de la escoria suponiendo que el hierro entra en la arrabio
como Fe2O3
C) Consumo de aire (m³) por tonelada de arrabio
72.02 INDUSTRIAS I
Metodología problemas: AH – LD - HE Fecha: 2/2010
Resolución:
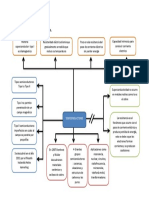
A) Se toma como base una tonelada de arrabio
Mineral hierro, 1750 Kg Gas salida, 4200 m³
(80% Fe2O3; 12% SiO2; (26% CO; 12% CO2;
1% MnO; 3% Al2O3; 4% H2O ) 4% H2O; 58% N2)
Piedra Caliza, 500 Kg
(95% CaCO3; 1% H2O;
4% SiO2)
Alto
Horno
Coque
(10% SiO2; 90% C)
Aire
(Fe2O3, SiO2, MnO,
(79% N2)
Escoria Al2O3, CaO)
Arrabio, 1000 kg (4% C; 1,2% Si;
1% Mn; 93,8% Fe)
A) Balance carbón
C (en coque) + C (p. Caliza) = C (arrabio) + C (como CO2 + CO en gases de salida)
Como C + ½ O2 CO
C + O2 CO2 nC = nCO + nCO2 = 48,75 + 22,5
= 71,25 Kg C
Coque P. caliza Arrabio Gases salida
0,9. X 0,95 . 500 . 12 0,04 . 1000
+ 100 = + 71,25
12 12 12
(Peso atómico C=12) (Peso molecular CaCO3 = 100)
72.02 INDUSTRIAS I
Metodología problemas: AH – LD - HE Fecha: 2/2010
0,075 . X + 4,75 = 3,333 + 71,25
X = 69,833 / 0,075 ⇒
X = 931 Kg coque / tonelada arrabio
B) Composición escoria
Componentes escoria: Fe2O3; SiO2; MnO; Al2O3; CaO
Balance Fe2O3
Fe2O3 (en mineral hierro) = Fe2O3 (en escoria) + Fe2O3 (hierro en arrabio
calculado como Fe2O3)
Fe2O3 (en escoria) = 1400 – 1340 = 60 kg
Ídem con los demás componentes.
C) Consumo aire (m³ / tonelada de arrabio)
N2 (aire) = N2 (gases salida)
Consumo de aire = 2436 . (100 / 79) = 3038,5 m³ / ton. de arrabio
72.02 INDUSTRIAS I
Metodología problemas: AH – LD - HE Fecha: 2/2010
Problema: Determinación de Oxígeno necesario en Convertidor LD
Enunciado:
Convertidor: Capacidad 180 tons. Carga metálica.
70 % Arrabio
30% Chatarra
Características Arrabio – Acero
C (%) Si (%) Mn (%) P (%) S (%) T (ºC)
Arrabio 4,30 1,20 1,00 0,10 0,03 1370
Acero 0,06 0,00 0,20 0,015 0,015 1620
Características Proceso
• Humos: 90% CO y 10% CO2
• 8 Kgs. de O2/ton arrabio se consumen en la formación de óxidos de
hierro.
• Pureza O2: 99.5%
Otros datos: Pesos Atómicos
C O Si Mn P Fe
12 16 28 55 31 56
Determinar: Necesidades de O2 para obtener el acero
72.02 INDUSTRIAS I
Metodología problemas: AH – LD - HE Fecha: 2/2010
Resolución:
1) Eliminación del Carbono:
C arrabio – C acero = 4,3% – 0,06 %= 4,24 %
4,24 % x (1000 kg/100) = 42,4 kg. C / ton. arrabio
42,4 kg.: 38,16 kg. Se eliminan con el CO (90 %)
4,24 kg. Se eliminan con el CO2 (10%)
1.a) Como monóxido de carbono:
2 C + O2 (g) → 2 CO (g)
2 x 12 + 16 x 2 → 56
24 kg de C → 32 kg O2
38,16 kg de C → X = 50,9 kg O2 / ton. arrabio
1.b) Como anhídrido carbónico:
Se determina como 1.a
El total de oxigeno es: suma de 1.a y 1.b
2) Eliminación del Silicio:
Si arrabio – Si acero = 1,2% – 0,00 %= 1,2 %
1,2 % x (1000 kg/100) = 12 kg. de Si/ ton. de arrabio
Si + O2 (g) → SiO2 (g)
28 + 16 x 2 → 60
Se determina la cantidad de oxígeno necesario
3) Eliminación del Manganeso:
Proceso similar a punto 2.
4) Eliminación del Fósforo:
Proceso similar a punto 3.
NECESIDADES TOTALES DE OXIGENO ( kg. O2 / ton. arrabio)
Suma de necesidades parciales
1 molécula – gramo (mol) de O2 = 2 x 16 g = 32 g
Un mol de cualquier gas en condiciones normales de presión y temperatura (1
atmósfera y 273 K) ocupa 22,4 litros.
Se determina en metros cúbicos referenciados a la pureza y al arrabio
72.02 INDUSTRIAS I
Metodología problemas: AH – LD - HE Fecha: 2/2010
Problema Balance Térmico: Horno Eléctrico de Arco
Enunciado:
Problema:
• Determinación de las energías teóricas de oxidación
• Determinación del oxígeno necesario para las reacciones de oxidación
Datos:
Carga promedio del horno
Componente cantidad/colada cantidad/tal
Hierro esponja 52,3 t 679 kg/tal
Chatarra 34,9 t 453 kg/tal
Cal mezcla 3,6 t 47 kg/tal
Carbón insuflado 0,35 t 4,5 kg/tal
Carbón por cinta 0,35 t 4,5 kg/tal
Finos 1t 13 kg/tal
Acero 77 t 1000 kg/tal
Escoria 9,9 t 129 kg/tal
72.02 INDUSTRIAS I
Metodología problemas: AH – LD - HE Fecha: 2/2010
Componentes Chatarra Hierro esponja Acero líquido Escoria Finos
FeT 92,4 29,16 61,9
Femetálico 90 87,8 3,19 4,6
FeO 5,7 25,97 13,2
C 0,2 2,3 0,07 - 1,56
SiO2 1,55 11,81 4,15
Si 0,2
Al2O3 0,76 4,63 0,8
Al 0,02
CaO 0,47 26,94 12,5
MgO 0,2 10,57 5,9
MnO 0,1 2,75 2,55
Mn 0,6 0,04
P 0,023 0,007 -
P2O5 0,048 0,63
S 0,003 - 0,32
72.02 INDUSTRIAS I
Metodología problemas: AH – LD - HE Fecha: 2/2010
Resolución:
1. Energía teórica de las reacciones de oxidación
1.1. Oxidación del Silicio.
Si + O2 ⇒ SiO2 ΔH = -9 Kw h .
kg Si
Cantidad de Si chatarra = 453 kg ch . 0,20 kg Si = 0,906 kg Si .
tal 100 kg ch tal
ESi = Energía de oxidación del Silicio = 9 Kw h . 0,906 kg Si =
kg Si tal
ESi = 8,15 Kw h .
tal
1.2 Oxidación del Manganeso.
Mn + 1 O2 ⇒ MnO. ΔH = -2,04 Kw h .
2 kg Mn
Cantidad de Mn en la chatarra = 453 kg ch . 0,60 kg Mn = 2,718 kg Mn .
tal 100 kg ch tal
Cantidad de Mn en acero = 0,04 kg Mn . 1000 kg acero líq.
100 kg acero líq.
Cantidad de Mn en acero = 0,4 kg Mn .
tal
EMn = Energía de oxidación del Mn = 2,04 Kw h . (2,718 - 0,4) kg Mn .
kg Mn tal
EMn = 4,73 Kw h.
tal
1.3. Oxidación del Aluminio.
Similar a los anteriores
1.4. Oxidación del Fósforo.
Similar a los anteriores
72.02 INDUSTRIAS I
Metodología problemas: AH – LD - HE Fecha: 2/2010
1.5. Oxidación del Hierro.
Fe + 1 O2 ⇒ FeO. ΔH = - 1,2 Kw h .
2 kg Fe
56 16 72
La cantidad de FeO formado presente en la escoria es:
= 25,97 kg FeO . 129 kg esc = 33,47 kg FeO .
100 kg esc. tal tal
Cantidad de Fe que reacciona = 33,47 kg FeO . 56 kg FeO = 26,03 kg Fe .
tal 72 kg FeO tal
EFe = Energía de oxidación del Fe = 26,03 kg Fe . 1,2 Kw h =
tal kg Fe
EFe = 31,24 Kw h .
tal
1.6. Energía de las reacciones de oxidación.
Suma de las calculadas
2. Determinación del oxígeno necesario para las reacciones de
oxidación.
Datos: Pesos Atómicos
Σ O2 = O2 Silicio + O2 Manganeso + O2 Aluminio + O2 Fósforo + O2 Hierro
Se determina en metros cúbicos por tonelada de acero líquido.
You might also like
- Muy Probable Problema de Alto HornoDocument10 pagesMuy Probable Problema de Alto HornohcampospNo ratings yet
- Balance Alto HornoDocument8 pagesBalance Alto HornoLuis Andres Arancibia BecerraNo ratings yet
- Muy Probable Problema de Alto HornoDocument10 pagesMuy Probable Problema de Alto Hornoalberto8303No ratings yet
- Balance de Materiales Alto HornoDocument9 pagesBalance de Materiales Alto HornoWh TayaNo ratings yet
- Problemas7 Hornos2Document16 pagesProblemas7 Hornos2Leonardo GallegosNo ratings yet
- Balance Elaboracion de Arrabico en El Alto HornoDocument5 pagesBalance Elaboracion de Arrabico en El Alto HornoRosani AguilarNo ratings yet
- Guia Balance SiderurgiaDocument4 pagesGuia Balance Siderurgianicol san martinNo ratings yet
- PIROMETALURGIADocument5 pagesPIROMETALURGIAFran Belén ZúAlNo ratings yet
- Punto 3 RefraDocument9 pagesPunto 3 RefraCésar A. AparicioNo ratings yet
- Problemas Balance de Materia de Altos HornosDocument15 pagesProblemas Balance de Materia de Altos HornosCRISTHIAN SANTOS FLORES LUQUENo ratings yet
- Problemas de SiderurgiaDocument9 pagesProblemas de SiderurgiaRenatoAlonsoAbarcaArana100% (1)
- Solución - Segundo Examen ParcialDocument10 pagesSolución - Segundo Examen ParcialsocorroNo ratings yet
- Tercera Practica Calificada Ml706 Procesos Pirometalurgicos 2020Document2 pagesTercera Practica Calificada Ml706 Procesos Pirometalurgicos 2020LLERENA SUZARET ORUE VILLEGASNo ratings yet
- Balance de Masa y EnergíaDocument35 pagesBalance de Masa y EnergíaDiego F. CuevasNo ratings yet
- Práctica 2Document4 pagesPráctica 2Tacachiri Chocamani JaimeNo ratings yet
- 4.4. Balance de Masa en El Alto HornoDocument5 pages4.4. Balance de Masa en El Alto HornoMiguel Angel Mamani AliNo ratings yet
- Fijas PC2Document9 pagesFijas PC2FrankMarkoCastañedaMalpartidaNo ratings yet
- PDF Practica 02 Metalurgia 2 Tostacion 2017docx - CompressDocument6 pagesPDF Practica 02 Metalurgia 2 Tostacion 2017docx - CompressCristian Elian Ventura CoaquiraNo ratings yet
- EhhhhDocument6 pagesEhhhhdiomedesNo ratings yet
- Produccion de ArrabioDocument12 pagesProduccion de ArrabioMiguel Angel HernandezNo ratings yet
- Tarea GruoaDocument7 pagesTarea GruoaJosueNo ratings yet
- Problemas Años AnterioresDocument4 pagesProblemas Años AnterioresNicolas Olivari ViverosNo ratings yet
- Laboratorio N°2Document23 pagesLaboratorio N°2Shirley Andrea ChambiNo ratings yet
- Examen Siderurgia ParcialDocument3 pagesExamen Siderurgia ParcialEd LCNo ratings yet
- META 2 TAREA1 ResoñucionDocument21 pagesMETA 2 TAREA1 ResoñucionALEJANDRO ALONSO OCHOA VARGASNo ratings yet
- Manufactura 1 Presentacion Extra PDFDocument39 pagesManufactura 1 Presentacion Extra PDFJ'uan M'anuel V'mNo ratings yet
- Taller 10 - Estequiometr A II y Balance de MasasDocument6 pagesTaller 10 - Estequiometr A II y Balance de MasasNeyson Osorio JananpaNo ratings yet
- Enunciado Ejercicio de Balance Materia Alto HornoDocument2 pagesEnunciado Ejercicio de Balance Materia Alto HornosandraNo ratings yet
- Siderurgia 3era Practica Monge SorianoDocument9 pagesSiderurgia 3era Practica Monge SorianoGary Monge SorianoNo ratings yet
- Practica 02 Metalurgia 2 Tostacion 2017Document13 pagesPractica 02 Metalurgia 2 Tostacion 2017EmersonSJ0% (1)
- Chavez Lechon Efrain Gualberto SiderDocument13 pagesChavez Lechon Efrain Gualberto SiderHenry Jesus Saavedra AlvarezNo ratings yet
- Vsip - Info - Guia Balance Siderurgia PDF FreeDocument8 pagesVsip - Info - Guia Balance Siderurgia PDF Freechristopher orellana carmonaNo ratings yet
- Procesos Industriales Ii: Sesion N ° 07 SiderurgiaDocument30 pagesProcesos Industriales Ii: Sesion N ° 07 SiderurgiaJhon Icho GarciaNo ratings yet
- Hierro Esponja 2011Document80 pagesHierro Esponja 2011Marco Antonio Ojeda PradoNo ratings yet
- 2da PRAC CAL 07 de HoyDocument3 pages2da PRAC CAL 07 de Hoysergio ramozNo ratings yet
- Arrabio Tarea CDLM 2023Document1 pageArrabio Tarea CDLM 2023Eduardo DelfinNo ratings yet
- 1-ESTUDIANTESTRABAJO-DE-INVESTIGACI - N-PROBLEMAS-DE-INVESTIGACI - N-PARA-SUSTENTACI - N-Copia - Docx Filename UTF-8''1-ESTUDIANTESTRABAJO-DE-INVESTIGACIÓN-PROBLEMAS-DE-INVESTIGACIÓN-PARA-SUSTENTACIÓNDocument18 pages1-ESTUDIANTESTRABAJO-DE-INVESTIGACI - N-PROBLEMAS-DE-INVESTIGACI - N-PARA-SUSTENTACI - N-Copia - Docx Filename UTF-8''1-ESTUDIANTESTRABAJO-DE-INVESTIGACIÓN-PROBLEMAS-DE-INVESTIGACIÓN-PARA-SUSTENTACIÓNjhon gonzales100% (1)
- Guia 2 Procesos Pirometalurgicos Del CobreDocument4 pagesGuia 2 Procesos Pirometalurgicos Del CobreBenjaminNo ratings yet
- Jose Faustino Sanchez: Ejercicios ResueltosDocument8 pagesJose Faustino Sanchez: Ejercicios ResueltosCesar JanquiNo ratings yet
- Tema 3.2Document33 pagesTema 3.2Andrea Garcia LopezNo ratings yet
- Semana 5 (Teoría) - Alto Horno Hierro EsponjaDocument87 pagesSemana 5 (Teoría) - Alto Horno Hierro EsponjaPochito Anacleto Grandote PardoNo ratings yet
- Balance de MateriBALANCE DEL ALTO HORNOaDocument28 pagesBalance de MateriBALANCE DEL ALTO HORNOaGabriel VillanuevaNo ratings yet
- Proceso Del Horno AltoDocument36 pagesProceso Del Horno Alto2fercepolNo ratings yet
- Grupo 1 Actividad 10 (Problema 4, 5 y 2)Document9 pagesGrupo 1 Actividad 10 (Problema 4, 5 y 2)LEONARDO V�CTOR EUGENIO PACHAS QUISPENo ratings yet
- Lan 3 Red. Carbot. de Pbo AbitaDocument12 pagesLan 3 Red. Carbot. de Pbo AbitaedgarNo ratings yet
- Sem 02 Química AmbientalDocument6 pagesSem 02 Química AmbientalAnonymous OKvsl0L8CNo ratings yet
- Guia N°3 PirometalurgiaDocument4 pagesGuia N°3 PirometalurgiaFranco Castro ArayaNo ratings yet
- Sem 02 Química AmbientalDocument7 pagesSem 02 Química AmbientalCarlos GonzalesNo ratings yet
- Problemas de Balance de MasaDocument9 pagesProblemas de Balance de MasaBill C. Mercado GamboaNo ratings yet
- Estequiometria 2Document13 pagesEstequiometria 2LENIN GAMARRANo ratings yet
- Seminario 3problema He 2Document3 pagesSeminario 3problema He 2FrankMarkoCastañedaMalpartidaNo ratings yet
- Problemas de Pirometalurgia IIDocument9 pagesProblemas de Pirometalurgia IICarloXs Xs Mgl100% (2)
- Problemas de Pirometalurgia IIDocument9 pagesProblemas de Pirometalurgia IICarloXs Xs MglNo ratings yet
- Tratamiento de Lodos AnodicosDocument6 pagesTratamiento de Lodos AnodicosmedyNo ratings yet
- Taller PirometalurgiaDocument19 pagesTaller PirometalurgiaMarcos Geo LogiaNo ratings yet
- Trabajo Práctico #4Document3 pagesTrabajo Práctico #4brenmendez2No ratings yet
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSAFrom EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSANo ratings yet
- 5to Practica de Soldadura 1Document4 pages5to Practica de Soldadura 1Felipe Romario Hilario QuispeNo ratings yet
- 7ma Practica de SoldaduraDocument5 pages7ma Practica de SoldaduraFelipe Romario Hilario QuispeNo ratings yet
- 2da Practica de SoldaduraDocument4 pages2da Practica de SoldaduraFelipe Romario Hilario QuispeNo ratings yet
- 6ta Practica de Soldadura 1Document6 pages6ta Practica de Soldadura 1Felipe Romario Hilario QuispeNo ratings yet
- El proceso FASTMET fue desarrollado en los años 90 por varios actores clave de la industria para crear un proceso de fabricación de hierro más rentable para combatir el aumento de los precios del gas natural que impulsó unDocument3 pagesEl proceso FASTMET fue desarrollado en los años 90 por varios actores clave de la industria para crear un proceso de fabricación de hierro más rentable para combatir el aumento de los precios del gas natural que impulsó unFelipe Romario Hilario QuispeNo ratings yet
- 10 Modelos de Optimización de RedesDocument25 pages10 Modelos de Optimización de RedesFelipe Romario Hilario QuispeNo ratings yet
- Practica 8Document6 pagesPractica 8Felipe Romario Hilario QuispeNo ratings yet
- CAP9 RevenidoDocument70 pagesCAP9 RevenidoFelipe Romario Hilario QuispeNo ratings yet
- Aditivos Potenciadores de Sabor y Agentes de Textura EstudiarDocument9 pagesAditivos Potenciadores de Sabor y Agentes de Textura EstudiarRonald LPNo ratings yet
- Vicerrectorado BarquisimetoDocument98 pagesVicerrectorado BarquisimetoAnthony Rojas LopezNo ratings yet
- Libro MycomDocument97 pagesLibro MycomCesar Gabriel Carrasco MejiaNo ratings yet
- Ensayo DefinitivoDocument4 pagesEnsayo DefinitivoAnnel PerezNo ratings yet
- QuimicaDocument18 pagesQuimicaPsc. Linda Cajas Edgar100% (1)
- Penicillium ChriysogenumDocument2 pagesPenicillium ChriysogenumKevin100% (1)
- Materia Organica e InorganicaDocument3 pagesMateria Organica e InorganicaDelv NpNo ratings yet
- Tema 1 Glandulas Salivales PDFDocument66 pagesTema 1 Glandulas Salivales PDFMIGUEL ANGEL CALLE GRANADANo ratings yet
- Trabajo - Accidente de Seveso, ItaliaDocument20 pagesTrabajo - Accidente de Seveso, ItaliaJohn Rimaycuna Ramirez100% (1)
- 5 CristalografiaDescriptivaDocument104 pages5 CristalografiaDescriptivaPriscilla Alvarez Meneses0% (1)
- Fundamentos Pruebas Bioquimicas y Medios de CultivoDocument12 pagesFundamentos Pruebas Bioquimicas y Medios de CultivoNatiNo ratings yet
- Intr. Química OrgánicaDocument48 pagesIntr. Química OrgánicaNubia Hasset Palacios MosqueraNo ratings yet
- PRÁCTICA 1 Química de SolucionesDocument17 pagesPRÁCTICA 1 Química de SolucionesAndrea ChristinaNo ratings yet
- Tema+1.+Introduccion+ V1.1Document19 pagesTema+1.+Introduccion+ V1.1AndresD.MendozaNo ratings yet
- QIR - Cuaderno 2016Document22 pagesQIR - Cuaderno 2016GiadaTitiCanigliaNo ratings yet
- Prevalencia de Caries Dental Según El Índice CPOD en Pacientes Adultos Chacchadores de Hojas de CocaDocument16 pagesPrevalencia de Caries Dental Según El Índice CPOD en Pacientes Adultos Chacchadores de Hojas de Cocadavidiaz19890% (1)
- Sistema Directo DE Suministro de Agua: Segunda UnidadDocument44 pagesSistema Directo DE Suministro de Agua: Segunda Unidadda silvaNo ratings yet
- Tarea 3 Ejercicio 3 - Nicolas Alvarez Diagrama MentefactoDocument1 pageTarea 3 Ejercicio 3 - Nicolas Alvarez Diagrama MentefactoDiasarmaNo ratings yet
- Toma de Muestras de Fitoplanc MacroDocument3 pagesToma de Muestras de Fitoplanc MacroJoel Medina GuttiNo ratings yet
- Oro y Plata Por AbsorcionDocument8 pagesOro y Plata Por AbsorcionNivio ZarateNo ratings yet
- Sistemas de Refrigeracion-2015Document73 pagesSistemas de Refrigeracion-2015Delmy GonzálezNo ratings yet
- Dop Dap VeredaDocument12 pagesDop Dap VeredaJulio Ñahuincopa ArangoNo ratings yet
- Guia de Interpretacion de Analisis de Agua para RiegoDocument9 pagesGuia de Interpretacion de Analisis de Agua para RiegoVictor Gutierrez CruzNo ratings yet
- MasterbachtsDocument8 pagesMasterbachtsELIANA GABRIELA ALVAREZ ZUÑIGANo ratings yet
- Tronadura y Voladura en Mineria Cielo AbiertoDocument24 pagesTronadura y Voladura en Mineria Cielo AbiertoAle100% (2)
- Sesión 2 NEURONAS PSICOLOGIADocument33 pagesSesión 2 NEURONAS PSICOLOGIALuis GalvanNo ratings yet
- Lab 13692695Document5 pagesLab 13692695Lorena RosendoNo ratings yet
- Formulas para Fabricar Productos de LimpiezaDocument14 pagesFormulas para Fabricar Productos de Limpiezaecoloco7778% (85)
- Catalogo de Colores 2020Document10 pagesCatalogo de Colores 2020Aída SiuNo ratings yet