Professional Documents
Culture Documents
Alcalinité
Uploaded by
Alkatel Al HanouneOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Alcalinité
Uploaded by
Alkatel Al HanouneCopyright:
Available Formats
ALCALINITE D’UNE EAU
Introduction :
Alcali : de l'arabe "al cali", algue dont on extrait la soude
Depuis l'époque de l'alchimie (de l'arabe al kimiyâ), ce terme désigne les bases solubles dans
l'eau comme la soude (NaOH), la potasse (KOH), ou l'ammoniac aussi appelé alcali volatil
(NH3).
Alcalinité d'une solution : synonyme de basicité, elle augmente avec le pH
Dans les eaux minérales destinées à l'alimentation, l'alcalinité est principalement due à la
présence d'ions carbonate CO32- et hydrogénocarbonate HCO3- (anciennement appelés ions
bicarbonates).
L'alcalinité d'une eau est mesurée par un dosage avec un acide fort. Par convention, on
exprime ce résultat par le Titre Alcalimétrique (TA) et par le Titre Alcalimétrique Complet
(TAC)
Titre Alcalimétrique (TA)
Ce titre est égal au volume d'acide (en mL) à 0,02 mol L-1 d'ions H3O+ nécessaire pour doser
les ions CO32- dans 100 mL d'eau en présence de phénolphtaléine.
(incolore 8,2 < pH < 9,9 rose)
Titre Alcalimétrique Complet (TAC)
Ce titre est égal au volume d'acide (en mL) à 0,02 mol L-1 d'ions H3O+ nécessaire pour doser
les ions CO32- et les ions HCO3- dans 100 mL d'eau en présence de vert de bromocrésol-
rhodamine (BCR). (jaune 3,8 < pH < 5,4 bleu)
Pour une eau potable on doit avoir : TAC < 50.
I) Objectif
Mesurer le TA et le TAC de différentes eaux.
II) Questions préliminaires (à faire à la maison, avant la séance)
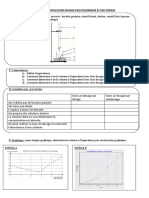
1. Faire la liste du matériel nécessaire pour ce TP.
Réaliser un schéma annoté d'un montage de dosage pH-métrique.
2. Que dire des espèces CO32-, HCO3- et H2CO3 (noté aussi CO2, H2O) ?
3. On donne pKa1 = 6,4 et pKa2 = 10,3. Que signifient ces données ?
4. Placer sur un axe de pH les domaines de prédominance de chacune de ces espèces. Faire
apparaître les zones de virages des indicateurs colorés.
5. Ecrire l’équation de dosage des ions hydrogénocarbonate par les ions H+.
6. On étudie de l’eau d’Evian pour laquelle on lit sur l’étiquette « HCO3- : 357 mg/L »
Convertir cette concentration massique en concentration molaire.
Estimer le volume d'acide chlorhydrique à 0,02 mol.L-1 à verser pour avoir l'équivalence
lors du dosage de 20 mL d'eau.
Une dilution est-elle nécessaire pour éviter une coulée de burette trop grande ou trop
petite ?
III) Manipulation
1. Mesure du TA
Qu'observe-t-on lorsqu'on ajoute quelques gouttes de phénolphtaléine à une prise d'essai
chaque eau ?
Quel est donc le TA de ces eaux ?
2. Mesure du TAC
• Prélever 20 mL d’eau d’Evian.
• Ajouter une dizaine de gouttes de BCR. Quelle est la couleur ?
• Faire le dosage acido-basique de ces 20 mL d'eau par une solution d'HCl à 2.10-2 mol.L-1
en traçant la courbe pH = f(Va) et en surveillant la couleur de la solution.
• Déterminer le volume équivalent avec le virage du BCR et avec la courbe de titrage.
• Effectuer le dosage de 20 mL d’eau du robinet en utilisant uniquement le BCR.
IV) Compte-rendu
On fera apparaître dans le compte-rendu le travail préliminaire, les résultats expérimentaux et
les réponses aux questions suivantes :
1. Justifier l'emploi du BCR pour ce dosage.
2. Commenter les différentes parties de la courbe.
3. Retrouver graphiquement la valeur du pKa du couple : CO2, H2O / HCO3-
4. Pour chaque eau :
- Calculer le TAC grâce à vos résultats expérimentaux.
- Calculez les concentrations (en mol.L-1 et mg.L-1) en ion hydrogénocarbonate.
- Pour l’eau d’Evian, ces résultats sont-ils en accord avec l'étiquette ?
You might also like
- TP AlcaliniteDocument3 pagesTP Alcaliniteجعدبندرهم100% (2)
- Applications de la spectrophotomérie en phytochimie: sciencesFrom EverandApplications de la spectrophotomérie en phytochimie: sciencesNo ratings yet
- TP - Titre AlcalimtrieauDocument2 pagesTP - Titre Alcalimtrieausbe3centrleNo ratings yet
- TAC - Titre Alcalimétrique CompletDocument8 pagesTAC - Titre Alcalimétrique Completabderrahimn67% (3)
- TP - 1 - Traitement EauxDocument4 pagesTP - 1 - Traitement Eauxnasa nasaNo ratings yet
- Série Des Exercices en Chimie Des Eaux 2021Document5 pagesSérie Des Exercices en Chimie Des Eaux 2021Bøũdįāf Khäwlå100% (2)
- AlcalinitéDocument4 pagesAlcalinitéHoc IneNo ratings yet
- Correction DcoDocument3 pagesCorrection DcomohmedNo ratings yet
- Tac TaDocument5 pagesTac TaDana SalasNo ratings yet
- TITRE ALCALIMETRIQUE Et TITRE ALCALIMETRIQUE COMPLETDocument4 pagesTITRE ALCALIMETRIQUE Et TITRE ALCALIMETRIQUE COMPLETLemane CHEIKHNo ratings yet
- TP1 Durete EauDocument3 pagesTP1 Durete Eauayoub dahbiNo ratings yet
- TP AnalytiqueDocument7 pagesTP AnalytiqueRoubio Hiba100% (1)
- TP Traitement Des Eaux 2010Document14 pagesTP Traitement Des Eaux 2010Aya KhaouidNo ratings yet
- Exercice TacDocument2 pagesExercice Tacayoub dahbi100% (1)
- 7 AlcalinitéDocument12 pages7 AlcalinitéabdouNo ratings yet
- TP Mesure Du Tac Alcalinite Btsa Gemeau m58Document4 pagesTP Mesure Du Tac Alcalinite Btsa Gemeau m58kawterNo ratings yet
- Stage de Fin DDocument20 pagesStage de Fin DAyour Wazal TouaziNo ratings yet
- Memotec 17Document2 pagesMemotec 17Amine Jebli100% (1)
- TP Chimie 1Document18 pagesTP Chimie 1Abla FettahNo ratings yet
- Chapitre3 Chimie Des EauxDocument24 pagesChapitre3 Chimie Des EauxAnime StageNo ratings yet
- Analyse Des Eaux DDocument8 pagesAnalyse Des Eaux DAmira ZedNo ratings yet
- Partie Expérimentale I ChlorationDocument4 pagesPartie Expérimentale I ChlorationYa CinNo ratings yet
- S3 TBP CME5.3 TP EleveDocument6 pagesS3 TBP CME5.3 TP EleveJamal LachgreNo ratings yet
- Chimie Des EauxDocument26 pagesChimie Des EauxAMIRA FADIA GHOMRANINo ratings yet
- Le But de Ce TP Est de Doser Les SulfatesDocument3 pagesLe But de Ce TP Est de Doser Les SulfatesMorched Tounsi100% (2)
- TP Dosage Chlore Méthode Iodométrique 2019Document3 pagesTP Dosage Chlore Méthode Iodométrique 2019Bouz. TimaNo ratings yet
- Titre Alcalimetrique Et Titre Alcalimetrique CompletDocument4 pagesTitre Alcalimetrique Et Titre Alcalimetrique CompletBelkacem Elouafi100% (3)
- DésinfectionDocument5 pagesDésinfectionamel amoulNo ratings yet
- DCODocument6 pagesDCOYousef Zoubairi0% (1)
- Titres de L'eauDocument10 pagesTitres de L'eauعمر الفاروق صانع حضارةNo ratings yet
- TPDocument12 pagesTPopppNo ratings yet
- TS Spe Chimie TP 8 Dosage Ions Chlorures Par La Methode de Mohr EleveDocument2 pagesTS Spe Chimie TP 8 Dosage Ions Chlorures Par La Methode de Mohr Elevechabi khaoulaNo ratings yet
- Dosage Des Ions Chlorures Par La Méthode de MohrDocument1 pageDosage Des Ions Chlorures Par La Méthode de MohrAmiraBenhammou100% (1)
- Dosage Azote SolDocument22 pagesDosage Azote Solkamal100% (1)
- Chlorures Charp VolharDocument2 pagesChlorures Charp VolharAmath FayeNo ratings yet
- Chapitre 3 - Paramètres D'analyse de L'eauDocument11 pagesChapitre 3 - Paramètres D'analyse de L'eauرضا بونعاسNo ratings yet
- T.D #03 Chimie Des Eaux GPE M1-2021Document1 pageT.D #03 Chimie Des Eaux GPE M1-2021Boudjaoui100% (2)
- TP 2 - Dosage Des Chlorures PDFDocument2 pagesTP 2 - Dosage Des Chlorures PDFMoezNo ratings yet
- Demande Chimique en OxygèneDocument6 pagesDemande Chimique en Oxygèneayoubouraoui0% (1)
- NC004-Adoucissement Et Décarbonatation Des Eaux EntartrantesDocument6 pagesNC004-Adoucissement Et Décarbonatation Des Eaux EntartrantesTCHIMOUNo ratings yet
- TP Mesure Du THDocument9 pagesTP Mesure Du THMohamed MohammediNo ratings yet
- Cours Chimie de Leau Ière Annaée ArchiDocument23 pagesCours Chimie de Leau Ière Annaée ArchihdNo ratings yet
- CHAP - 02 ACT - EXP Dosage ChlorureDocument3 pagesCHAP - 02 ACT - EXP Dosage ChlorureChikh Mourad0% (1)
- Dosage Des Ions Chlorures Par La Méthode deDocument4 pagesDosage Des Ions Chlorures Par La Méthode deKonan Richard KouassiNo ratings yet
- Section 2 Echange D'ions/ PR KHERRATDocument59 pagesSection 2 Echange D'ions/ PR KHERRATRochdi KherratNo ratings yet
- Tdn°1-Cae 2023Document1 pageTdn°1-Cae 2023Hamida100% (1)
- TP Indice PermanganateDocument3 pagesTP Indice Permanganateadilofive67% (6)
- Partie Théorique TP ChlorationDocument6 pagesPartie Théorique TP ChlorationYa CinNo ratings yet
- Calco CarboniqueDocument35 pagesCalco Carboniquebali123a100% (1)
- TP AdoucissementDocument6 pagesTP AdoucissementsoufyaneNo ratings yet
- TP Dosage O2 Dissous WinklerDocument6 pagesTP Dosage O2 Dissous WinklerMohamed Abd SamedNo ratings yet
- Traitement Des Eaux de Consommation Partie AsmaaDocument34 pagesTraitement Des Eaux de Consommation Partie Asmaaash600100% (1)
- Ta TacDocument4 pagesTa TacSalah-Eddine Saidi100% (1)
- Cours Partie N°2 Chimie Des Eaux (M1-GPE 2021-2022)Document15 pagesCours Partie N°2 Chimie Des Eaux (M1-GPE 2021-2022)Boudjaoui100% (1)
- Série N°4Document6 pagesSérie N°4Aliouat Roumaissa100% (2)
- Equilibre Calco-CarboniqueDocument38 pagesEquilibre Calco-CarboniqueAlphonsius WongNo ratings yet
- Fiche DBO5Document4 pagesFiche DBO5Amine HajjiNo ratings yet
- Travaux Pratiques: Traitements Des EauxDocument12 pagesTravaux Pratiques: Traitements Des EauxAbNo ratings yet
- Compte Rendu de Travaux Pratiques de Chimie de L-1Document18 pagesCompte Rendu de Travaux Pratiques de Chimie de L-1Hajar ouajidNo ratings yet
- Introduction Aux TP L1-1Document35 pagesIntroduction Aux TP L1-1mamadouNo ratings yet
- Chapitre II Cin - 351tique Formelle Desr - 351actions Irr - 351versibles2020Document9 pagesChapitre II Cin - 351tique Formelle Desr - 351actions Irr - 351versibles2020Æm InēNo ratings yet
- 07.dosages Acide BaseDocument6 pages07.dosages Acide BaseCedric BabokaNo ratings yet
- F-Thermochimie Et ÉlectrochimieDocument51 pagesF-Thermochimie Et Électrochimiefelix richardNo ratings yet
- Ch04 Dosage Par TitrageDocument2 pagesCh04 Dosage Par Titragesylvain zuchiattiNo ratings yet
- Dosages Acido Basique SM 3 TP2Document5 pagesDosages Acido Basique SM 3 TP2azertyiashmy1234No ratings yet
- TPCH1 TSdosageDocument2 pagesTPCH1 TSdosageجعدبندرهمNo ratings yet
- TP L3 Option Analyse 2017Document24 pagesTP L3 Option Analyse 2017Ouss AmaNo ratings yet
- Site TS C 02 Suivi Temporelle D'une Transfo ChimDocument8 pagesSite TS C 02 Suivi Temporelle D'une Transfo ChimPecorellaNo ratings yet
- Compte Rendu Ph-MètrieDocument8 pagesCompte Rendu Ph-MètrieIKRAM BOULAJOUL67% (3)
- Réaction AB Indicateur DosageDocument5 pagesRéaction AB Indicateur DosageSk CisseNo ratings yet
- Elements Guide Activites-Suppl IntroDocument10 pagesElements Guide Activites-Suppl IntrohihockNo ratings yet
- Terminale Controle7 BB Sujet2 CorrectionDocument23 pagesTerminale Controle7 BB Sujet2 Correctionm20263033No ratings yet
- Ex Chapitre 2Document8 pagesEx Chapitre 2الدعم الجامعيNo ratings yet
- Chimie D Chap14 Correction ExosDocument4 pagesChimie D Chap14 Correction ExosSOULA CHAHINAZNo ratings yet
- Commission Du Codex AlimentariusDocument13 pagesCommission Du Codex AlimentariuschokriNo ratings yet
- 2011 Liban Exo3 Sujet AciditeVin 4ptsDocument3 pages2011 Liban Exo3 Sujet AciditeVin 4ptsgrajzgrNo ratings yet
- Transformations Associées À Des Réactions Acido-Basiques, Analyse Des Courbes de Titrage Acide-Base PH-métrique Et ConductimétriqueDocument18 pagesTransformations Associées À Des Réactions Acido-Basiques, Analyse Des Courbes de Titrage Acide-Base PH-métrique Et ConductimétriqueAmal ElbaniNo ratings yet
- 2021 AmNord Sujet2 ExoB ConductiPython 5ptsDocument4 pages2021 AmNord Sujet2 ExoB ConductiPython 5ptsMariamaaxxxNo ratings yet
- Micro MDocument28 pagesMicro Ml3bsectionbNo ratings yet
- TD ElectrochimieDocument9 pagesTD Electrochimiepa75rin95No ratings yet
- TP 26 Chlore ActifDocument5 pagesTP 26 Chlore ActifEric CassagneNo ratings yet
- Nouveau Document Microsoft WordDocument21 pagesNouveau Document Microsoft WordHanane EdNo ratings yet
- Exercices Et Problèmes de ConcoursDocument12 pagesExercices Et Problèmes de ConcoursSa LimNo ratings yet
- EDTADocument5 pagesEDTAopppNo ratings yet
- Exercices Application Dosage Par Etalonnage Et Par TitrageDocument3 pagesExercices Application Dosage Par Etalonnage Et Par TitrageMohamed Ali MahjoubNo ratings yet
- Dosage Des Chlorure SDocument4 pagesDosage Des Chlorure SOmaima EttalouiNo ratings yet
- Rapport de Stage JeremyDocument14 pagesRapport de Stage JeremyJérémie Valentin valNo ratings yet
- Fascicule de TP de Chimie 1Document28 pagesFascicule de TP de Chimie 1Karim Kisserli100% (1)
- Ab-085 2 FRDocument8 pagesAb-085 2 FRhamid babacheikhNo ratings yet