Professional Documents
Culture Documents
Elligham 2
Uploaded by
cristiangggOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Elligham 2
Uploaded by
cristiangggCopyright:
Available Formats
Termodinmica 87
Juan Chamorro G.
REACCIONES QUE INVOLUCRAN FASES CONDENSADAS PURAS Y
FASES GASEOSAS
El criterio de equilibrio para reacciones en sistemas gaseosos fue analizado
precedentemente, la pregunta ahora es qu sucede cuando uno o ms de los reactivos o
productos de la reaccin se encuentra como fase condensada? La primera consideracin que
haremos es tomar a las fases condensadas como fases puras (son de composicin fija). Esto se
da en muchos sistemas prcticos, por ejemplo cuando se produce la reaccin de un metal puro
con elementos gaseosos para formar un xido puro, un sulfuro, un haluro, etc.
Las preguntas de inters incluyen:
-cul es la mxima presin de equilibrio que se puede tolerar en la atmsfera gaseosa sin que
se produzca la oxidacin de un metal determinado a una temperatura dada?
-a qu temperatura debe ser calentado un carbonato, en una atmsfera gaseosa con una
presin de dixido de carbono, para causar su descomposicin?
En estos sistemas el equilibrio completo involucra el establecimiento de (1) equilibrio de fases
entre las fases condensadas individuales y la fase gaseosa y (2) equilibrio de reaccin entre las
especies presentes en la fase gaseosa.
Como el equilibrio de fases se establece cuando las fases puras condensadas ejercen sus
presiones de vapor saturadas, las cuales tienen un nico valor cuando la temperatura del
sistema est fija, las nicas presiones que se pueden variar a temperatura constante son las de
las especies que se encuentran en estado gaseoso. El hecho que las presiones de vapor de las
fases condensadas puras slo varen con la temperatura y la energa libre de Gibbs de stas sea
prcticamente insensible a los cambios de presin simplifica el tratamiento termodinmico de
este tipo de sistemas.
EQUILIBRIO EN UN SISTEMA QUE CONTIENE FASES
CONDENSADAS Y FASES GASEOSAS
Consideremos el equilibrio en la reaccin entre un metal puro M, su xido puro MO y oxgeno
gaseoso, a la temperatura T y presin P.
M
(s)
+ O
2(g)
= MO
(s)
Consideramos que el O es insoluble en el metal y MO es estequiomtrico. M y MO existen
como especies en estado vapor en la fase gaseosa, de acuerdo al criterio de equilibrio:
M
G
(en la fase gaseosa) = G
M
(en la fase slida)
y
MO
G (en la fase gaseosa) = G
MO
(en la fase slida)
Termodinmica 88
Juan Chamorro G.
y por lo tanto el equilibrio de la reaccin
M
(g)
+ O
2(g)
= MO
(g)
podr establecerse en la fase gaseosa. El criterio para que esta reaccin ocurra en equilibrio a
la temperatura T es
2 / 1
O
M
MO
) g ( M
) g ( O
) g ( MO
2
2
p p
p
ln RT G G G
2
1
G = =
donde
G es la diferencia entre la energa libre de Gibbs de 1 mol de MO gaseoso a 1 atm de
presin y la suma de las energas libres de mol de oxgeno gaseoso a 1 atm de presin y 1
mol de M gaseoso a 1 atm de presin, todos a la temperatura T.
Como M y MO estn presentes en el sistema como fases slidas puras, el equilibrio de fase
requiere que p
MO
sea la presin de vapor en equilibrio del slido MO a la temperatura T y p
M
sea la presin de vapor en equilibrio del slido M a la temperatura T, por lo tanto esos valores
sern fijos a la temperatura T con lo cual el valor de p
O2
tambin quedar fijado para esa
temperatura.
El equilibrio de fases requiere que
M
G
(en la fase gaseosa) = G
M
(en la fase slida)
y
MO
G (en la fase gaseosa) = G
MO
(en la fase slida)
Estas ecuaciones pueden escribirse como:
G
M(g)
+ R T ln
pM(g)
= G
M(s)
+
=
=
) g ( M
p P
1 P
) s ( M
dP V
G
MO(g)
+ R T ln
pMO(g)
= G
MO(s)
+
=
=
) g ( M
p P
1 P
) s ( MO
dP V
La integral es el efecto en el valor de la energa libre molar del M a la temperatura T por un
cambio de presin entre P = 1 y P = P.
Consideremos por ejemplo Fe a 1000C, la presin de vapor es 6x10
-10
atm y por lo tanto RT
ln p
M(g)
= -224750 J. El volumen molar a 1000C es 7,34 cm
3
, el valor de la integral ser -0,74
J. Queda claro que G
Fe(g)
a 1000C es considerablemente mayor que G
Fe(s)
por lo cual la
integral puede despreciarse, de sta manera:
Termodinmica 89
Juan Chamorro G.
G
M(g)
+ R T ln
pM(g)
= G
M(s)
G
MO(g)
+ R T ln
pMO(g)
= G
MO(s)
Por lo que:
K ln RT
p
1
ln RT G G G G
2 / 1
O
) s ( M
) g ( O
2
1
) s ( MO
2
2
= = =
G : energa libre estndar de la reaccin
Por lo tanto en el caso de equilibrio en reacciones que involucran fases condensadas puras y
fases gaseosas, la constante de equilibrio puede ser expresada solamente en funcin de
aquellas especies que se encuentran en estado gaseoso. Como
G slo es funcin de la
temperatura, K tambin y por lo tanto a una T determinada el establecimiento del equilibrio se
da un nico valor de p
O
2
= p
O
2
(eq.,T).
A cualquier temperatura T, si la presin del sistema
cerrado es mayor que p
O
2
(eq.,T)
se producir la oxidacin espontnea del metal consumiendo O
y disminuyendo la presin (inverso tambin).
4 Cu
(s)
+ O
2(g)
= 2Cu
2
O
(s)
=
G -339000 14.2 T lnT + 247 T (J)
Entre 298 y 1356 K (T
mCu
)
3144 . 8 x 303 . 2
247
3144 . 8
T log 2 . 14
T 3144 . 8 x 303 . 2
339000
p log
) T , eq ( O
2
+ =
La variacin de p
O
2
(eq.,T)
con 1/T se aprecia en la figura
Termodinmica 90
Juan Chamorro G.
MO
(s)
+ H
2
O
(g)
= M(OH)
2(s)
) T , eq ( 2
O H
p ln RT K ln RT G = =
MO
(s)
+ CO
2(g)
= MCO
3(s)
) T , eq (
2
CO
p ln RT K ln RT G = =
MgO
(s)
+ CO
2(g)
= MgCO
3(s)
=
G -117600 + 170T (J)
Entre 298 y 1000 K
3144 . 8 x 303 . 2
170
T 3144 . 8 x 303 . 2
117600
p log
) T , eq ( CO
2
+ =
Termodinmica 91
Juan Chamorro G.
VARIACIN DE LA ENERGA LIBRE ESTNDAR CON LA
TEMPERATURA
+ = =
T
298
p
298
T
298
p
298
T
dT
T
c
T S T dT c H S T H G
c
p
es de la forma c
p
= a + bT + cT
-2
por lo tanto c
p
= a + b + cT
-2
la ecuacin de Kirchhoff es: =
|
|
.
|
\
|
T
H
c
p
= a + b + cT
-2
T
c
2
bT
aT H H
2
+ + =
donde H
o
es una constante de integracin
Para la reaccin la ecuacin de Gibbs-Helmholtz es
3 2
2
T
c
2
b
T
a
T
H
T
H
T
T
G
|
.
|
\
|
La integracin da:
2
T 2
c
2
bT
T ln a
T
H
I
T
G
+ =
T 2
c
2
bT
T ln aT H IT G
2
+ =
donde I es una constante de integracin
Como K ln RT G
= entonces,
) T 3144 . 8 x 2 (
c
3144 . 8 x 2
bT
3144 . 8
T ln a
3144 . 8
I
T 3144 . 8
H
K ln
2
=
El valor de I se puede determinar si se conoce K a cualquier temperatura.
4 Cu
(s)
+ O
2(g)
= 2Cu
2
O
(s)
Termodinmica 92
Juan Chamorro G.
298
H =-335000 (J)
298
S =-152.2 J/K
por lo tanto
298
G = -335000 + (298x152.2) = -289600 J
c
p,Cu(s)
= 22,6 +6,3x10
-3
T J/K entre 298 y 1356 K
c
p,Cu
2
O(s)
= 62,34 + 24x10
-3
T J/K entre 298 y 1200K
c
p,O
2
(g)
= 30 + 4,2x10
-3
T 1,7x10
5
T
-2
J/K entre 298 y 3000K
en el rango 298-1200K
c
p
= 2c
p,Cu
2
O(s)
- 4c
p,Cu(s)
- c
p,O
2
(g) =
4,28 + 18,6x10
-3
T + 1,7x10
5
T
-2
J/K
T
H =
H + 4,28 T + 9,3x10
-3
T
2
- 1,7x10
5
T
-1
J
Como
298
H =-335000 (J) substituyendo H
o
= -336500 J
T
H = -336500 + 4,28 T + 9,3x10
-3
T
2
- 1,7x10
5
T
-1
J
Dividiendo por T
2
, integrando respecto a T y multiplicando por T tenemos:
IT T 10 x 85 , 0 T 10 x 3 , 9 T ln T 28 , 4 336500 G
1 5 2 3
+ =
J
Como
298
G = -289600 J substituyendo I = 185,5 y por lo tanto
T T x T x T T G 5 , 185 10 85 , 0 10 3 , 9 ln 28 , 4 336500
1 5 2 3
+ =
J
-lnK=lnp
O
2
(eq,T)
=
3144 , 8
5 , 185
3144 , 8
10 85 , 0
3144 , 8
10 3 , 9
3144 , 8
ln 28 , 4
3144 , 8
336500
3
5 3
+
xT
x T x T
T
La variacin de
T
G calculada experimentalmente ajusta para esta reaccin a una ecuacin
del tipo T T T G 246 ln 28 , 14 338000 + = J, que puede aproximarse a una forma lineal
T G 126 333000 + = J
Termodinmica 93
Juan Chamorro G.
DIAGRAMAS DE ELLINGHAM
Ellingham grafic las relaciones G -T determinadas experimentalmente para la oxidacin y
sulfuracin de una serie de metales y encontr que estas en forma general se aproximaban a
rectas en un rango de temperaturas en el cual no se producan cambios de estado. La relacin
puede expresarse por medio de una ecuacin simple como:
BT A G + = con A= H y B= - S
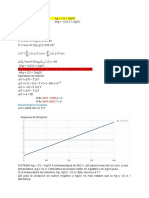
La figura es el diagrama de Ellingham para la reaccin de oxidacin
4 Ag
(s)
+ O
2(g)
= 2Ag
2
O
(s)
y en ella H es la interseccin de la lnea con el eje T=0 y S es la pendiente de la lnea
cambiada de signo. Como S es una cantidad negativa la lnea tiene pendiente positiva. A la
temperatura de 462K el G de la reaccin es cero, o sea que a esa temperatura Ag slida pura
y oxgeno gas a 1 atm estn en equilibrio xido de Ag puro y pO2(eq,T)=1.
A T
1
el G para la reaccin es (-) y el xido es ms estable, a T
2
el G para la oxidacin es
(+) y por lo tanto son ms estables la Ag y el oxgeno.
Para la reaccin de oxidacin A
(s)
+ O
2(g)
= AO
2
(s)
S = S
AO
2
(s)
S
O
2
(g)
S
A(s)
y generalmente en el rango de temperatura en el cual A y AO
2
son slidos, S
O
2
es
considerablemente mayor que los otros dos, por lo tanto
Termodinmica 94
Juan Chamorro G.
S = S
O
2
(g)
Esto indica que los cambios en la entropa estndar para reacciones de oxidacin que
involucran fases slidas son similares y como las pendientes de los diagramas de Ellingham
son -S las lneas son ms o menos paralelas unas a otras. G a cualquier temperatura es la
suma de las contribuciones de la entalpa H ( la cual si c
p
= 0 es independiente de la
temperatura) y de la entropa -TS (la cual si c
p
= 0 es linealmente dependiente de la
temperatura. Las dos contribuciones se grafican en la figura:
Para la oxidacin del Co: G = -467800 + 143,7 T (J) (298-1763K)
Para la oxidacin del Mn: G = -769400 + 145,6 T (J) (298-1500K)
Los valores de S son prcticamente iguales, por lo tanto las estabilidades relativas de los
xidos dependern de los valores de H, mientras ms negativos sean estos valores ms
estables sern los xidos.
Como
) ., (
2
ln
ln
T eq O
p
R
S
RT
H
K =
=
luego
) ., (
2
T eq O
p = exp (H/RT) exp (-S/R) = cte.x exp (H/RT)
esto indica que
) ., (
2
T eq O
p aumenta exponencialmente con la temperatura y decrece a medida
que H se hace ms negativa.
Termodinmica 95
Juan Chamorro G.
Consideremos dos reacciones de oxidacin:
2X + O
2
= 2XO (1) y Y + O
2
= YO
2
(2)
En la figura se puede apreciar que H (2) es ms negativa que H (1) y que S (2) es ms
negativa que S (1).
Restando las dos reacciones tenemos:
Y + 2XO = 2X + YO
2
reaccin para la cual la variacin de G con T se muestra en la figura
Por debajo de T
E
X y YO
2
son estables con respecto a Y y XO y por encima de T
E
es a la
inversa.
Las unidades de G deben ser energa por mol de oxgeno.
A fin de evitar el clculo de los valores de
) ., (
2
T eq O
p para cualquier reaccin de oxidacin,
Richardson aadi otra escala a los diagramas de Ellingham.
A cualquier temperatura la variacin en energa libre estndar est dada por:
Termodinmica 96
Juan Chamorro G.
) ., (
2
ln
T eq O
p RT G =
pero
G = G + RT ln P
por lo tanto G puede ser vista como el descenso en la energa libre de un mol de oxgeno(g)
cuando su presin decrece de 1 atm a
) ., (
2
T eq O
p atm a la temperatura T. Para una disminucin
de presin de un mol de un gas ideal G es una funcin lineal de la temperatura y la pendiente
de la recta es R ln P, por lo tanto G se volver ms negativo con la temperatura si P<1 y ms
positivo si P>1. Todas las lneas partiran de G= 0 y T= 0.
Termodinmica 97
Juan Chamorro G.
A T
1
G = ab la disminucin en energa libre a T
1
cuando p
O
2
disminuye de 1 a 10
-20
y por lo
tanto
) ., (
1 2
T eq O
p = 10
-20
A T
3
G = 0 que corresponde a cuando no hay cambio en la presin, por lo tanto
) ., (
3 2
T eq O
p = 1
2X + O
2
= 2XO (1) y Y + O
2
= YO
2
(2)
Termodinmica 98
Juan Chamorro G.
A cualquier temperatura menor que T
E
(T
1
) por ejemplo
) T , 2 . reac ., eq ( O
1 2
p <
) T , 1 . reac ., eq ( O
1 2
p
ambos metales en un sistema cerrado en una atmfera de O a 1 atm de presin se oxidarn
espontneamente.
Como resultado del consumo de O la presin disminuir. Cuando la presin parcial de oxgeno
alcance el valor
) , 1 . ., (
1 2
T reac eq O
p la oxidacin de X cesar, sin embargo, la oxidacin de Y
continuar hasta que la
2
O
p tenga un valor menor que
) , 1 . ., (
1 2
T reac eq O
p , entonces XO se vuelve
inestable y se descompone. Cuando se alcanza el equilibrio completo, el estado del sistema a
T1 es X+YO
2
+O
2
a
) , 2 . ., (
1 2
T reac eq O
p .
EFECTO DE LA TRANSFORMACIN DE FASES
En el rango de temperatura en el cual no ocurren cambios de fases en ninguno de los
reactantes o productos, la relacin G - T para la reaccin se puede representar
aproximadamente por una lnea recta. Sin embargo, cuando la entalpa de una fase de alta
temperatura excede la de la fase de baja temperatura en una cantidad igual al calor latente del
cambio de fase y similar para la entropa que difieren en la entropa de cambio de fase, la lnea
de Ellingham presenta una inflexin.
Consideremos la reaccin
X
(s)
+ O
2(g)
= XO
2(s)
para la cual el cambio en entalpa estndar es H y el cambio en entropa estndar es S.
A la temperatura de fusin de X, T
m,x
, la reaccin
X
(s)
= X
(l)
ocurre y el cambio en entalpa estndar (calor latente de fusin) es H
m,x
y el correspondiente
cambio en entropa es S
m,x
=H
m,x
/ T
m,x.
Por lo tanto para la reaccin
X
(l)
+ O
2(g)
= XO
2(s)
el cambio en entalpa estndar es H-H
m,x
y el cambio en entropa estndar es S-S
m,x
.
Como H
m,x
y S
m,x
son siempre valores positivos (fusin proceso endotrmico), H-
H
m,x
es una cantidad negativa ms grande que H y lo mismo ocurre para S-S
m,x
que es
una cantidad negativa mayor que S. Entonces la lnea de Ellingham para la oxidacin de X
lquida a XO
2
slido tiene mayor pendiente que la correspondiente a la oxidacin de X slido
Termodinmica 99
Juan Chamorro G.
y a T
m,x
la lnea presenta una inflexin hacia arriba. No hay discontinuidad ya que a T
m,x
G
x(s)
= G
x(l)
. Si T
m,xO
2
es menor que T
m,x
, a T
m,xO
2
la reaccin
XO
2(s)
= XO
2(l)
ocurre y los cambios en la entalpa y entropa estndar son H
m,xO
2
y
S
m,xO
2
respectivamente.
Por lo tanto para la reaccin
X
(s)
+ O
2(g)
= XO
2(l)
el cambio en entalpa estndar es H-H
m,XO
2
y el cambio en entropa estndar es S-
S
m,XO
2
, ambos son valores menos negativos que H y S. En ese caso la lnea
correspondiente a la oxidacin del metal slido para dar un xido lquido tiene menos
pendiente y la lnea tiene una inflexin hacia abajo.
La siguiente figura muestra la forma de las lneas de Ellingham
(a) T
m,x
, < T
m,xO
2
y (b)
T
m,x
, > T
m,xO
2
Termodinmica 100
Juan Chamorro G.
El Cu es un metal que funde a menor temperatura que su xido de menor punto de fusin
Cu
2
O. Mediciones de presiones de oxgeno en equilibrio con Cu
(s)
y Cu
2
O
(s)
en el rango de
temperaturas de estabilidad del Cu
(s)
, y en equilibrio con Cu
(l)
y Cu
2
O
(s)
en el rango de
estabilidad de Cu
(l)
da
G = -338900-14,2T lnT+247T (J) (1)
para 4Cu
(s)
+ O
2(g)
= 2Cu
2
O
(s)
en el rango 298 T
m,Cu
G = -390800-14,2T lnT+285,3T (J) (2)
para 4Cu
(l)
+ O
2(g)
= 2Cu
2
O
(s)
en el rango T
m,Cu
1503K
Esas dos lneas se intersectan a 1356K que es T
m,Cu
Termodinmica 101
Juan Chamorro G.
G
(1)
- G
(2)
da G= 51900 - 38,3 T (J)
para 4 Cu
(s)
= 4 Cu
(l)
para la fusin de un mol de Cu
G
m,Cu
= 12970 9,58T (J)
H
m,Cu
= 12970 (J)
S
m,Cu
= 9,58T (J/K)
Por lo tanto a T
m,Cu
el diagrama de Ellingham para la oxidacin del Cu incrementa su
pendiente en 9,58 J/K.
El FeCl
2
ebulle a menor temperatura que la de fusin de Fe, el diagrama de Ellingham para la
cloracin de Fe muestra una inflexin hacia abajo a la temperatura de fusin del FeCl
2
y a la
temperatura de ebullicin de FeCl
2
.
Fe
(s)
+ Cl
2(g)
= FeCl
2(s)
(1) G = -346300 12,68T lnT + 212,9T (J) entre 298 y T
m, FeCl
2
Fe
(s)
+ Cl
2(g)
= FeCl
2(l)
(2) G = -286400 + 63,68T (J) entre T
m, FeCl
2
y
T
b, FeCl
2
Fe
(s)
+ Cl
2(g)
= FeCl
2(g)
(3) G = -105600 41,8T lnT - 375,1T (J) entre T
b, FeCl
2
y
T
m, Fe
Las lneas (1), (2) y (3) se muestran en la figura
Termodinmica 102
Juan Chamorro G.
T
m, FeCl
2
= 969K y
T
b, FeCl
2
= 1298K
Para FeCl
2(s)
FeCl
2(l)
G
(2)
- G
(1)
= G
m,FeCl
2
= 59900+12,68TlnT-149T
Por lo tanto
T
T
T
G
T H
FeCl m
FeCl m
68 , 12 59900
2
2
,
2
,
=
|
|
.
|
\
|
=
la cual a 969K da J H
FeCl m
47610
2
,
=
T
G
S
FeCl m
FeCl m
=
2
2
,
,
= -12,68 lnT-12,68+149 J/K = 49,13 J/K a 969K
2
2
2
,
,
,
FeCl m
FeCl m
FeCl m
T
H
S
= = 49,13 J/K
Por lo tanto el cambio en pendiente entre las lneas (1) y (2) a 969K es 49,13 J/K, el mismo
clculo se puede realizar para G
(3)
- G
(2)
Termodinmica 103
Juan Chamorro G.
OXIDOS DE CARBONO
Existen dos formas gaseosas de xidos de carbono:
C
(gr)
+O
2(g)
= CO
2(g)
(1) G(1)=-394100-0,84T
2C
(gr)
+O
2(g)
= 2CO
(g)
(2) G(2)=-223400-175,3T
Combinando (1) y (2)
2CO
(g)
+O
2(g)
= 2CO
2(g)
(3) G(3)=-564800+173,62T
La lnea para la reaccin (3) tiene pendiente positiva (2 moles de gas se producen a partir de 3
moles de gas, S(3)=-173,62 J/K
La lnea para la reaccin (1) tiene pendiente virtualmente cero (1 moles de gas se producen a
partir de 1 mol de gas, S(3)=0,84 J/K
La lnea para la reaccin (2) tiene pendiente negativa (2 moles de gas se producen a partir de 1
mol de gas, S(2)=175,3 J/K
Consideremos el equilibrio
C
(gr)
+CO
2(g)
= 2CO
(g)
(4) G(4)=G(2) - G(1)=170700-174,5T
G(4) = 0 a T=705C, temperatura a la cual las lneas de Ellingham para las reacciones (1)
y(2) se intersectan. A esa temperatura CO y CO
2
en sus estados estndar (por ejemplo 1 atm
de presin) estn en equilibrio con C slido y la presin total del sistema es 2 atm. Como las
reacciones en equilibrio generalmente consideran sistemas a 1 atm de presin, es importante
calcular la temperatura a la cual CO y CO
2
, cada uno a 0,5 atm, estn en equilibrio con C
slido
C
(gr)
+O
2(g)
= CO
2(g)
(1) G(1)=-394100-0,84T
Si la presin de CO
2
decrece de 1 atm a 0,5 atm
CO
2
(T, P=1) = CO
2
(T, P=0,5) (5) G(5)=RT ln0,5
C
(gr)
+O
2(g, P=1)
= CO
2(g, P=0,5)
(6)
G(6)=G(1) + G(5) = -394100-0,84T+RTln0,5
Esta lnea se obtiene rotando la lnea para la reaccin (1) alrededor de su punto de interseccin
con T= 0 en el sentido de las agujas del reloj hasta que a la temperatura T la separacin
vertical entre las lneas (1) y (6) sea RTln0,5.
Lo mismo debe hacerse para la reaccin
2C
(gr)
+O
2(g, P=1)
= 2CO
(g, P=0,5)
(7)
Termodinmica 104
Juan Chamorro G.
Combinando las reacciones (6) y (7)
C
(gr)
+CO
2(g, P=0,5)
= 2CO
(g, P=0,5)
(8)
G(8)=G(4) + RT ln0,5
Como CO
2
y CO cada uno a 0,5 atm estn en equilibrio con C slido a esa temperatura G(8)
= 0 y por lo tanto la temperatura ser la de la interseccin de las lneas (6) y (7) (punto c).
La siguiente figura indica que por debajo de 400C el gas en equilibrio es virtualmente CO
2(g,
P=1)
y por encima de 1000C el gas en equilibrio es CO
(g, P=1)
(puntos a y e respectivamente )
Termodinmica 105
Juan Chamorro G.
EQUILIBRIO 2CO + O
2
= 2CO
2
A cualquier temperatura T la mezcla CO / CO
2
en equilibrio con C ejerce una presin de O en
equilibrio por medio de la reaccin
2CO + O
2
= 2CO
2
para la cual G(3)= -564800 + 173,62T = -RT ln
|
|
|
.
|
\
|
2
2
O
2
CO
2
CO
p p
p
= 2RT ln
) eq ( O
conC . eq
CO
CO
2
2
p ln RT
p
p
+
|
|
|
.
|
\
|
conC . eq
CO
CO
) T , eq ( O
p
p
ln 2
3144 . 8
62 , 173
T 3144 . 8
564800
p ln
2
2
|
|
|
.
|
\
|
+ + =
Ejercicio: Una mezcla de Fe
2
O
3
y Al se encuentran presentes en una razn molar de 1:2
dentro de un recipiente adiabtico que contiene algo de Fe a 25C. Si se produce la reaccin
qumica exotrmica Fe
2
O
3
+ 2 Al = Al
2
O
3
+ 2 Fe, hasta que se completa totalmente,
calcule la razn molar de Fe y Fe
2
O
3
que exista inicialmente para que despus de ocurrida la
reaccin solo existan Fe (l) y Al
2
O
3 (s)
a 1600 C.
) ( 298
3 2
O Fe
H = -196300 cal/mol
) ( 298
3 2
O Al
H = -400000 cal/mol
Termodinmica 106
Juan Chamorro G.
C
p ( Al
2
O
3
)
= 25,48 + 4,25 10
-3
T - 6,82 10
5
T
-2
( cal/mol) (298 1873)
C
p
) ( Fe
=
4,18 + 5,92 10
-3
T (cal/mol) (273 1033 K)
C
p
) ( Fe
=
9,0 (cal/mol) (1033 1181)
C
p
) ( Fe
=
1,84 + 4,66 10
-3
T (cal/mol) (1181 - 1674)
C
p
) ( Fe
=
10,5 (cal/mol) (1674 - 1808)
C
p
) ( Liquido Fe
=
10,0 (cal/mol) (1808 - 1873)
Fe
H = 1200 (cal/mol) T
Transferencia
= 1033 K
Fe
H = 220 (cal/mol) T
Transferencia
= 1181 K
Fe
H = 210 (cal/mol) T
Transferencia
= 1674 K
l Fe
H
= 3300 (cal/mol) T
Transferencia
= 1808 K
I ) Fe
2
O
3
+ 2 Al 2 Fe + Al
2
O
3
a 298 K
II) ( n + 2) Fe + Al
2
O
3
( 298 1873 )
Termodinmica 107
Juan Chamorro G.
Termodinmica 108
Juan Chamorro G.
Capacidad calrica molar a presin constante cp (cal/mol K)
Cp = a + bT + cT
- 2
cal/molK
Sustancia a = b x 10
3
= c x 10
-5
= Rango (K)
Al
(s)
4,94 2,96 298 - 932
Al
(l)
7,0 932 - 1273
Al
2
O
3
(s)
25,48 4,25 -6,82 298 - 1800
Au
(s)
5,66 1,24 298 - T
m
Bi
(s)
4,49 5,4 298 - T
m
Bi
(l)
4,78 1,47 5,05 T
m
-
820
C
(diamante)
2,18 3,16 -1,48 298 - 1200
C
(grafito)
4,10 1,02 -2,10 298 - 2300
Co
()
5,11 3,42 -0,21 298 - 650
Co
()
3,30 5,86 715 - 1400
Co
()
9,6 1400 - T
m
CoO
(s)
11,54 2,04 0,4 298 - 1800
Cr
(s)
5,84 2,36 -0,88 298 - T
m
Cr
2
O
3
(s)
28,53 2,2 -3,74 350 - 1800
H
2 (g)
6,52 0,78 0,12 298 - 3000
Mn
()
5,16 3,81 298 - 993
Mn
()
8,33 0,66 993 - 1373
Mn
()
10,7 1373 - 1409
Mn
()
11,3 1409 - 1517
Mn
(l)
11,0 1517 - T
b
MnO
(s)
11,11 1,94 -0,88 298 - 1800
Ni
()
7,8 -0,47 -1,335 298 - 630
Ni
()
7,10 1,00 -2,23 630 - T
m
NiO
()
-4,99 37,58 3,89 298 - 525
O
2 (g)
7,16 1,00 -0,4 298 - 3000
Pb
(s)
5,63 2,33 298 - 600
Pb
(l)
7,75 -0,74 600 - 1200
PbO
(s)
9,05 6,40 298 - 1000
Termodinmica 109
Juan Chamorro G.
Capacidad calrica molar a presin constante Cp (J/mol K)
Cp = a + bT + cT
-2
J/molK
Especie a = b x 10
3
= c x 10
-5
= Rango (K) observaciones
Ag
(s)
21,30 8,54 1,51 298 - 1234 (T
m
) +20,7510
-6
T
2
Ag(l) 30,50 1234 - 1600
Al
(s)
31,38 -16,4 -3,60 298 934 (T
m
)
Al
(l)
31,76 934 - 1600
Al
2
O
3
(s)
117,49 10,38 -37,11 298 2325 (T
m
)
Ba
()
-473,2 1587,0 128,2 298 - 648
Ba
()
0,67 -975,7 -710,0 648
1003 -428,410
-6
T
2
BaO
(s)
50,29 7,20 -4,60 298 2286 (T
m
)
BaTiO
3 (s)
121,46 8,54 -19,16 298 - 1800
C
(diamante)
9,12 13,22 -6,19 298 - 1200
C
(grafito)
0,11 38,94 -1,48 298 - 1100 -17,3810
-6
T
2
C
(grafito)
24,43 0,44 -31,63 1100 4000
CO 28,41 4,1 -0,46 298 -2500
CO
2
44,14 9,04 -8,54 298 -2500
Ca
()
16,02 21,51 2,55 298 - 716
Ca
()
-0,45 41,35 716 - 1115
CaO
(s)
50,42 4,18 -8,49 298 1177
CaTiO
3
127,49 5,69 -27,99 298 - 1530
Cr
(s)
21,76 8,98 -0,96 298 2130 (T
m
) +2,2610
-6
T
2
Cr
2
O
3
(s)
119,37 9,30 -15,65 298 1800
Cu
(s)
30,29 -10,71 -3,22 298 1356 (T
m
) +9,4710
-6
T
2
Fe
()
17,5 24,8 298 1187
Fe
()
7,70 19,5 1187 1664
Fe
()
43,9 1664 1809
Fe
(l)
41,84 1809 1873
H
2
O
(g)
30,0 10,71 0,33 298 2500
O
2 (g)
29,96 4,18 -1,67 298 3000
2MgO.2l
2
O
3
.5SiO
2
626,34 91,21 -200,83 298 1738 (T
m
)
N
2
27,87 4,27 298 2500
Si
3
N
4
76,36 109,04 -6,53 298 900 -27,0710
-6
T
2
SiO
2 (-cuarzo)
43,93 38,83 -9,69 298 847
Ti
(s)
24,94 6,57 -1,63 298 1155 +1,3410
-6
T
2
TiO
2 (Rutilo)
73,35 3,05 -17,03 298 1800
Zr
()
22,84 8,95 -0,67 298 1136
Zr
()
21,51 6,57 36,69 1136 2128
ZrO
2 ()
69,62 7,53 -14,06 298 - 1478
ZrO
2 ()
74,48 1478 2950 (T
m
)
Termodinmica 110
Juan Chamorro G.
Calor molar de formacin estndar H
298 K
(Joules) y Entropa S (J/K)
CaO.Al
3
O
3
.2SiO
2
-4223700 202,5
2CaO.Al
2
O
3
.SiO
2
-3989400 198,3
Cr
2
O
3
-1134700 81,2
H
2
O -241800 232,9
N
2
191,5
O
2
205,1
SiO
2
(-cuarzo)
-910900 41,5
Si
3
N
4
-744800 113,0
Ti 30,7
TiO -543000 34,7
Ti
2
O
3
-1521000 77,2
Ti
3
O
5
-2459000 129,4
TiO
2
-944000 50,6
Zr 39,0
ZrO
2
-1100800 50,4
Sustancia H
298 K
J S J/K
Al
2
O
3
-1675700 50,9
Ba 62,4
BaO -548100 72,1
BaTiO
3
-164700 107,9
C (grafito) 5,7
C (diamante) 1500 2,4
CH
4
-74800 186,3
CO -110500 197,5
CO
2
-393500 213,7
Ca 41,6
CaO -634900 38,1
CaTiO
3
-1660600 93,7
3CaO.Al
2
O
3
.3SiO
2
-6646300 241,4
CaO.Al
2
O
3
. SiO
2
-3293200 144,8
Termodinmica 111
Juan Chamorro G.
Calor molar de formacin standard H
298 K
(caloras) y Entropa S (cal/ K)
Cr
2
O
3
-270000 19,4
MnO -92000 14,13
Ni 0 7,12
NiO -57500 9,1
O
2
0 49,0
Pb 0 15,5
PbO -52400 16,1
Si 0 4,5
SiO
2 (cuarzo)
-217700 9,91
*de 2CaO + SiO
2
Sustancia H
298 K
caloras S cal/K
Ca 0 9,95
CaO -151600 9,5
Ca
2
SiO
4
-30200* 30,5
Co 0 7,18
CoO. -57100 12,65
Termodinmica 112
Juan Chamorro G.
Calor molar de transformacin H
Transf.
(Joules) y T de Fusin (K)
Sustancia Transformacin H
transf.
J T
m
K
Ag S L 11090 1234
Al S L 10700 934
Al
2
O
3
S L 107500 2324
Au S L 12600 1338
Ba 630 648
Ba L 7650 1003
Cu S L 12970 1356
Ca 900 716
CaF
2
S L 31200 1691
Fe 670 1187
Fe 840 1664
Fe L 13770 1809
H
2
O S L 6008 273
K
2
O.B
2
O
3
S L 62800 1220
MgF
2
S L 58160 1563
Na
2
O.B
2
O
3
S L 67000 1240
Pb S L 4810 600
PbO S L 27840 1158
Si S L 50200 1685
V S L 22840 2193
Zr 3900 1136
ZrO
2
5900 1478
Termodinmica 113
Juan Chamorro G.
Calor de transformacin H
Transformacin
(caloras) y T de Fusin (K)
Elemento Transformacin H
transf.
caloras T
m
K
Al S L 2500 932
Bi S L 2600 544
Cr S L 5000 2173
I
2
S L 3770 387
Mn 480 993
Mn 550 1373
Mn 430 1409
Mn L 3200 1517
Pb S L 1150 600
Ti S L 4500 1940
V S L 4200 2188
Presiones saturadas de vapor de varias sustancias (mm-Hg)
D CT T B
T
A
Hg mm P + + + = log ) ( log
10
Sustancia A = B = Cx10
3
= D = Rango K
Ag
(s)
14900 - 0,85 12,20 298 - T
m
Ag
(l)
14400 - 0,85 11,70 T
m
- T
b
Au
(s)
19820 - 0,306 - 0,16 10,81 298 - T
m
Cu
(s)
17770 - 0,86 12,29 298 - T
m
Hg
(l)
3305 - 0,795 10,355 298 - T
b
I
2(s)
3578 - 2,51 17,715 298 - T
m
I
2(l)
3205 - 5,18 23,65 T
m
- T
b
Zn
(s)
6850 - 0,755 11,24 273 - T
m
Zn
(l)
6620 - 1,255 12,34 693 - 1180
Presiones saturadas de vapor de varias sustancias (atm)
C T B
T
A
atm P + + = ln ) ( ln
Sustancia A B C Rango K
CaF
2()
54350 - 4,525 56,27 298 - 1430
CaF
2()
53780 - 4,525 56,08 1430 - 1691 (T
m
)
CaF
2(l)
50200 - 4,525 53,96 1691 - 2783 (T
m
)
Fe
(l)
45390 - 1,27 23,93 1809 (T
m
) - 3330 (T
b
)
Hg
(l)
7611 - 0,795 17,168 298 - 630 (T
b
)
Mn
(l)
33440 - 3,02 37,68 1517 (T
m
) - 2348 (T
b
)
SiCl
4(l)
3620 10,96 273 - 333 (T
b
)
Zn
(l)
15520 - 1,255 21,79 693 (T
m
) - 1177 (T
b
)
Termodinmica 114
Juan Chamorro G.
Cambios de energa libre estndar de Gibbs G para varias reacciones
Reaccin G Joules Rango K
2Ag
(s)
+ O
2(g)
= Ag
2
O
(s)
- 30540 + 66,11 T 298 - 463
Al
(l)
= [Al]
(1 %peso en Fe)
- 43100 32,26 T
2Al
(l)
+ 1,5O
2(g)
= Al
2
O
3(s)
- 1687200 + 326,8 T 993 - 2327
C
(s)
+ O
2(g)
= CO
(g)
- 111700 - 87,65 T 298 - 2000
C
(s)
+ O
2(g)
= CO
2(g)
- 394100 - 0,84 T 298 - 2000
C
(s)
+ O
2(g)
+ S
(g)
= COS
(g)
- 202800 - 9,96 T 773 - 2000
C
grafito
+ 2H
2(g)
= CH
4(g)
- 91040 + 110,7 T 773 - 2000
C
grafito
= [C]
(1 %peso en Fe)
22600 - 42,26 T
CaO(s) + CO
2
= CaCO
3(s)
- 161300 + 137,2 T 449 -1150
2CaO
(s)
+ SiO
2(s)
= 2CaO.SiO
2(s)
- 118800 - 11,30 T 298 - 2400
CoO
(s)
+ SO
3(g)
= CoSO
4(s)
- 227860 + 165,3 T 298 -1230
2Cr
(s)
+ 1,5O
2(g)
= Cr
2
O
3(s)
- 1110100 + 247,3 T 298 - 1793
2Cu
(s)
+ O
2(g)
= Cu
2
O
(s)
- 162200 + 69,24 T 298 -1356
2Cu
(l)
+ O
2(g)
= Cu
2
O
(s)
-188300 + 88,48 T 1356 - 1509
2Cu
(s)
+ S
2(g)
= Cu
2
S
(s)
- 131800 + 30,79 T 708 -1356
3Fe
()
+ C
grafito
= Fe
3
C
(s)
29040 - 28,03 T 298 -1000
3Fe
()
+ C
grafito
= Fe
3
C
(s)
11234 - 11,0 T 1000 - 1137
Fe
(s)
+ O
2(g)
= FeO
(s)
- 263700 + 64,35 T 298 - 1644
Fe
(l)
+ O
2(g)
= FeO
(l)
- 256000 + 53,68 T 1808 - 2000
3Fe
(s)
+ 2O
2(g)
= Fe
3
O
4(s)
- 1102200 + 307,4 T 298 - 1808
Fe
(s)
+ S
2(g)
= FeS
(s)
-150200 + 52,55 T 412 - 1179
H
2(g)
+ Cl
2(g)
= 2HCl
(g)
- 188200 -12,80 T 298 - 2000
H
2(g)
+ I
2(g)
= 2Hl
(g)
- 8370 - 17,65 T 298 - 2000
H
2(g)
+ O
2(g)
= H
2
O
(g)
- 247500 + 55,85 T 298 - 2000
Hg
(v)
+ O
2(g)
= HgO
(s)
- 152200 + 207,2 T
Li
(g)
+ Br
2(g)
= LiBr
(g)
- 333900 + 42,09 T 1289 - 2000
Mg
(l)
+ Cl
2(g)
= MgCl
2(l)
- 603200 + 121,43 T 987 -1368
Mg
(g)
+ O
2(g)
= MgO
(s)
- 729600 + 204 T 1363 - 2200
2MgO
(s)
+ SiO
2(s)
= Mg
2
SiO
4(s)
- 67200 + 4,31 T 298 -2171
MgO
(s)
+ Al
2
O
3(s)
= MgO.Al
2
O
3(s)
- 35560 - 2,09 T 298 - 1698
Mn
(s)
+ O
2(g)
= MnO
(s)
- 388900 + 76,32 T 298 - 1517
N
2(g)
+ 3H
2(g)
= 2NH
3(g)
- 87030 + 25,8 T ln T + 31,7 T 298 - 2000
2Ni
(s)
+ O
2(g)
= 2NiO
(s)
- 471200 + 172 T 298 - 1726
2Ni
(l)
+ O
2(g)
= 2NiO
(s)
- 506180 + 192,2 T 1726 - 2200
O
2(g)
= [O]
(1 %peso en Fe)
- 111070 - 5,87 T
Pb
(l)
+ O
2(g)
= PbO
(s)
- 208700 + 91,75 T 600 - 1158
Pb
(l)
+ O
2(g)
= PbO
(l)
- 181200 + 68,03 T 1158 - 1808
Pb
(l)
+ S
2(g)
= PbS
(s)
- 163200 + 88,03 T 600 - 1386
PbO
(s)
+ SO
2(g)
= PbSO
4
- 401200 + 261,5 T 298 - 1158
PCl
3(g)
+ Cl
2(g)
= PCl
5(g)
- 95600 7,94 T ln T + 235,2 T 298 - 1000
S
2(g)
+ O
2(g)
= SO
2(g)
- 361700 + 76,68 T 718 - 2000
Si
(s)
+ O
2(g)
= SiO
2(s)
- 907100 + 175 T 298 - 1685
3Si
(s)
+ 2N
2(g)
= Si
3
N
4(s)
-723800 + 315,1 T 298 - 1685
Sn
(l)
+ Cl
2(g)
= SnCl
2(l)
- 333000 + 118,4 T 520 - 925
SO
2(g)
+ O
2(g)
= SO
3(g)
- 94600 + 89,37 T 298 - 2000
U
(l)
+ C
grafito
= UC
(s)
- 102900 + 5,02 T 1408 - 2500
2U
(l)
+ 3C
grafito
= U
2
C
3(s)
- 236800 + 25,1 T 1408 - 2500
U
(l)
+ 2C
grafito
= UC
2(s)
- 115900 + 10,9 T 1408 - 2500
V
(s)
+ O
2(g)
= VO
(g)
- 424700 + 80,04 T 298 - 2000
Zn
(v)
+ O
2(g)
= ZnO
(s)
- 460200 + 198 T 1243 - 1973
Termodinmica 115
Juan Chamorro G.
Cambios de energa libre estndar de Gibbs G para varias reacciones
Reaccin G caloras Rango K
2l
(l)
+ 3/2 O
2(g)
= Al
2
O
3(s)
- 400700 + 76,6 T 923 - 1800
23/6 Cr
(s)
+ C
(s)
= 1/6 Cr
23
C
6(s)
-16380 -1,54 T 298 - 1673
2Cr
(s)
+ 3/2 O
2(g)
= Cr
2
O
3(s)
-267750 + 62,1 T 298 - 2100
C
(s)
+ 2H
2(g)
= CH
4(g)
- 16520+ 12,25 T log T - 15,62 T 298 - 1200
C
(s)
+ O
2(g)
= CO
(g)
- 26700 - 20,95 T 298 - 2500
C
(s)
+ O
2(g)
= CO
2(g)
- 94200 - 0,2 T 298 - 2000
CaO(s) + CO
2
= CaCO
3(s)
- 140250 + 34,4 T 449 -1500
2Cu
(s)
+ O
2(g)
= Cu
2
O
(s)
- 40500 + 3,92 T log T + 29,5 T 298 -1356
2Cu
(l)
+ O
2(g)
= Cu
2
O
(s)
- 46700 + 3,92 T log T + 34,1 T 1356 - 1503
2Cu
(s)
+ S
2(g)
= Cu
2
S
(s)
- 34150 + 6,22 T log T + 28,74 T 623 -1360
Fe
(s)
+ O
2(g)
= FeO
(s)
- 62050 + 14,95 T 298 - 1642
Fe
(l)
+ O
2(g)
= FeO
(l)
- 55620 + 10,83 T 1808 - 2000
H
2(g)
+ O
2(g)
= H
2
O
(g)
- 58900 + 13,1 T 298 - 2500
H
2(g)
+ Cl
2(g)
= 2HCl
(g)
- 43540 + 1,98 T log T - 10,44 T 298 - 2100
H
2(g)
+ S
2(g)
= H
2
S
(g)
- 21580 - 11,805 T 298 - 2000
Mn
(l)
+ S
2(g)
= MnS
(l)
- 62770 + 15,4 T 1803 - 2000
Mn
(s)
+ O
2(g)
= MnO
(s)
- 91950 + 17,4 T 298 - 1500
3Mn
(s)
+ C
(s)
= Mn
3
C
(s)
- 3330 - 0,26 T 298 - 1010
2MgO
(s)
+ SiO
2(s)
= Mg
2
SiO
4(s)
- 15120 298 - 1700
Mg
(g)
+ O
2(g)
= MgO
(s)
- 181600 - 7,37 T log T + 75,7 T 1380 - 2500
MgO
(s)
+ CO
2(g)
= MgCO
3(s)
- 28100 + 40,6 T 298 - 1000
Mg
(l)
+ Cl
2(g)
= MgCl
2(l)
- 144600 + 29,98 T 973 - 1133
2Ni
(s)
+ O
2(g)
= 2NiO
(s)
- 116900 + 47,1 T 298 - 1725
2Ni
(l)
+ O
2(g)
= 2NiO
(s)
- 125300 + 51,96 T 1725 - 2200
2Pb
(l)
+ S
2(g)
= 2PbS
(s)
- 75160 + 38,25 T 600 - 1380
Pb
(l)
+ O
2(g)
= PbO
(l)
- 45830 + 18,9 T 1200 - 1400
PCl
3(g)
+ Cl
2(g)
= PCl
5(g)
- 22850 - 4,37 T log T + 56,22 T 298 - 1000
S
2(g)
= [S]
(1 %peso en Fe)
- 31520 + 5,27 T
SO
2(g)
+ O
2(g)
= SO
3(g)
- 22600 + 21,36 T 318 - 1800
Si
(s)
+ O
2(g)
= SiO
2(s)
- 215600 + 41,5 T 700 - 1200
3Si
(s)
+ 2N
2(g)
= Si
3
N
4(s)
-177000 - 5,76 T log T + 96,3 T 298 - 1686
Sn
(l)
+ Cl
2(g)
= SnCl
2(l)
- 79600 + 28,3 T 520 - 925
Ti
(s)
+ O
2(g)
= TiO
2(s)
- 217500 + 41,4 T 298 - 2080
2V
(s)
+ O
2(g)
= 2VO
(s)
- 205900 + 35,9 T 900 - 1800
Zn
(g)
+ O
2(g)
= ZnO
(s)
- 115420 - 10,35 T log T + 82,38 T 1170 - 2000
Zn
(g)
+ S
2(g)
= ZnS
(s)
- 94970 - 8,05 T log T + 74,92 T 1120 - 2000
Termodinmica 116
Juan Chamorro G.
You might also like
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSFrom EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSRating: 4.5 out of 5 stars4.5/5 (7)
- Arco en C Philips BV LibraDocument11 pagesArco en C Philips BV LibraJuan C Gomez50% (2)
- Ingeniería química. Soluciones a los problemas del tomo IFrom EverandIngeniería química. Soluciones a los problemas del tomo INo ratings yet
- Apuntes BPMDocument7 pagesApuntes BPMMiguel Ángel Reyes MartínezNo ratings yet
- Apuntes BPMDocument7 pagesApuntes BPMMiguel Ángel Reyes MartínezNo ratings yet
- Reducción y Refinación TostaciónDocument23 pagesReducción y Refinación TostaciónAldo GranadosNo ratings yet
- Diagramas de EllinghamDocument27 pagesDiagramas de EllinghambeburicoteritoNo ratings yet
- Campo EléctricoDocument18 pagesCampo EléctricojhonnyNo ratings yet
- Metalurgía Del HierroDocument5 pagesMetalurgía Del Hierrocristianggg67% (3)
- COORDENADAS GEODESICAS - Grupo CDocument25 pagesCOORDENADAS GEODESICAS - Grupo CJhonny juan cuellar garciaNo ratings yet
- Problemas Resueltos de FisicoquímicaDocument17 pagesProblemas Resueltos de FisicoquímicaERICK GUSTAVO QUINTANILLA GARCIA100% (1)
- 1 Ellingham-TostaciónDocument53 pages1 Ellingham-TostaciónMARCELO HINOJOSA HERNANDEZNo ratings yet
- Serie FasesDocument9 pagesSerie FasesDaniela GonzalezNo ratings yet
- Operacion Unitaria 1Document44 pagesOperacion Unitaria 1StephanyPerezNo ratings yet
- Cuarta Semana de Clases - Calderas A Vapor PDFDocument23 pagesCuarta Semana de Clases - Calderas A Vapor PDFFelixGranadosNo ratings yet
- Diagramas de Estabilidad de Ellingham y KelloggDocument7 pagesDiagramas de Estabilidad de Ellingham y KelloggJeyson GrandaNo ratings yet
- Apuntes III - Metalurgia-UdaDocument30 pagesApuntes III - Metalurgia-UdaAlexander TRNo ratings yet
- Capitulo XI Reacciones Que Involucran Fases Condensadas Puras y GasesDocument20 pagesCapitulo XI Reacciones Que Involucran Fases Condensadas Puras y Gasesjose lopezNo ratings yet
- Eq. Fases Condensadas - GasDocument65 pagesEq. Fases Condensadas - GasBelén TorresNo ratings yet
- El Efecto de La Temperatura Y La Presion en El Equilibrio de Los Procesos Metalurgicos 1. IntroducciónDocument15 pagesEl Efecto de La Temperatura Y La Presion en El Equilibrio de Los Procesos Metalurgicos 1. IntroducciónLucio FernandoNo ratings yet
- EllinghamDocument7 pagesEllinghamTeresa MataNo ratings yet
- 5.diagramas de Ellingham ClasesDocument27 pages5.diagramas de Ellingham ClasesCristhian Ł. BarrientosNo ratings yet
- 6.0 Equilibrio Log P 1sobret Cu2ODocument8 pages6.0 Equilibrio Log P 1sobret Cu2OMario JorgeNo ratings yet
- Problemas Resueltos Tema 6Document4 pagesProblemas Resueltos Tema 6Maria Fernanda PerezNo ratings yet
- Certamen 1 Pauta de CorrecciónDocument2 pagesCertamen 1 Pauta de CorreccióngerardtobarNo ratings yet
- Taller 4 FQ 2022-1Document5 pagesTaller 4 FQ 2022-1humberto lopezNo ratings yet
- Tablas TermodinamicasDocument1 pageTablas TermodinamicasDiego HernandezNo ratings yet
- Ingeniería Electromecánica.: Máquinas Y Equipos Térmicos 1. Complemento de La Unidad 1Document13 pagesIngeniería Electromecánica.: Máquinas Y Equipos Térmicos 1. Complemento de La Unidad 1Kevin PerezNo ratings yet
- Efectos TermicosDocument5 pagesEfectos TermicosBranco R. R. HermozaNo ratings yet
- Termodinamica II 2015Document10 pagesTermodinamica II 2015Charly MuñozNo ratings yet
- Metalurgia Extractiva Termo 2014 1 ProcesosDocument65 pagesMetalurgia Extractiva Termo 2014 1 ProcesosNandeiro1591No ratings yet
- 2022 I Tarea 1Document2 pages2022 I Tarea 1bryanNo ratings yet
- Problemas Equilibrio Quí MicoDocument2 pagesProblemas Equilibrio Quí MicoTonyFontanaNo ratings yet
- Cambios de EntropíaDocument6 pagesCambios de EntropíaWalver LópezNo ratings yet
- Problemas Quimica (Termodinamica)Document30 pagesProblemas Quimica (Termodinamica)Daniel SolarNo ratings yet
- Fisico Quimica 2Document24 pagesFisico Quimica 2Melanie PinzonNo ratings yet
- FQ Clase 1 2022-2Document16 pagesFQ Clase 1 2022-2humberto lopezNo ratings yet
- 3PC FQDocument5 pages3PC FQPipo HernándezNo ratings yet
- Cuestionario-Segundo ParcialDocument43 pagesCuestionario-Segundo ParcialJuan Silva LopezNo ratings yet
- Intercade - Aspectos Termodinamicos EjemplosDocument30 pagesIntercade - Aspectos Termodinamicos EjemplosMarcelo MamaniNo ratings yet
- Termoquimica EjemploDocument44 pagesTermoquimica EjemploCarolina Tejada GomezNo ratings yet
- Problemas U2Document7 pagesProblemas U2Alma Sosa Flores100% (1)
- Aplicacion de La Primera Ley de La TermodinamicaDocument64 pagesAplicacion de La Primera Ley de La TermodinamicaNacha TamaraNo ratings yet
- Clase4 ADocument26 pagesClase4 ARONALDNo ratings yet
- Sustancias Inorgánica ( ), ( ) : D (LNKP) DT RT H H RTDocument4 pagesSustancias Inorgánica ( ), ( ) : D (LNKP) DT RT H H RTmilene cardenas castroNo ratings yet
- Serie 3 Equilibrio Quimico 4540Document2 pagesSerie 3 Equilibrio Quimico 4540Yassel4No ratings yet
- 2019 01 Certamen 01 Con PautaDocument7 pages2019 01 Certamen 01 Con PautaDiego VenegasNo ratings yet
- Clase 08 Termodinamica de Soluciones 1Document47 pagesClase 08 Termodinamica de Soluciones 1Francisco Javier Alarcón GarridoNo ratings yet
- Fisicoquímica UPCH CLASE 1Document15 pagesFisicoquímica UPCH CLASE 1Stev EnNo ratings yet
- BE 2006 3 Capacidad CalorificaDocument17 pagesBE 2006 3 Capacidad CalorificaJavier RivmatamNo ratings yet
- Energía Libre y EquilibrioDocument15 pagesEnergía Libre y EquilibrioEloisa Amell AmellNo ratings yet
- Certamen 1 ResueltoDocument3 pagesCertamen 1 ResueltoLuciaRiquelmeMartínezNo ratings yet
- FIsicoquimica 3 TroutonDocument30 pagesFIsicoquimica 3 TroutonArcentiNo ratings yet
- Preguntas de TermoDocument50 pagesPreguntas de TermoEdy Leon ChavezNo ratings yet
- Ter Cera LeyDocument8 pagesTer Cera LeyVllsSNo ratings yet
- Trabajo 4Document3 pagesTrabajo 4kevin dominguez valenciaNo ratings yet
- 254 - Mario Sanches - Juan Leseigneur - Caracterizacion de La Tostacion de Concentrados Mediante El Uso de Diagraas de Estabilidad, Construccion Tridimensional para El Sstema Cu Fe S ODocument12 pages254 - Mario Sanches - Juan Leseigneur - Caracterizacion de La Tostacion de Concentrados Mediante El Uso de Diagraas de Estabilidad, Construccion Tridimensional para El Sstema Cu Fe S OCesarPastenSozaNo ratings yet
- Fisico CatDocument5 pagesFisico CatalexanderNo ratings yet
- Trabajo de Termodica JuevesDocument3 pagesTrabajo de Termodica JuevesMario JorgeNo ratings yet
- Considere La Siguiente Reacción: 2 ( ) + 2 ( ) 2 ( ) 1204Document8 pagesConsidere La Siguiente Reacción: 2 ( ) + 2 ( ) 2 ( ) 1204Alisson Fernanda33% (3)
- Texto 3Document24 pagesTexto 3Jorddy Peralta IruriNo ratings yet
- Universidad de CartagenaDocument14 pagesUniversidad de CartagenaRalph MarrugoNo ratings yet
- Guia de Manejo de ResinasDocument14 pagesGuia de Manejo de ResinasLAVERO2008No ratings yet
- Momento Flector y Esfuerzo CortanteDocument6 pagesMomento Flector y Esfuerzo CortantePedro Piñero CebrianNo ratings yet
- Estructuras de Tipo AX, AmXnDocument15 pagesEstructuras de Tipo AX, AmXncristiangggNo ratings yet
- TRATAMIENTOS TERMICOS (Aceros)Document23 pagesTRATAMIENTOS TERMICOS (Aceros)Juan Carlos Arias GomezNo ratings yet
- CBF211L Pract 06Document5 pagesCBF211L Pract 06Jhon SnowNo ratings yet
- Permeabilidad de MembranaDocument9 pagesPermeabilidad de MembranaErika AldamaNo ratings yet
- UTILIZACIÓN DEL R 134a EN SISTEMAS HERMÉTICOS DE REFRIGERACIÓN LBPDocument6 pagesUTILIZACIÓN DEL R 134a EN SISTEMAS HERMÉTICOS DE REFRIGERACIÓN LBPOsman CastroNo ratings yet
- En La EstabilidadDocument4 pagesEn La EstabilidadLuisManuelHuamanMartinezNo ratings yet
- Tema 2 Deformacion Simple 2 1 ContenidosDocument26 pagesTema 2 Deformacion Simple 2 1 ContenidosfernandaNo ratings yet
- Química Tema 5Document4 pagesQuímica Tema 5youngsnow /fNo ratings yet
- T2 Ejercicios - Electricidad y ElectrónicaDocument6 pagesT2 Ejercicios - Electricidad y ElectrónicaFLORNo ratings yet
- Modelos Termodinamicos PDFDocument7 pagesModelos Termodinamicos PDFNicandroGonzalesNo ratings yet
- Taller Cinemática de FluidosDocument6 pagesTaller Cinemática de FluidosJesus LeitonNo ratings yet
- Ecuación de Euler de Las Turbomáquinas PDFDocument10 pagesEcuación de Euler de Las Turbomáquinas PDFLuis David Girón EscobarNo ratings yet
- Vibrado de ConcretoDocument2 pagesVibrado de ConcretomariaNo ratings yet
- Materiales y Procesos - Unidad 2.1 PDFDocument14 pagesMateriales y Procesos - Unidad 2.1 PDFFabricio Gonzales MalcaNo ratings yet
- Convección 5Document9 pagesConvección 5LUIS EMILIO HERNANDEZ TORRESNo ratings yet
- Cortante BasalDocument18 pagesCortante BasalwwwdannyfiltNo ratings yet
- CuestionarioDocument6 pagesCuestionarioLyn Portilla GarciaNo ratings yet
- 12cap11 Presionlateraldelsuelo 160725223823 PDFDocument39 pages12cap11 Presionlateraldelsuelo 160725223823 PDFZecarlos A ChNo ratings yet
- 3 Tension Superficial 1 1Document23 pages3 Tension Superficial 1 1Marcos Orlando Calla CondoriNo ratings yet
- Analisis Estructural de AliviaderoDocument7 pagesAnalisis Estructural de AliviaderoCesarNo ratings yet
- Analisis Climatico Municipio de MariquitaDocument3 pagesAnalisis Climatico Municipio de MariquitaMomotus AequatorialisNo ratings yet
- Cinemática en 1D y 2DDocument24 pagesCinemática en 1D y 2DDARWIN RICARDO CANDO GUANOTUÑANo ratings yet
- Alberto Diseño Del Puente LosaDocument7 pagesAlberto Diseño Del Puente LosaRivera GraceNo ratings yet
- Medicon de Flujo Equipo3Document45 pagesMedicon de Flujo Equipo3Fidel Angel Díaz AlvaradoNo ratings yet
- Antecedentes Teoricos Tostacion de MolibdenitaDocument17 pagesAntecedentes Teoricos Tostacion de MolibdenitaJorge JeriaNo ratings yet
- Solución T.P.Nº10Document16 pagesSolución T.P.Nº10Alfredo MIKENo ratings yet