Professional Documents
Culture Documents
Balance de materia de un proceso de producción de metano
Uploaded by
Israel Jimenez RamosOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Balance de materia de un proceso de producción de metano
Uploaded by
Israel Jimenez RamosCopyright:
Available Formats
A un proceso de produccin de metano a partir de gas de sntesis y vapor de agua, se alimentan 6 kgmol/min de un gas que contiene 50 % de H 2 , 33 1/3 % de CO y el resto
CH 4 (todos en base molar), as como 72 kg/min de vapor de agua. Los productos son 3 kgmol/min de agua lquida y 95 kg/min de un gas que contiene 25 % de CH 4 , 25 % de CO 2 y el resto H 2 (todos en base molar).
Determine, con tres cifras significativas, si: a. b. c. d. e. Se conserva la masa total? Se conservan las moles totales? Se conservan las moles de cada tipo de tomo? Se conserva la masa de cada tipo de sustancia qumica? Qu puede concluirse que ocurre en este proceso?
SOLUCION: Para la mezcla gaseosa de salida se conoce el flujo msico y su porcentaje molar, puede efectuarse un cambio de fraccin molar a msica o, lo que es ms sencillo, encontrar la masa molecular media de la mezcla. Procediendo de ambas maneras: Masa Molecular Media = (0.25 16 + 0.25 44 + 0.5 2) = 16 por tanto:
Conocida la fraccin molar se toma como base un mol de mezcla y la fraccin msica de cada componente se calcula dividiendo la masa de cada componente (fraccin molar por masa molecular) por la masa total del mol de mezcla (o masa molecular media):
Para los otros componentes se procede de manera anloga (sin todas las unidades):
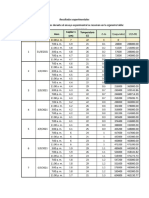
Para visualizar el balance de materia, se toma como base un minuto y con los flujos msicos y/o molares conocidos se construye la siguiente tabla.
En ella se hace inventario de las masas de los componentes y las moles totales a la entrada y a la salida: a. Se conserva la masa total? Al proceso entran 150 kg y de l salen 150 kg. La masa total que entra es igual a la masa total que sale, de acuerdo con la Ley de la Conservacin de la Materia. b. Se conservan las moles totales? Las moles totales no se conservan: Al proceso entran 10 kgmol y de l salen 9 kgmol. c. Se conservan las moles de cada tipo de tomo? Sumando los tomos mol de cada componente a la entrada y a la salida se tiene que: ENTRADA: Los elementos que intervienen en el proceso son H, C y O.
SALIDA: Efectuando el mismo procedimiento para los componentes a la salida (sin colocar las unidades): kg - tomo de H kg - tomo de C kg - tomo de O = H del H 2 + H del CH 4 + H del H 2 O = ( 3 2 + 1.5 4 + 3 2) = 18 = C del CH 4 + C del CO 2 = ( 1.5 1 + 1.5 1) = O del H 2 O + O del CO 2 = ( 3 1 + 1.5 2) = = 3 6
Los kg tomo que entran y salen de los elementos H, C y O son, respectivamente: 18, 3 y 6. Se conserva el nmero de tomos mol de cada tipo de tomo. d. Se conserva la masa de cada tipo de sustancia qumica? Como puede verse en la tabla anterior, la masa de cada tipo de sustancia no se conserva. Esto se debe a que en el proceso ocurre una reaccin qumica en la que, como es obvio, desaparecen unas sustancias y se forman otras. e. Qu puede concluirse que ocurre en este proceso? Que hay interaccin qumica entre los diferentes componentes. Puede plantearse que ocurre la reaccin: 2 CO + H2O 1.5 CO 2 + 0.5 CH 4
La cual explica que en el proceso haya desaparecido el CO, que los kg-mol de agua hayan disminuido en 1, que hayan aparecido 1.5 kg-mol de CO 2 y que el nmero de kg-mol de CH 4 haya aumentado en 0.5, tal como puede constatarse en la tabla.
Un proceso de produccin de yoduro de metilo, CH 3 I, tiene las corrientes de entrada y salida que se muestran en la figura. La corriente de desperdicio consiste en 82.6 % (en masa) de HI y el resto agua, mientas que la corriente de producto contiene 81.6 % (msico) de CH 3 I y el resto CH 3 OH. Determine con tres cifras significativas, si: a. Se conserva la masa total? b. Se conservan el nmero total de moles? c. Se conservan el nmero de moles de cada tipo de tomo? d. Se conserva la masa de cada tipo de sustancia qumica? e. Qu puede concluirse que ocurre en este proceso?
SOLUCION: Tomando como base un da se tendr que: a. Se conserva la masa total? Masa que entra = (125 128 + 150 32) lb Masa que entra = 20800 lb Masa que sale = (7760 + 13040) lb Masa que sale = 20800 lb De la igualdad de las masas se concluye que se conserva la masa total. b. Se conservan el nmero total de moles? Moles que entran = (125 + 150) lbmol = 275 lbmol
Moles que salen: Es la suma de las moles del desperdicio y del producto: Desperdicio: HI = 7760 0.826 lb = 6409.76 lb = 50.076 lbmol
H 2 O = 7760 0.174 lb = 1350.24 lb Producto:
= 75.013 lbmol
CH3I = 13040 0.816 lb = 10640.64 lb = 74.41 lbmol CH3OH = 2399.36 lb = 74.98 lbmol = (50.076 + 75.013 + 74.41 + 74.98) lbmol = 274.479
As: Moles que salen lbmol
Con tres cifras significativas el nmero de moles no se conserva: 275 vs. 274.479 c. Se conserva el nmero de moles de cada tipo de tomo?
Los elementos que intervienen en las sustancias del proceso son: C, H, O e I. Hallando la cantidad total de cada uno de ellos en los componentes de los flujos de entrada y salida, se encuentra que: ENTRADA: lb-tomo de C lb-tomo de O lb-tomo de I lb-tomo de H SALIDA: lb-tomo de C lb-tomo de O lb-tomo de I lb-tomo de H = = = = = C del CH 3 I + C del CH 3 OH = (74.41 + 74.98) = 143.39 O del H 2 O + O del CH 3 OH = (75.013 + 74.98) = 149.993 I del HI + I del CH 3 I = (50.076 + 74.41) = 124.486 H del HI + H del H 2 O + H del CH 3 I + H del CH 3 OH (50.076 + 75.013 2 + 74.41 3 + 74.98 4) = 723.252 = = = = C del CH 3 OH = 150 O del CH 3 OH = 150 I del HI = 125 H del HI + H del CH 3 OH = (125 + 150 4) = 725
En el proceso, con tres cifras significativas, el nmero de tomos de cada elemento no se conserva. d. Se conserva la masa de cada tipo de sustancia qumica? La masa de cada tipo de sustancia qumica no se conserva porque hay una transformacin qumica, en la que desaparecen unas sustancias y se forman otras. e. Qu puede concluirse que ocurre en este proceso? Primero, hay reaccin qumica. Segundo, es probable que los porcentajes msicos del desperdicio y del producto sean aproximaciones y que al dar sus valores con ms cifras significativas se obtenga el resultado esperado: que la masa se conserve.
En una planta de cido sulfrico, se mezclan 100 lbmol/h de una corriente que contiene 90 % mol de H 2 SO 4 en agua, con 200 lbmol/h de otra que contienen 95% mol de H 2 SO 4 en agua y con 200 lbmol/h de una corriente que consiste de 15% mol de SO 3 en N 2 . El resultado son 480 lbmol/h de una corriente mezclada que contiene 170 lbmol/h de N 2 , 62.5 % mol de H 2 SO 4 , nada de agua y el resto SO 3 . Determine, mediante clculos, si: a. b. c. d. e. f. Se conserva la masa total? Se conservan el nmero total de moles? Se conservan el nmero de moles de cada tipo de tomo? Se conserva la masa de cada sustancia? Si el balance total de masa no resulta, cul es la explicacin ms probable? Si el balance del nmero total de moles no resulta, cul es la explicacin ms probable?
SOLUCION: Con base en una hora de operacin y los flujos correspondientes a la entrada y a la salida se construye la tabla siguiente. En ella, cada columna corresponde a: La Columna 1 muestra los componentes de cada flujo. Las Columnas 2, 3 y 4 corresponden a los tres flujos. La Columna 5 corresponde a la suma total de moles de estas corrientes. La Columna 6 corresponde a la masa que entra al proceso. La Columna 7 es la corriente de salida, en moles. La Columna 8 es la masa que sale del proceso. La ltima fila corresponde a la suma, en lbs o lbmol, de los componentes de cada columna.
Las respuestas al problema son: a. Se conserva la masa total? La masa total se conserva: resultados de las columnas 6 y 8. b. Se conservan el nmero total de moles? El nmero total de moles no se conserva. Columnas 5 y 7: entran 500 y salen 480. c. Se conservan el nmero de moles de cada tipo de tomo? El nmero de moles de cada tipo de tomos se conserva. Esto puede deducirse como consecuencia de que se conserve la masa y de que no haya dos compuestos que tengan la misma masa molecular.
Para corroborarlo se halla la suma de los lb-tomo de hidrgeno, azufre y oxgeno de las corrientes de entrada, y compararla con los lb-tomo a la salida: Hidrgeno: Entrada: H = [(90 2 + 10 2) + (190 2 + 10 2)] lb-tomo = 600 lb-tomo Salida: H = (280 2 + 20 2) lb-tomo = 600 lb-tomo Azufre: Entrada: S = [(90 1) + (190 1) + (30 1)] lb-tomo = 310 lb-tomo Salida: S = [(280 1 + 30 1)] lb-tomo = 310 lb-tomo Oxgeno: Entrada: O = [(90 4 + 10 1) + (190 4 + 10 1) + (30 3)] lb-tomo =1230 lb-tomo Salida: O = [(280 4 + 20 1 + 30 3)] lb-tomo = 1230 lb-tomo d. Se conserva la masa de cada sustancia? La masa de cada sustancia no se conserva porque hay reaccin qumica. e. Si el balance total de masa no resulta, cul es la explicacin ms probable? El balance total de masa resulta. f. Si el balance del nmero total de moles no resulta, cul es la explicacin ms probable? Las veinte lb-mol de H 2 O que entran al proceso reaccionan con 20 de las 30 lb-mol de SO3 que llegan, segn la ecuacin: H2O + SO 3 H 2 SO 4 Desaparecen, en total, 40 lb-mol y se forman 20 lb-mol de H 2 SO 4 , como puede observarse en la tabla: Columnas 5 y 7. La tabla siguiente explica el proceso.
Un gas que contiene 79.1 % de N 2 , 1.7 % de O 2 y 19.2 % de SO 2 , se mezcla con otro gas que contiene 50 % de SO 2 , 6.53 % de O 2 y 43.47 % de N 2 , para producir un gas que contiene 21.45 % de SO 2 , 2.05 % de O 2 y 76.50 % de N 2 . Todas las composiciones corresponden a porcentaje en mol. Determine: a. El nmero de variables de corrientes independientes que hay en el problema. b. El nmero de balances de materia que pueden expresarse y cuntos sern independientes. c. En qu proporcin debern mezclarse las corrientes? SOLUCION: El diagrama cuantitativo, con todas las variables del proceso, es:
a. Nmero de variables de corrientes independientes que hay en el problema. En el diagrama cuantitativo puede verse que el nmero de variables de corriente independientes es nueve (9): hay tres corrientes y las variables independientes de cada una son tres: 1 flujo y 2 composiciones. b. Nmero de balances de materia que pueden expresarse y cuntos sern independientes. Pueden expresarse cuatro balances de materia: uno, para cada uno de los tres componentes, y el balance de materia total. Solamente tres son independientes porque al sumar las ecuaciones de balance de los tres componentes se obtiene la ecuacin para el balance total. c. En qu proporcin debern mezclarse las corrientes?
En este caso, al no haber reaccin qumica, el nmero de moles totales debe conservarse y los balances molares son anlogos a los balances de materia. Se trata de un sistema homogneo de 3 ecuaciones con 3 incgnitas que tiene o una solucin (la solucin trivial) o infinitas soluciones.
Dividiendo el sistema de ecuaciones por N1 (con lo cual se descarta la solucin trivial) se obtiene un sistema de 3 ecuaciones con 2 incgnitas. Sea x = N2/N1 y y z = N3/N1: 0.79 0.017 1 + 0.4347 x + 0.0653 x + x = = = 0.7650 z 0.0205 z z
Al resolver este sistema se encuentra la siguiente redundancia: z = 1.078716 z = 1.078125
es decir, 2 valores diferentes para z. Por tanto el sistema slo tendra la solucin trivial: N1 = N2 = N3 = 0, o dicho de otra manera, es imposible obtener el flujo de salida con esa composicin a partir de los 2 flujos con las composiciones dadas. Sin embargo, la pequea diferencia entre los dos valores encontrados para la variable z (1.078716 vs. 1.078125) hacen pensar que sta se debe al corte de decimales, y no a que el problema est mal planteado. Resolviendo el problema para un flujo dado se comprobar lo anterior. Tomando como base de clculo N1 = 1000, el sistema de ecuaciones de balance anteriores se transforma en:
en el cual slo hay dos incgnitas: N2 y N3. Resolviendo simultneamente las ecuaciones (1) y (3) se encuentra que: N3 = 1078.716 N2 = 78.716
Reemplazando en la ecuacin (2) estos valores se encuentra que: 17 + (0.0653 78.716) = 22.140 = 22.114 0.0205 1078.716
Situacin que indica que si la composicin de O2 en la corriente de salida tuviera ms decimales, las dos incgnitas satisfaran la ecuacin (2). A la misma situacin se llega al hacer el correspondiente anlisis de Grados de Libertad del problema: Tabla de Grados de Libertad:
Al tomar una base de clculo, los Grados de Libertad seran iguales a -1, valor con el cual el proceso estar sobre-especificado. Esto significa que en el proceso sobra informacin, pero no necesariamente que ella no se ajuste a las condiciones de operacin del proceso. En este caso, como ya se sabe, se origina un sistema de 3 ecuaciones y 2 incgnitas. Resolviendo simultneamente dos cualesquiera de ellas y reemplazando los valores encontrados en la tercera podr saberse si las tres ecuaciones son consistentes. Si lo hacen, la informacin es redundante, pero no contradictoria. Si no lo hacen, el problema no tiene solucin porque la informacin, adems de ser redundante es contradictoria. Es decir, no pueden cumplirse todas las especificaciones. La primera situacin es la que se presenta problema, la cual se aclarar ms a continuacin. Como sobra informacin puede eliminarse un dato. Consideremos que es desconocida la composicin de O 2 en el flujo de salida. En estas condiciones, slo se conocen 5 composiciones y la Tabla de Grados de Libertad es: Tabla de Grados de Libertad:
Al tomar una base de clculo, N1 = 1000, por ejemplo, el sistema queda con CERO Grados de Libertad. Esto significa que se puede configurar un sistema con: Tres ecuaciones (nitrgeno, oxgeno, total) Tres incgnitas (N2, N3, xO23).
Las ecuaciones de balance son:
Resolviendo el sistema se encuentra que: Obsrvese que el valor calculado para la composicin de oxgeno a la salida no difiere sustancialmente del dato que se le elimin al problema, pero esta pequea diferencia (0.000024) es suficiente para los dos valores diferentes encontrados para la variable z, y para los dos valores diferentes al reemplazar N2 y N3 en (4). Ahora, los resultados hallados se pueden corroborar en el balance de dixido de azufre, el cual es dependiente. Por diferencia:
En este problema se aclaran las situaciones que se pueden presentar cuando un proceso se encuentra sobre-especificado. La respuesta que se pide es:
You might also like
- Proceso de Producción de Metano A Partir de Gas de Síntesis y Vapor de AguaDocument4 pagesProceso de Producción de Metano A Partir de Gas de Síntesis y Vapor de Agualaura HernandezNo ratings yet
- Reacciones químicasDocument6 pagesReacciones químicasMarcel Kempe0% (1)
- Análisis GravimetricoDocument14 pagesAnálisis GravimetricoOscar E RS100% (1)
- Mi Parte de Tu PapáDocument2 pagesMi Parte de Tu PapáKevin E Reyes DiazNo ratings yet
- 02 Guión Práctica 2. ENSAYOS DE DUREZA Y DE IMPACTO 2018Document13 pages02 Guión Práctica 2. ENSAYOS DE DUREZA Y DE IMPACTO 2018cassyNo ratings yet
- 01 Bal Masa 2021 ResueltosDocument3 pages01 Bal Masa 2021 ResueltosIvo ManriqueNo ratings yet
- Solución - Segundo Examen ParcialDocument10 pagesSolución - Segundo Examen ParcialsocorroNo ratings yet
- QA Unidad IIDocument41 pagesQA Unidad IIEdgar HernándezNo ratings yet
- Balance de MateriaDocument11 pagesBalance de MateriaPablo Orellana TapiaNo ratings yet
- 05 c1 BALANCES EN ESTADO TRANSITORIODocument32 pages05 c1 BALANCES EN ESTADO TRANSITORIOMelisa ParedesNo ratings yet
- SOLUCIONES Relación de Problemas 4 Balances de Materia Sin Reacción QuímicaDocument5 pagesSOLUCIONES Relación de Problemas 4 Balances de Materia Sin Reacción Químicapisignatus123No ratings yet
- Variables de ProcesoDocument6 pagesVariables de ProcesoAINA DANAE HEREDIA CASTRONo ratings yet
- Autoevaluacion de ReaccionesDocument37 pagesAutoevaluacion de ReaccionesAle OsbertoNo ratings yet
- Calor Molar de Una Reacción QuímicaDocument6 pagesCalor Molar de Una Reacción QuímicaSebastian PertuzNo ratings yet
- Trabajo en Clase 1Document31 pagesTrabajo en Clase 1karenNo ratings yet
- Balance 18Document9 pagesBalance 18FL MargioryNo ratings yet
- Jessica Arismendi Taller n.1 Balance Sin Reacción QuímicaDocument3 pagesJessica Arismendi Taller n.1 Balance Sin Reacción QuímicaJESSICA VANESSA ARISMENDI AVILEZNo ratings yet
- UDocument2 pagesURandyNo ratings yet
- Guía 4Document9 pagesGuía 4Juan AparicioNo ratings yet
- 1borrador Examen Final 020819PILAR CABILDO MIRANDADocument17 pages1borrador Examen Final 020819PILAR CABILDO MIRANDARicardo SierraNo ratings yet
- Tema 8 Ejercicios SuplementariosDocument1 pageTema 8 Ejercicios SuplementarioscacaNo ratings yet
- Cálculo de parámetros de equipos de separación de sólidosDocument4 pagesCálculo de parámetros de equipos de separación de sólidosariel yana morgaNo ratings yet
- NaucilDocument18 pagesNaucilJESSICA DANIELA MACIAS PEREZNo ratings yet
- PiritaDocument3 pagesPiritaSamiirOx Xz' Méndez LimayNo ratings yet
- ProcesosDocument3 pagesProcesosCristian CelyNo ratings yet
- Balance energía reacciones químicasDocument10 pagesBalance energía reacciones químicasJerson Llanqui NuñesNo ratings yet
- Conversion 2Document3 pagesConversion 2Alfredo FernandezNo ratings yet
- Balance de masa unidades y dimensionesDocument2 pagesBalance de masa unidades y dimensionesJoss AndradeNo ratings yet
- Balance de MateriaDocument12 pagesBalance de MateriacynthiajulissaNo ratings yet
- Prob 4.10 FelderDocument3 pagesProb 4.10 FelderDavid SotoNo ratings yet
- Volumetria de NeutralizacionDocument46 pagesVolumetria de NeutralizacionBruno ValverdeNo ratings yet
- Balance Con ReaccionDocument4 pagesBalance Con ReaccionManuel Carmona50% (2)
- Ejercicio 3. Balance de Materia en Varias Unidades de ProcesoDocument4 pagesEjercicio 3. Balance de Materia en Varias Unidades de ProcesoKarla BecerrilNo ratings yet
- Equilibrio Resueltos2Document7 pagesEquilibrio Resueltos2LEODAN BLADIMIR MAMANI ZAPANANo ratings yet
- BalanceDocument7 pagesBalanceGunnar Leonardo Gutiérrez QuisbertNo ratings yet
- Entregable 6Document7 pagesEntregable 6Daniel Esparza100% (1)
- Método de OndaDocument9 pagesMétodo de OndaAna VelázquezNo ratings yet
- Clase 2 06 - 10 - 2023Document2 pagesClase 2 06 - 10 - 2023JoseIgnacioNo ratings yet
- Determinación de bario en muestra solubleDocument5 pagesDeterminación de bario en muestra solubleJordy Daniel Gonzaga AbadNo ratings yet
- Blanqueo pulpa papelera ClO2Document1 pageBlanqueo pulpa papelera ClO2Yardlenis SanchezNo ratings yet
- Ácido BenzoicoDocument5 pagesÁcido BenzoicoanytcNo ratings yet
- Semana 6 Problemas Balance de EnergíaDocument1 pageSemana 6 Problemas Balance de EnergíaIng Ronald PortalesNo ratings yet
- B 5Document1 pageB 5davis ramirezNo ratings yet
- Método Ponchon-Savarit para calcular el número de platos en una columna de destilación fraccionadaDocument11 pagesMétodo Ponchon-Savarit para calcular el número de platos en una columna de destilación fraccionadaJose Carlos RubiNo ratings yet
- Guía #4 - Energía Libre - Clausius Clapeyron 2021Document4 pagesGuía #4 - Energía Libre - Clausius Clapeyron 2021Andreina RicattoNo ratings yet
- Metodo Grafico de WinkelmannDocument4 pagesMetodo Grafico de WinkelmannCarmen HernandezNo ratings yet
- Problema 4.40 Balance de La MateriaDocument11 pagesProblema 4.40 Balance de La MateriaAnaNo ratings yet
- Semana 3Document18 pagesSemana 3Cesar Augusto Buendia Baldeon0% (1)
- 1er Práctico III - 2019Document6 pages1er Práctico III - 2019VHRNo ratings yet
- PolarimetriaDocument11 pagesPolarimetriaGiuseppe Jerónimo MezaNo ratings yet
- Calcinación y combustiónDocument10 pagesCalcinación y combustiónMatías Ariel HerreraNo ratings yet
- 1ra. Taller de Balance de Materia y EnergíaDocument2 pages1ra. Taller de Balance de Materia y EnergíaGiancarlo Castro50% (2)
- Ejercicios con ciclos y algoritmosDocument9 pagesEjercicios con ciclos y algoritmosDiego AlanNo ratings yet
- Problemas PrincipiosDocument7 pagesProblemas PrincipiosGustavo Carranza NeyraNo ratings yet
- NDocument5 pagesNLeonardo KkalixtoNo ratings yet
- Universidad de GuayaquilDocument22 pagesUniversidad de GuayaquilLeiver JoelNo ratings yet
- Clase # 8 Constante de AcidezDocument28 pagesClase # 8 Constante de AcidezJennifer Montenegro ParraNo ratings yet
- Calidad del agua en la cuenca del Río MoctezumaDocument145 pagesCalidad del agua en la cuenca del Río MoctezumaEdris MejíaNo ratings yet
- Ejemplo 4.5-1 FelderDocument1 pageEjemplo 4.5-1 FelderRicardo Avilés SánchezNo ratings yet
- Práctica N°4. EjerciciosDocument8 pagesPráctica N°4. EjerciciosDanan DiazNo ratings yet
- Recetas Esotericas2Document44 pagesRecetas Esotericas2Marcos LeonNo ratings yet
- 221pm 5e791a4a68397Document3 pages221pm 5e791a4a68397Santiago VaronNo ratings yet
- Manual CFKN 20 - 170 ESDocument112 pagesManual CFKN 20 - 170 ESCalendarioFC FCNo ratings yet
- Para Limpiar Mayolicas PDFDocument3 pagesPara Limpiar Mayolicas PDFOscar Fernandez SanchezNo ratings yet
- Matriz Leopold CamalDocument25 pagesMatriz Leopold CamalVictor Miguel Alcazar Flor100% (3)
- PRACTICA #01 - Contenido de HumedadDocument2 pagesPRACTICA #01 - Contenido de HumedadEddy CcosiNo ratings yet
- Material InformativoDocument25 pagesMaterial InformativolmamanioNo ratings yet
- Aliviaderos Laterales InformeDocument26 pagesAliviaderos Laterales Informebrandon cusi aguilar100% (1)
- Memoria Descriptiva II EtapaDocument10 pagesMemoria Descriptiva II EtapaAdenAinalaNo ratings yet
- CausasEFectosCCDocument3 pagesCausasEFectosCCAndrea Castro Benito100% (1)
- Exposición Cuenca Del Rio CañeteDocument25 pagesExposición Cuenca Del Rio CañeteDIANA CASTRONo ratings yet
- Curso Cero de BiologíaDocument57 pagesCurso Cero de BiologíaJaviergvNo ratings yet
- Algodon TanguisDocument77 pagesAlgodon TanguisGladys Jannet Noa Rayme100% (1)
- Azúcares y DulcesDocument33 pagesAzúcares y DulcesLorena Iglesias BellosoNo ratings yet
- Marco Disciplinar HeliconiaDocument5 pagesMarco Disciplinar HeliconiaNatalia BravoNo ratings yet
- HTP (Word)Document16 pagesHTP (Word)estebantulliNo ratings yet
- Irrigacion Presas de RegulacionDocument4 pagesIrrigacion Presas de RegulacionAnthony Barreto MontesNo ratings yet
- ANÁLISIS MORFOMÉTRICO DE LA CUENCA DEL RÍO GUANACASDocument4 pagesANÁLISIS MORFOMÉTRICO DE LA CUENCA DEL RÍO GUANACASLuis Miguel Orrego MonsalveNo ratings yet
- Ciclo HidrológicoDocument33 pagesCiclo HidrológicoDiego MejiaNo ratings yet
- Extracción Por Solventes UDECDocument107 pagesExtracción Por Solventes UDECFrancisco Javier Alarcón Garrido100% (3)
- Presentacion ChallacabaDocument19 pagesPresentacion ChallacabaCesar Agustin Zarate MirandaNo ratings yet
- Clasificacion de Los PescadosDocument5 pagesClasificacion de Los PescadosCarlha SalazarNo ratings yet
- Bomberos AeronauticosDocument25 pagesBomberos AeronauticosANTONY CHIRINOSNo ratings yet
- Guía de anclajes en obras de carreteraDocument56 pagesGuía de anclajes en obras de carreteradefmere100% (1)
- Ficha Tecnica New World 11 8 6Document8 pagesFicha Tecnica New World 11 8 6kassandraNo ratings yet
- Válvulas EspecialesDocument6 pagesVálvulas EspecialesING. HERBERT LUPACANo ratings yet
- Cuestionario BioquimicaDocument3 pagesCuestionario BioquimicaYADIRANo ratings yet
- Folleto Higiene VocalDocument6 pagesFolleto Higiene VocaltorrecampenoNo ratings yet
- Erosión y Transporte de SedimentosDocument30 pagesErosión y Transporte de SedimentosJorgemanuelsilva100% (1)
- Drenaje AgrícolaDocument12 pagesDrenaje AgrícolaCarmen Rosa SanchezNo ratings yet