Professional Documents
Culture Documents
Química Analítica
Uploaded by
Ricardo D Alcivar ACopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Química Analítica
Uploaded by
Ricardo D Alcivar ACopyright:
Available Formats
Qumica Analtica (Ingeniera Qumica) Home
PROBLEMAS DE ANALISIS INSTRUMENTAL
I.-TECNICAS ELECTROQUIMICAS
1.-El potencial de la celda Pt,H2(1,00 atm)/HCl(3,215.10-3 M),AgCl(sat)/Ag es 0,52053 V. Calcule el potencial del electrodo de la derecha.? R: 0,671V 2.-Cul es el potencial de una semicelda que consta de un electrodo de cadmio sumergido en una disolucin 0,020 M en Cd 2+ ? Datos Eo (Cd(II)/Cd)) = -0,40 V. R: 3.-Se construye de forma experimental la pila siguiente: Pt/H2 (1,0 atm)/HX (0,10 M)//KCl (0,10 M), AgCl/Ag y su f.e.m. resulta ser 0,46 V. A partir de ese valor y sabiendo que el E00 del sistema 2H3O+/H2 vale 0 V (por convenio), que el E01 del sistema AgCl/Ag vale 0,22 V, y que HX es un cido dbil cuyo anin no tiene propiedades red-ox, determine el valor de la constante de acidez ka del cido HX. R: K(HA) = 10-5 4.-La quinidrona es un slido cristalino que consiste en una mezcla equimolecular de quinona e hidroquinona. Sobre electrodo de platino el sistema es Q + 2 H3O+ + 2 e === H2Q + H2O , reversible y con un potencial normal de 0,699 V. a) Dibuje el diagrama de una celda que pueda ser usada para la determinacin del pH con quinidrona. b) Deducir la ecuacin que relaciona el potencial de la misma con el pH. Datos: H2Q/HQ-/Q2- pK1 = 10 ; pK2 = 11,5. R: FEM = cte- 0,06 pH 5.-La celda compuesta por Ag, AgI, KI (1 M) // AgNO3 (0,001 M), Ag tiene un potencial de 0,72 V. Calcule el producto de solubilidad del AgI. Suponga los coeficientes de actividad = 1. 6.-Se desea valorar un cido dbil HA de pK = 4 con una base fuerte y seguir la valoracin electroqumicamente. Para ello se aade a la disolucin del cido una mezcla equimolecular de quinona e hidroquinona (quinhidrona). A) Demostrar mediante el trazado de las curvas i-E a lo largo de la valoracin que la misma puede seguirse electroqumicamente. B) Qu tcnica indicadora escogera?. Datos: Q + 2 e- + 2 H3O+ H2Q + H2O Eo = 0,70 V ; H2Q/HQ-/Q2- pK1= 10 ; pK2 = 11,5 7.-Se pretende valorar Hg(II) con AEDT y seguir la valoracin electroqumicamente utilizando como electrodo de trabajo oro amalgamado. Utilizando los datos que se dan A) Escoja el pH ms adecuado para llevar a cabo la valoracin. B) Trazar las curvas i-E a lo largo de la valoracin , situndolas sobre un eje apropiado. C) Indique los mejores mtodos electroanalticos para detectar el punto final de la valoracin. Datos: Log b (HgY) =
21,8, Eo(Hg(II)/Hg(0)) = 0,80 V pH Log a Y (H3O) Log a Hg(OH) 3 10,8 0,5 4 8,6 1,9 5 6,6 3,9 6 4,8 5,9 7 3,4 7,9 8 2,3 9,9 9 1,4 11,9 10 0,5 13,9 11 0,1 15,9
8.-Se pretende valorar complexomtricamente una disolucin 10-2 M de sal frrica y seguir la valoracin electroqumicamente mediante un electrodo indicador de platino. Para ello se aade a la disolucin sal ferrosa en la misma concentracin y a continuacin AEDT desde la bureta. Utilizando los datos que se suministran, determine el pH ptimo para realizar la valoracin . Establezca las ecuaciones i-E del sistema y site dichas curvas sobre u eje i-E segn sus E1/2, calculando numricamente los desplazamientos de las curvas a lo largo de la valoracin. Deduzca a partir de las mismas qu mtodos indicadores son los ms adecuados para seguir la valoracin. Datos: E (Fe(III)/Fe(II)) = 0,77 V, Log b (FeY-) = 25,1, Log b (FeY2-) = 14,2 PH 0 Log a Y (H3O) 21,4 Log a FeII (OH) 0 III Log a Fe (OH) 0 1 17,4 0 0 2 13,7 0 0 3 10,8 0 0,4 4 8,6 0 1,8 5 6,6 0 3,7 6 4,8 0 5,7 7 3,4 0 7,7 8 2,3 0 9,7 9 1,4 0,1 11,7 10 0,5 0,6 13,7
9.-Se desea valorar una disolucin de tisosulfato con triyoduro y seguirse electroqumicamente con un electrodo de platino. Deducir con ayuda de los datos las reacciones electroqumicas sobre el electrodo y trazar las curvas i-E. Qu mtodo indicador utilizara?. Datos: Eo(I3 -/I-).=0,54 V. El sistema tetrationato/tiosulfato es lento. La especie tetrationato no es electroactiva, mientras que el tiosulfato se oxida a un potencial prximo a 0,6 V. 10.-Se valora una disolucin de amonaco con un HCl, utilizando una celda compuesta por electrodo de vidrio/electrodo de calomelanos. Demuestre cmo se puede obtener Kb a partir del pH del punto de semineutralizacin. 11.-Los siguientes datos se obtuvieron en la valoracin potenciomtrica de 50,00 ml de Fe(II) de concentracin desconocida con Ce(IV) 0,100 N. Represente la curva de valoracin. Calcule y represente la diferencial primera, la diferencial segunda y la concentracin de la disolucin de Fe(II): Ce(IV) E(mV) Ce(IV) E(mV) 1,0 411 50,0 944 10,0 488 50,1 1204 25,0 524 50,2 1221 49,0 624 50,3 1233 49,5 641 50,4 1240 49,6 647 50,5 1245 49,7 655 51 1264 49,8 666 52 1280 49,9 683 55 1307
12.-Se disuelve en cido sulfrico una muestra de metal puro M generando M2+. La disolucin se valora potenciomtricamente utilizando un ECS como referencia y uno de Pt como indicador. Se gastan hasta el Punto Final 40,00 ml de Ce(IV) 0,1000 N. La FEM para el 25% de la valoracin es 0,184 V, para el 75% =0,212 V, siendo la curva de valoracin
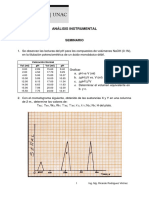
lineal desde el 10 al 90%. a) Calcular el potencial normal de la semicelda de la sustancia que se valora, b)Calcular el nmero de electrones intercambiados, c) Calcular el peso atmico de M, d) Deducir la reaccin de la clula antes del punto estequiomtrico y despus del punto estequiomtrico. R: n 0 2 , Eo = 0,438 V (vs. ENH), Mm= 125 g/molg 13.-Una disolucin que contiene dos sustancias reducibles, A y B en KCl 1 M como electrolito soporte, presenta los datos polarogrficos tabulados a continuacin. Ambas sustancias tienen el mismo coeficiente de difusin y A se reduce a un potencial ms negativo que B. E(V) 0,00 I(mA) 0,0 -0,20 -0,40 -0,50 -0,54 -0,58 -0,60 -0,64 -0,68 -0,72 -0,76 1,0 2,0 2,5 2,7 3,5 5 10 16 22,5 28,5
-0,80 -0,84 -0,90 -1,00 -1,10 -1,14 -1,18 -1,20 -1,24 -1,28 -1,32 -1,40 33 34 34,5 35,5 36 37,6 40,5 47,5 53 57 57,5 58 a) Representar i frente a E y determinar el potencial de onda media de A y B, b) la concentracin de A es 4,0. 10-4 M, Cul es la concentracin de B? Si
14.- Una disolucin que contiene Cd2+ en medio actico-acetato como electrolito soporte, tiene una constante de la corriente de difusin, I, de 4,60. Utilizando un capilar que deja caer 2,50 mg de mercurio por segundo y un tiempo de goteo de 3,00 segundos, la corriente de difusin es de 3,50 mA. Calcule la concentracin de Cadmio en la disolucin. 15.- La constante de la corriente de difusin para una cierta disolucin de Zn(II) es 3,50. Cuando m= 3,00 mg s-1y t = 4,00 s, la corriente de difusin, id, es 7,00 mA. Calcular la concentracin de in cinc en la disolucin. 16.-Calcule el tiempo necesario para depositar por electrolisis, con la corriente que se indica, el peso de metal dado: Peso de metal 0,300 g de Cu 0,550 g de platino R: t1 = 694 s, t2 = 17.-Se necesitan 20 minutos con una corriente de 1,2450 A para depositar todo el Cu2+ que contiene una disolucin obtenida disolviendo 0,2000 g de Cu. Calcule el rendimiento de la corriente. R: Rdto= 43,06%. 18.-Una disolucin ntrica de nitrato de plomo se electroliza durante 18 minutos a 0,400 A. Qu peso de PbO2 se depositar en el nodo?. Si el volumen de la disolucin es de 200,00 Electrolito Sulfato de cobre anhidro PtCl4 Corriente, A 1,375 0,2650
ml, Cul es el aumento de la concentracin de cido como resultado de la electrlisis ?Qu volumen de hidrgeno (c.n.) se libera en el ctodo ?. R: V= 0,0501 litros 19.-Una disolucin de permanganato se reduce a in manganoso con in ferroso generado culombimtricamente con una corriente constante de 2,450 mA durante 11 minutos. Calcular la concentracin molar del permanganato si el volumen inicial es de 50,00 ml. R: M= 0,0672 20.-Un cubo metlico de 5,00 cm de arista se recubre en todas sus caras de cobre (densidad= 8,9) mediante depsito catdico del mismo a partir de una disolucin de Cu2+, por electrolisis con 2,000 A. a) Cul es el espesor del depsito producido por electrolisis durante 1 hora? c) Cunto tiempo se requiere para obtener un espesor de 0,0200 mm? R: V = 4,19 . 103 cm3 ; Espesor = 2,096 . 10-5 cm. de
PROBLEMAS DE ESPECTROFOTOMETRIA (Tomados
Anlisis Instrumental, Skoog-Leary y de Anlisis Qumico Cuantitativo, Ayres)
8.l.- Tras las diluciones adecuadas una disolucin patrn dio las concentraciones de hierro que se muestran a continuacin. El complejo de hierro (II)/1,10-fenantrolina se desarroll entonces en alcuotas de 25,0 mL de estas disoluciones, a continuacin cada una de ellas se diluy a 50,0 mL. Se leyeron las siguientes absorbancias a 510 nm; Concentracin de Fe(ll) en las disoluciones iniciales, ppm Absorbancia, A (cubetas de I cm) 2,00 5,00 8,00 12 00 16,00 20.00
0,164
0,425 0,628 0,951 1,260
1.582
(a) Construir una curva de calibrado a partir de estos datos., (b) Construir un grfico de Ringbom, indicando el intervalo ptimo y el error mnimo cometido 8-2 El mtodo desarrollado en el Problema 8-1 se aplica a la determinacin rutinaria de hierro en alcuotas de 25,0 mL de aguas naturales. Determinar la concentracin (en ppm Fe) de muestras que dieron los datos de absorbancia que siguen (en celdas de 1,00 cm): (a) 0,107 (b) 0,721 (c) 1,538 8-4 Una alcuota de 25,0 mL de una solucin acuosa de quinina se diluy a 50,0 mL y se encontr que tena una absorbancia de 0,832 a 348 nm cuando se meda en una celda de 2,00 cm. Una segunda alcuota de 25,0 mL se mezcl con 10,00 mL de una disolucin que contena 23,4 ppm de quinina; despus de diluir a 50,0 mL, esta disolucin tena una absorbancia de 1,220 (cubetas de 2,00 cm). Calcular las partes por milln de quinina en la muestra.
8-5 Una muestra de 5,12 g de un pesticida se descompuso por mineralizacin y a continuacin se diluy a 200,0 mL en un matraz aforado. El anlisis se complet tratando las alcuotas de esta disolucin como se indica. Volmenes de reactivo utilizados Volumen de muestra ________________________________________Absorbancia, A, 545 nm tomados, mL 3,82 ppm Cu2+ Ligando H2O (cubetas de 1,00-cm) 50,0 0,00 20,0 30,0 0,512 50,0 4,00 20,0 26,0 0,844 Calcular el porcentaje de cobre en la muestra. 8-6 Una determinacin simult nea de cobalto y nquel se puede basar en la absorcin simult nea de sus respectivos complejos de 8-hidroxiquinolinol. Las absortividades molares correspondientes a sus mximos de absorcion son Absortividad molar, x, a 365 nm 700 nm 3529 428,9 3228 10.2
Co Ni
Calcular la concentracin molar de nquel y cobalto en cada una de las siguientes disoluciones bas ndose en los datos siguientes: Absorbancia, A (cubetas de 1,00 cm) Disolucin 365 nm 700 nm (a) 0,598 0,039 (b) 0.902 0.072
8-7 Cuando se midi, con una cubeta de 1,00 cm, una disolucin 8,50 x 10-5 M de la especie A present absorbancias de 0,129 y 0,764 a 475 y 700 nm respectivamente. Una disolucin 4,65 x 10-5 M de la especie B di absorbancias de 0,567 y 0,083 en las mismas condiciones. Calcular las concentraciones de A y B en disoluciones que dieron los siguientes datos de absorbancia en una cubeta de 1,25 cm: (a) 0,502 a 475 nm y 0,912 a 700 nm; (b) 0,675 a 475 nm y 0,696 a 700 nm. 8-8 El indicador cido/base HIn experimenta la siguiente reaccin en disolucin acuosa diluida: HIn (color I) ~ H + + In ( color 2). Se obtuvieron los siguientes datos de absorbancia para una disolucin 5,00 x 10-4 M de HIn en NaOH 0,1 M y HCl 0,1 M. Las medidas se hicieron a la longitud de onda de 484 nm y 625 nm con cubetas de 1,00 cm: 0,1 M NaOH: A485 = 0,052 A625 = 0,823; 0,1 M HCI: A485 = 0,454 A625 = 0,176. En la disolucin de NaOH, bsicamente todo el indicador estaba presente como In~; en la disolucin cida, estaba todo en forma de HIn. (a) Calcular las absortividades
molares para In- y HIn a 485 y 625 nm. (b) Calcular la constante de disociacin para el indicador si un tampn de pH 5,00 que contiene una pequea cantidad de indicador presenta una absorbancia de 0,472 a 485 nm y 0,351 a 625 nm (cubetas de 1,00 cm), (c) Cual es el pH de una disolucin que contiene una pequea cantidad del indicador y que presenta una absorbancia de 0,530 a 485 nm y 0,216 a 635 nm (cubetas de 1,00 cm)?, (d) Una alcuota de 25,00 mL de una disolucin de un cido dbil org nico purificado HX necesita exactamente 24,20 mL de una disolucin est ndar de una base fuerte para alcanzar el punto final de la fenoftaleina. Cuando se aadieron exactamente 12,10 mL de la base a una alcuota de 25,00 mL del cido, que contenia un~ pequea cantidad del indicador que se est considerando, la absor bancia se encontr que era de 0,306 a 485 nm y 0,555 a 625 nm (cubetas de 1,00 cm). Calcular el pH de la disolucin y la Ka del cido dbil., (e) Cu l seria la absorbancia de una disolucin a 485 y 625 nm (cubetas de 1,25 cm) que fuese 2,00 x 1o-4 M en el indicador y que estuviese tamponada a pH 6,000? 8-9 El error absoluto en la transmitancia para un fotmetro concreto es 0,005 e independiente de la magnitud de T. Calcular el porcentaje de error relativo en la concentracin producido por esta fuente cuando: (a) A = 0,585 (c) A = 1,800 (e) T = 99,25% (b) T = 49,6% (d) T = 0,0592 (f) A = 0,005 31-3 Una disolucin que contiene l0,0 ppm (1 ppm = 1 mg por litro) de cierto material coloreado. medida con un espesor ptico de 1,00 cm, presenta la absorbancia y el porcentaje de transmitancia (% T) que se muestran en la primera lnea de la tabla. Calcular los valores que faltan en la tabla. Se supone aue el sistema sigue la leY de Beer. Ccn (ppm) 10,0 4,2 12,7 18,00 Espesor (cm) 1.00 1,00 1,00 2,00 1,00 5,00 %T 38.9 Absorbancia 0,410
Dado a b c d e f
0,861 22,1 19,2
10,0
31-4 Una disolucin de KMnO4 que contiene 1,00 mg de manganeso por 100 ml tiene una transmitancia de 12,9 % cuando se mide con un espesor de 2,00 cm. (a) Calcular la absorbancia de la disolucin.(b) Calcular el % T cuando se mide con un espesor de 1,00 cm. (c) Se disuelve una muestra de 0,2000 g de acero al manganeso, se oxida a permanganato, y diluye a 500.0 ml. Con un espesor de 1,00 cm la absorbancia de la disolucines 0,600. Calcular e] porcentaje de Mn en el acero. 31-5 Una disolucin de KMnO4 que contiene 1,00 ppm de manganeso tiene una transmitancia de 90,4 %, con un espesor de 1,00 cm, a 526 ml. (a) Calcular (,)/O Ten una solucin que contiene 2,00 ppm de manganeso cuando se mide con un espesor de 10,0 cm. (b) Calcular la absortividad molar del manganeso (medido como permanganato) a 526 ml. 31-9 Los siguientes datos se han obtenido por medida de cierta disolucin en cubetas de
2,00
cm de espesor. Concentracin, g/litro: 0,0105 0,0210 0,0280 Transmitancia por ciento: 44,8 20,0 11,7 (a) Sigue el sistema la ley de Beer, con una aproximacin del I %?, (b) Calcular el valor medio de la absortividad especfica, por ppm-cm., (c) Calcular la concentracin de una disolucin que tiene un % T 28.7 en cubeta de2,00 cm., (d) Calcular la concentracin de una solucin que tiene un % T de 52,4 % en cubetasde 1,00 cm. 31-10 Los datos siguientes se han obtenido en la calibracin de una serie de patrones para la determinacin de hierro, midiendo la transmitancia, a 506 mll y espesor de 1,00 cmde soluciones de hierro(ll) en las que se ha desarrollado color con 1,10-fenantrolina. Conc. Fe, ppm % T Conc. Fe, ppm % T 0.20 90,0 3,00 26,3 0,40 82,5 4,00 17,0 0,60 76,0 5,00 10.9 0,80 69,5 6,00 7.0 1,00 63,5 7,00 4.5 2.00 4l.0 (a) Representar, en papel semilogartmico de 2 ciclos, % T frente a la concentracin de hierro. Sigue el sistema la ley de Beer en todo el intervalo de concentraciones?, (b) Calcular la absortividad molar media del hierro cuando se determina por este mtodo., (c) En un papel semilogartmico similar al anterior, representan (100--% T) frente al logaritmo de la concentracin (mtodo de Ringbom). (l) Cu l es el intervalo de concentracin ptimo y la exactitud m xima (error relativo por I % de error fotomtrico) en este intervalo? (2) En qu intervalo de concentraciones el error relativo, por I % de error fotomtrico, no pasar de 5 %? 31-11 Los siguientes datos se han obtenido en la calibracin de una serie patrn para le determinacin de cobres, como Cu(NH3)4+ +, midiendo la transmitancia en un fotmetro de filtro Conc. Cu, ppm %T 0,020 27,8 0,050 2 0,080 84,7 1,40 17. % T Conc Cu,
ppm
96,0
0,800
90,6
1,00
23,
2 0,100 9 0,200 0,400 0,600 66,7 47,3 35,8 3,00 4,00 9,7 8,1 81,4 2,00 12,
(a) Representar, en un papel semilogartmico de 2 ciclos % T frente a la concentracin de cobre. Cumple el sistema en estas condiciones de medida, la ley de Beer en el intervalo completo de concentraciones? Cualquier desviacin de la ley, es de pequea o de gran magnitud? Sugerir causas de estas desviaciones. (b) Representar en un papel semilogartmico de 3 ciclos (100--% T) frente al logantmo de la concentracin (mtodo de Ringbom). (I) Cu l es el intervalo de concentraciones para la mayor precisin? (2) En este intervalo, cu l es el error relativo por ciento por I % de error fotomtrico? (3) Cu l es el intervalo de concentracin en el cual el error relativo de medida no pasa del S % y del 10 %? EJERCICIOS DE SEPARACIONES l-El coeficiente de distribucin de una sustancia, entre agua y el tetracloruro de carbono, es 4. Calcular la cantidad de soluto que queda sin extraer en fase acuosa cuando se realizan 3 extracciones sucesivas con igual cantidad de disolvente que de fase acuosa. 2- Calcular el rendimiento en una sola etapa de extracci6n, para un sistema cuyo coeficiente o relaci6n de distribuci6n es 100, cuando se emplean volmenes iguales de fase acuosa y fase orgnica. 3- Se trabaja con 1.000 g de una sustancia cuya relaci6n de distribuci6n entre una fase acuosa y una orgnica es 50. Calcular la cantidad extrada de 100ml de fase acuosa empleando 30ml de disolvente orgnico y con dos etapas de extracci6n sucesivas. Calcular el rendimiento de la extracci6n. 4-El coeficiente de distribucin del yodo entre agua y sulfuro de carbono (CS2) es 420. A) Si una disoluci6n de 0.0189 de I2, en 100ml de agua, se agita con 100ml de CS2 Qu peso de I2, permanecer en la fase acuosa?.B) si la misma disoluci6n de yodo se agita con dos porciones de 50ml de CS2 (de forma sucesiva). Qu cantidad de I2, permanece sin extraer al final del proceso?. 5- Calcular el pH de semiextracci6n de una disoluci6n acuosa de oxina en cloroformo, siendo iguales los volumenes de las dos fases. La especie que se extrae es HOx y los pKa,
del sistema H2Ox/ HOx/ Ox- son pK1=5, pK2=9.7 6- Se lleva a cabo la extracci6n del Zn2+ disuelto en una disoluci6n acuosa de concentraci6n 10-5M, empleando cloroformo en el que se ha disuelto un agente complejante HR. En primer lugar se tomaron 100ml de la disoluci6n acuosa, a pH=S y se equilibra con 20ml de reactivo HR 10-3 M disuelto en cloroformo; extrayndose la especie ZnR, con un rendimiento del 40%. a) Cul ser el % de extraccin a pH=6 extrayendo con 20ml de disolucin de HR 2.5 10 3 M en cloroformo? b) Idem a pH=4 y 50ml de la misma disolucin de HR que en el apartado a) 7- Calcular la fraccin de Ag+ fijada por 1 g de cambiador catinico en forma sdica, puesta en equilibrio con 5Oml de disolucin de Ag+ 0.001 M Datos: KH/Na=1.56 KH/Ag=6.70 CE(capacidad equivalente)= 5meq/g 8- Calcular el indice de fijacin y el % de a al poner en contacto 1 g de una resina Dowex 50 en forma s6dica con una disoluci6n formada por 50 ml de La3+ 0,001 M y NaCl 0.01 M. Datos: KH/1/3 La= 2.80 KH/Na = 1.56 CE = 5meq/g. 9- Calcular la fracci6n de iones Cu 2+ fijada por 1 g de cambiador de cationes en forma prot6nica puesto en equilibrio con l00ml de una disoluci6n de CuSO4 0.001 M. Datos: KH/1/2Cu =1.35 CE = 5meq/g. 10- Dados los coeficientes de selectividad K2H+/Zn2+ = 1,05 y KH+/Na+= 1,20. Calcular el coeficiente de selectividad de una resina en forma Na' frente a los iones Zn2+. (K2Na+/Zn2+ ) 11- Calcular el % a de una resina en forma cloruro cuando 2 g de la misma se ponen en contacto con una disoluci6n formada por 50 ml de Na2SO4 10-3 M y NaCl O4 .lM (Kcl/1/2 So4+= 2.55 CE = 3 meq/g) 12-Se analiza el contenido en colesterol de un huevo mediante BPLC empleando el mtodo del patr6n interno empleando para tal fin un compuesto I. Para ello se toma 1,0000 g de yema se le aade 5 ml de una disoluci6n del patr6n interno de 250 ppm y se somete a una saponificacin con potasa metanlica y despus a una extraccin con isopropanol; el rendimiento de esta etapa es del 90%. Al final el colesterol se recupera en un volumen de 50 ml de isopropanol y se inyecta en un equipo de HPLC. A la vista de los resultados obtenidos determinar el contenido en colesterol en mg/g de yema del huevo. Datos del calibrado: Colesterol ppm 150 Area pico colesterol 989635 Area pico patrn 1023567 interno 180 1139635 1035693 210 1289656 1019986 240 1439958 1021698 270 310 11590278 1740287 1022963 1030021
Datos para la muestra: Area de Pico 1399987 13.- En la fabricacin de un producto comercial (lquido acuoso) adems del compuesto de inters, A, se obtiene una impureza en una concentracin que es el 30% de la de A. En el proceso de fabricaci6n se introduce una etapa de extracci6n con un disolvente orgnico, con el fin de extraer la impureza en ste. En una experiencia piloto se fabrican 10 L del producto y se someten a la extracci6n liquido-liquido. Al final de la misma se toman 2 mL de la fase acuosa y se diluyen hasta l L. De la disoluci6n resultante se hace una anlisis por HPLC. El calibrado se realiz mediante el mtodo del patrn externo, obtenindose los siguientes datos: A (g/l) Area pico Impureza g/l Area pico 0,50 1000035 0,010 100325 1,00 2000096 0,020 200701 1,50 3000125 0,030 301009 2,00 4000200 0,040 401300 2,50 5000175 0,050 501705 3,00 6000210 0,060 601950
Datos obtenidos en el anlisis de la muestra: 3524367 Area de pico de la impureza: 321096
Area de pico del compuesto A:
A) Para que el producto pueda comercializarse, el compuesto A tiene que tener una concentraci6n mayor de 700,00 g/l y la impureza menor de 5,00 g/L. A la vista de los resultados obtenidos en el anlisis por HPLC, decir si el producto puede comercializarse. (Suponer que al final de la etapa de extracci6n el volumen de la fase acuosa no ha variado, y que s1o se extrae en la fase orgnica la impureza) B) Calcular el rendimiento de la etapa de extracci6n para la impureza. 14.-En una columna de 35,0 cm, dos steres de cidos grasos tienen un tiempo de retencin de 12,50 y 17,25 min. respectvamente. Una especie que no se retiene pasa a travs de la columna en 1,20 min. Las anchuras de pico (en la base) son , para A 1,25 y para B 0,95 min. Calcular: a) La resolucin de la columna, b) el nmero promedio de platos de la columna, c) la altura del plato, d) la longitud de columna necesaria para producir una resolucin de 2,5. 15.-Los siguientes datos corresponden a una columna para cromatografa de lquidos: Longitud del relleno: 24,7 cm; caudal 0,313 mL/min; VM = 1,37 mL, VS= 0,164 mL . El cromatograma de una mezcla de especies A,B,C y D proporciona los siguientes datos: Tiempo de retencin (min) no retenida A B 3,1 5,4 13,3 Anchura de la base del pico (min) 0,41 1,07
C D
14,1 21,6
1,16 1,72
Calcular: a) El nmero de platos de cada pico, b) La media y la desviacin estndard de N, c) La altura del plato de la columna, d) El factor de capacidad, e) El coeficiente de distribucin, f) La resolucin para B y C, g) La longitud de la columna necesaria para tener una resolucin (Ay B) de 1,5. 16.-Se analiza el mismo compuesto por cromatografa de gases con una columna Se-30 (muy poco polar) y a continuacin con una columna Carbomax 20M (muy polar). Cmo variar K= cS/cM entre las dos columnas? 17.-En una columna de reparto de fase normal se encuentra que un soluto tiene un tiempo de retencin de 29,1 min., mientras que una muestra que es retenida tiene un tiempo de 1,05 min cuando la fase mvil contiene un 50% de cloroformo y 50% de n-hexano. Calcular a) k para el soluto, b) una composicin de disolventes que condujera a un valor de k por debajo de 10. Programa y bibliografa Objetivos
You might also like
- 2.1. Taller Métodos Potenciometricos PDFDocument5 pages2.1. Taller Métodos Potenciometricos PDF'Sebastian OrtizNo ratings yet
- Taller 2 Analisis InstrumentalDocument4 pagesTaller 2 Analisis InstrumentalAlejandra QuinteroNo ratings yet
- Taller 2 Analisis Instrumental I 2019-2 (2020)Document4 pagesTaller 2 Analisis Instrumental I 2019-2 (2020)Johan Lf CalderonNo ratings yet
- Práctico Potenciometría 2015Document4 pagesPráctico Potenciometría 2015Liliana FernandezNo ratings yet
- QAI - Seminario 1Document4 pagesQAI - Seminario 1yesicaNo ratings yet
- Problemas Electroanalisis2010 11Document12 pagesProblemas Electroanalisis2010 11John Quintana HuamaliesNo ratings yet
- Seminarios 1 A 4Document7 pagesSeminarios 1 A 4populus1234No ratings yet
- 2Document5 pages2Vivi Mar CSiNo ratings yet
- Tarea IIAexpDocument8 pagesTarea IIAexpPablo CzNo ratings yet
- Taller No. 3 Potenciometria - Docx. Andres David Ortiz y Dieber CalderonDocument6 pagesTaller No. 3 Potenciometria - Docx. Andres David Ortiz y Dieber CalderonAndres OrtizNo ratings yet
- 16 - Ejercicios Extras Tercer ParcialDocument1 page16 - Ejercicios Extras Tercer ParcialPilar ChavesNo ratings yet
- Ejercicios PotenciometriaDocument13 pagesEjercicios Potenciometriaraul enrique valdeiglesias abarca100% (1)
- Taller Métodos PotenciometricosDocument5 pagesTaller Métodos PotenciometricosMonica OramasNo ratings yet
- Seminario Potenciometría Ing 2018 PDFDocument2 pagesSeminario Potenciometría Ing 2018 PDFargaxdNo ratings yet
- Potenciometría en Química AnalíticaDocument2 pagesPotenciometría en Química AnalíticaBoris Milton Mamani IchutaNo ratings yet
- Guia Ejercicios Analisis Instrumental N°6-2022Document5 pagesGuia Ejercicios Analisis Instrumental N°6-2022ChasconaNo ratings yet
- U3 - S5 - Ejercicios Electroquímica CDDocument10 pagesU3 - S5 - Ejercicios Electroquímica CDmaicot donayreNo ratings yet
- Ejercicios Electroquímica-Material ComplementarioDocument6 pagesEjercicios Electroquímica-Material ComplementarioMIRIAM MEJIA DIAZ0% (1)
- Solemnes InstrumentalDocument11 pagesSolemnes InstrumentalLeonidas LarrondoNo ratings yet
- Guia Electroquimica 2015Document28 pagesGuia Electroquimica 2015rikudou_14No ratings yet
- Seminario de Problemas para Examen Final PDFDocument4 pagesSeminario de Problemas para Examen Final PDFCarlos Baca SanchezNo ratings yet
- Soluciones Redox Pau Asturias-10Document4 pagesSoluciones Redox Pau Asturias-10minmacullfNo ratings yet
- como se solicitóDocument29 pagescomo se solicitóAaron B. Quispe RomeroNo ratings yet
- Examen Química de Navarra (Ordinaria de 2019)Document2 pagesExamen Química de Navarra (Ordinaria de 2019)Iván RedradoNo ratings yet
- La Caliza y Sus PropiedadesDocument7 pagesLa Caliza y Sus PropiedadesAldair A. Herrera HuertaNo ratings yet
- Captura 2022-12-13 A Las 21.03.59Document8 pagesCaptura 2022-12-13 A Las 21.03.59irenekitty6No ratings yet
- Practica Calificada 4Document5 pagesPractica Calificada 4mishellaguilar667No ratings yet
- Química 11Document5 pagesQuímica 11candelanm98No ratings yet
- Guía 9 - Equilibrio y Volumetría REDOXDocument3 pagesGuía 9 - Equilibrio y Volumetría REDOXJuanNo ratings yet
- 8.voltametria de Redisolución Anodica CD y PBDocument10 pages8.voltametria de Redisolución Anodica CD y PBNathalie Ameris Sanchez Lopez100% (1)
- QUI010 - Certamen 3 - 1.2009Document5 pagesQUI010 - Certamen 3 - 1.2009Ceeiqa UsmNo ratings yet
- Ejercicios para El Taller de La Práctica Calificada 02: FisicoquímicaDocument5 pagesEjercicios para El Taller de La Práctica Calificada 02: FisicoquímicaEdgard ChavzNo ratings yet
- Tema 6.electroquímica - EjerciciosDocument6 pagesTema 6.electroquímica - Ejerciciosijojoi0% (1)
- Repaso SanmarcosDocument6 pagesRepaso SanmarcosjuanNo ratings yet
- S1Document2 pagesS1zorroben1953No ratings yet
- Serie 08Document4 pagesSerie 08Sandra FanchiottiNo ratings yet
- P.D. N°11Document2 pagesP.D. N°11RafaelNo ratings yet
- Guia de Ejercicios CompletaDocument10 pagesGuia de Ejercicios CompletaSTEPHANIE SANCHEZ CASTRILLONNo ratings yet
- Ex Final Qu 118 2015 2Document3 pagesEx Final Qu 118 2015 2Angel MarellaNo ratings yet
- Equilibrios Quimicos 2017Document28 pagesEquilibrios Quimicos 2017Alexandro Jimenez HuashuayoNo ratings yet
- Wuolah-Problemas de Química Analítica ExamenesDocument3 pagesWuolah-Problemas de Química Analítica ExamenesFatimaNo ratings yet
- Septiembre TodoDocument19 pagesSeptiembre TodoDavid Marin MartinezNo ratings yet
- PROBLEMAS DE ELECTROQUIMICA Y CÁLCULO DE POTENCIALESDocument8 pagesPROBLEMAS DE ELECTROQUIMICA Y CÁLCULO DE POTENCIALESJunior YupanquiNo ratings yet
- Problemas Capítulo 21 (Instrumental)Document4 pagesProblemas Capítulo 21 (Instrumental)Manuela MendozaNo ratings yet
- Analisis1examenes 4 y 5toDocument11 pagesAnalisis1examenes 4 y 5toJavan ZaldivarNo ratings yet
- Skoog Resuelto 13 14 17 CapDocument15 pagesSkoog Resuelto 13 14 17 CapLuis AtencioNo ratings yet
- 2011 OPQ Intermedio Fases-1-Y-2Document16 pages2011 OPQ Intermedio Fases-1-Y-2JoseNo ratings yet
- Ejercicio Pre Examen 01Document2 pagesEjercicio Pre Examen 01SofiaYsitaNo ratings yet
- Ejercicios EADocument4 pagesEjercicios EAjeronimo fernandez andujarNo ratings yet
- Volumetrías de Formación de ComplejosDocument14 pagesVolumetrías de Formación de ComplejospepeNo ratings yet
- Seminario 2 Redox 2021Document3 pagesSeminario 2 Redox 2021gaNo ratings yet
- Analitica ProblemasDocument6 pagesAnalitica Problemasmartin11_91No ratings yet
- Conductimetría Serie 2 Agosto 2018Document3 pagesConductimetría Serie 2 Agosto 2018Leif_Erikson_No ratings yet
- Problemas de PotenciometríaDocument2 pagesProblemas de PotenciometríaRamiro Biscardi AlvarezNo ratings yet
- Taller de CulombimetríaDocument3 pagesTaller de CulombimetríaLiliana BuenoNo ratings yet
- Seminario Redox 2018Document3 pagesSeminario Redox 2018gaNo ratings yet
- Caracterización química, morfológica y estructural de materialesFrom EverandCaracterización química, morfológica y estructural de materialesNo ratings yet
- Problemas resueltos de Hidráulica de CanalesFrom EverandProblemas resueltos de Hidráulica de CanalesRating: 4.5 out of 5 stars4.5/5 (7)
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaFrom EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaNo ratings yet
- Experimento Propiedades de La MateriaDocument6 pagesExperimento Propiedades de La MateriaRosa Wene Gomez Officer75% (4)
- NTC 218. Acidez e Indice de AcidezDocument14 pagesNTC 218. Acidez e Indice de AcidezDiego GarzonNo ratings yet
- Tecnicas Hidrogeoquimicas DiagramasDocument140 pagesTecnicas Hidrogeoquimicas DiagramasElizier Jacquot Mansilla EguiaNo ratings yet
- Permanganato de PotasioDocument20 pagesPermanganato de PotasioEnrique PeraltaNo ratings yet
- UNIDADES DE CONCENTRACIÓN FÍSICAS y QUÍMICASDocument11 pagesUNIDADES DE CONCENTRACIÓN FÍSICAS y QUÍMICASluisovega50% (2)
- Deapositivas de UrgenciasDocument20 pagesDeapositivas de UrgenciasFreddy UreñaNo ratings yet
- Modulo I 2015 PDFDocument16 pagesModulo I 2015 PDFCFNo ratings yet
- Cloro y Ozono 113Document8 pagesCloro y Ozono 113ReNe SauCedaNo ratings yet
- Calor de dilución ácido sulfúrico calorímetro caseroDocument3 pagesCalor de dilución ácido sulfúrico calorímetro caseroLV HeribertoNo ratings yet
- Fermentacion Con Residuos de PanDocument12 pagesFermentacion Con Residuos de PanJoel Machaca GNo ratings yet
- Diagrama de Flujo BalanceDocument4 pagesDiagrama de Flujo BalanceDayra100% (1)
- Métodos de Limpieza y Desinfección Según La Naturaleza Del AlimentoDocument5 pagesMétodos de Limpieza y Desinfección Según La Naturaleza Del AlimentoPatty DoradoNo ratings yet
- Elaboración de Conservas Cocktail de FrutasDocument27 pagesElaboración de Conservas Cocktail de FrutasMarleny Guerra Huanchi100% (1)
- Nom 078 Ssa1 1994Document8 pagesNom 078 Ssa1 1994Eduardo A Galeana SánchezNo ratings yet
- Manual AguasDocument82 pagesManual AguasNaqsh DannNo ratings yet
- Hidrolisis SalesDocument7 pagesHidrolisis Salesfrankys200No ratings yet
- Analisis de Extracto Celular de FresaDocument58 pagesAnalisis de Extracto Celular de FresaMeinardo Bautista RuizNo ratings yet
- 2001.dachs - Inequidades en Salud. Como EstudiarlasDocument29 pages2001.dachs - Inequidades en Salud. Como EstudiarlasJorge SierraNo ratings yet
- Preguntas JuegoDocument5 pagesPreguntas Juegoalejo cardNo ratings yet
- Boop Reuther Manual SpanishDocument2 pagesBoop Reuther Manual SpanishEver SucoNo ratings yet
- Sexto - Preparacion y Valoracion de SolucionesDocument14 pagesSexto - Preparacion y Valoracion de SolucionesCristhian Mallqui100% (1)
- CAPITULO 12. Diluciones.Document29 pagesCAPITULO 12. Diluciones.José Carlos Tejeda100% (2)
- Guia Gestion SF6Document32 pagesGuia Gestion SF6Alberto Resino AlfonsoNo ratings yet
- Determinacion de ElemetosDocument242 pagesDeterminacion de ElemetosOmar DiazNo ratings yet
- Guia #08Document4 pagesGuia #08Wilfredo Gilmer ParedesNo ratings yet
- Articulo Solubilidad QuitosanoDocument6 pagesArticulo Solubilidad QuitosanoKarenMorenoRodriguezNo ratings yet
- Corrosion Por CO2 en Industria PetroleraDocument14 pagesCorrosion Por CO2 en Industria PetroleraAndres Carmona100% (1)
- Elaboración de Néctar en Planta PilotoDocument21 pagesElaboración de Néctar en Planta PilotoLuz Angelica Vera ChavezNo ratings yet
- QUÍMICA-II Secuencia Didáctica Con ProyectoDocument42 pagesQUÍMICA-II Secuencia Didáctica Con ProyectoBreKB MéndezNo ratings yet
- ACIDIMETRÍADocument4 pagesACIDIMETRÍAkarol321100% (1)