Professional Documents
Culture Documents
C1 Des Periodic As Primera Parte
Uploaded by
Jose Luis MoncadaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
C1 Des Periodic As Primera Parte
Uploaded by
Jose Luis MoncadaCopyright:
Available Formats
UPV Quimica I
Unidad I: Propiedades Peridicas: Masa y Enlace
1. Nociones moderna 2. Propiedades elementos
de
teora
atmica de los
peridicas
3. Enlace inico y covalente 4. Masas atmicas y moleculares
1. Nociones moderna
de
teora
atmica
A nivel cualitativo obtendremos una comprensin de la teora atmica actual. sta ha sido la evolucin de teoras anteriores que se fueron perfeccionando en la medida que el conocimiento se fue ampliando con descubrimientos experimentales y desarrollo de nuevos conceptos provenientes de la fsica y adaptados a las necesidades de la qumica.
Unidad 1
UPV Quimica I
1. Nociones de teora atmica moderna
A fines del siglo XIX, se crea que toda la naturaleza era explicable por medio de los conocimientos hasta ese entonces alcanzados por la fsica, solo quedaban pendiente un par de fenmenos que no se podan explicar, como: - la radiacin del cuerpo negro
1. Nociones de teora atmica moderna
- el efecto fotoelctrico
1. Nociones de teora atmica moderna
- espectros atmicos
Unidad 1
UPV Quimica I
1. Nociones de teora atmica moderna
Estructura del tomo de H Experimentos de finales del siglo XIX obligaron a replantear modelos atmicos en el siguiente orden cronolgico: 1.-) Modelo de Thomson
2.-) Modelo de Rutherford
1. Nociones de teora atmica moderna
Estructura del tomo de H
3.-) Modelo de Bohr
4.-) Modelo actual: concepto de rbita es abandonado siendo reemplazado por el concepto de orbital
1. Nociones de teora atmica moderna
Actualmente se conocen 115 elementos Segn origen: 89 naturales y 26 sintticos Segn abundancia: elementos comunes como C, O, Fe, Cu elementos escasos Lu, Pm, Tl
Clasificacin de elementos
Segn propiedades qumicas: metales 78%, no
metales 10%, semimetales 7%, gases nobles 5%
Unidad 1
UPV Quimica I
1. Nociones de teora atmica moderna tomos, molculas e iones
tomo: es la partcula ms pequea de un elemento
Molcula: es la partcula ms pequea de un compuesto, con una composicin y propiedades especficas In: es un tomo o molcula que posee carga elctrica
1. Nociones de teora atmica moderna Estructura atmica
Partculas fundamentales atmicas : protones y neutrones (en el ncleo) electrones (en torno al ncleo) Nmero atmico, Z , es el nmero de protones en el ncleo de un tomo. Todo tomo elctricamente neutro tiene un nmero de electrones igual al de protones Nmero msico, A , es el nmero total de protones y neutrones
2.
Propiedades peridicas de los elementos
Los elementos descubiertos hasta hoy se orden en lo que se conoce como la Tabla peridica de los elementos; se ordenan de acuerdo a su nmero atmico (orden creciente de Z) En la tabla peridica se puede notar la variacin que experimentan diversas propiedades fsicoqumicas de los elementos Por FILAS se ordenan los elementos que poseen igual nmero de capas de electrones Por COLUMNAS se ordenan los elementos que poseen igual nmero de electrones de valencia. Estos son los electrones ubicados en la ltima capa, es decir, los ms externos y por lo tanto los responsables de las propiedades qumicas de los elementos.
Unidad 1
UPV Quimica I
2. Propiedades elementos.
peridicas
de
los
Variaciones de las propiedades peridicas. Suceden a medida que nos desplazamos por la tabla peridica. Permiten entender la reactividad de los elementos a un nivel muy bsico y cualitativo, pero muy til al momento de querer obtener una idea acerca de la reactividad de los elementos.
Propiedades peridicas. En el sentido del desplazamiento, sucede lo siguiente:
Aumentan (de manera no montona): 1. La energa o potencial de ionizacin 2. La afinidad electrnica 3. La electronegatividad
Disminuyen (de manera no montona): 1. Radio inico 2. Radio atmico 3. Radio covalente
Agrupamiento de los elementos en la tabla peridica Transicin Se incluye el grupo del Zn
Tipo gas noble
Transicin interna: Lantnidos y Actnidos Metales Alcalinos y Alcalinos Trreos
Unidad 1
UPV Quimica I
2. Propiedades elementos.
peridicas
de
los
Ejemplo de la variacin de la energa de ionizacin
2. Propiedades elementos.
peridicas
de
los
Conceptos fsico-qumicos de importancia: - Potencial o energa o entalpa de ionizacin: (HI) se define como la energa requerida para desprender un electrn de un tomo en fase gaseosa. Se calcula del siguiente modo: Donde E(N) es la energa del sistema original (con sus N electrones) y E(N-1) es la energa del sistema catinico, es decir, con un electrn menos. - Electroafinidad: se define como la energa requerida para desprender un electrn de un anin en fase gaseosa. Se calcula del siguiente modo:
PI E ( N 1) E ( N ) H I
EA E ( N ) E ( N 1)
2. Propiedades elementos.
peridicas
de
los
Se suele confundir con la entalpa de electroafinidad (HEA), ya que la diferencia entre ambas es extremadamente sutil y en trminos prcticos, ambas se asocian a la diferencia energtica entre el tomo neutro y su respectivo anin.
H EA E ( N 1) E ( N ) EA
- Electronegatividad: se define como la capacidad de un tomo en una molcula para atraer electrones hacia s mismo.
Unidad 1
UPV Quimica I
3. Enlace inico y enlace covalente
Mecanismos bsicos de combinacin
Combinacin de los elementos
Las cargas opuestas se atraen Los electrones tienden a existir en pares Slo interactan los electrones de valencia
Gases nobles o inertes. Estos elementos no se combinan
En muchos casos, los elementos forman enlaces con el fin de adquirir la configuracin u ordenamiento electrnico de los gases nobles, es decir, los enlaces son una forma de ganar estabilidad energtica.
3. Enlace inico y enlace covalente
Principales tipos de enlace qumico Las diferentes interacciones electrnicas de los tomos al combinarse originan los siguientes tipos de enlaces qumicos:
Enlace
inico: Metal + No Metal (Ej.:sales y xidos metlicos) .
Se presenta entre los elementos representativos (extremos derecho e izquierdo de la tabla peridica)
Enlace
covalente: No Metal + No Metal (Ej.:agua, metano, metlico: Metal + Metal (Ej.:metales y aleaciones)
azcar, hidrocarburos y plsticos)
Enlace
3. Enlace inico y enlace covalente
Procedimiento:
1.
Estructuras de Lewis
2.
3.
Cada tomo se rodea de tantos electrones como lo indique el nmero de grupo al cual pertenece Los electrones se van colocando desapareadamente en torno al tomo La formacin de enlaces ocurre por la tendencia de los electrones desapareados a aparearse
Unidad 1
UPV Quimica I
3. Enlace inico y enlace covalente
Procedimiento:
1.
Estructuras de Lewis
2.
3.
Cada tomo se rodea de tantos electrones como lo indique el nmero de grupo al cual pertenece Los electrones se van colocando desapareadamente en torno al tomo La formacin de enlaces ocurre por la tendencia de los electrones desapareados a aparearse
Ejemplo:
Slidos Inicos: Su existencia se explica mediante la formacin de enlaces inicos los cuales se establecen entre elementos de los grupos 1 y 2 con los elementos de los grupos V, VI y VII. DESARROLLO : EJERCICIO TIPO CONTROL: Qu tipo de frmula corresponder para el compuesto que se forma entre calcio (grupo II) y flor (grupo VII)?
F: Grupo VII Ca: Grupo II xx x x xF xx -
7 electrones de valencia 2 electrones de valencia
Ca
+2
xx x x Fx xx
Reglas para escribir estructuras de Lewis se considera especie con carga elctrica neta q con n1 tomos diferentes al H y con n2 tomos de H i. Plantear el esqueleto de la molcula o in, identificando que tomos se conectan entre s. ii. Calcular V = el nmero total de electrones de valencia
Unidad 1
UPV Quimica I
Reglas para escribir estructuras de Lewis
Ejemplo:
Escribir la estructura de Lewis para el nitrato de cloro Cl-O-N(O) O q = 0; n1 = 5 ; n2 = 0 V = 1(7)Cl + 3(6)O + 1(5)N = 30 N = 8(5) + 2(0) - (30 - 0) = 10;
N/2 = 5; 3 enlaces simples y 1 enlace doble
Cl
O N O
OBSERVACIONES: enlace entre tomos no
metlicos idnticos se denomina covalente apolar; y si es entre no metlicos
distintos, el enlace es covalente polar.
Polaridad de enlace:
Cl
O N O
La suma de los momentos o polaridades de enlace en una molcula entrega el momento dipolar
Ejercicios de estructuras de Lewis
1.-) Explique, mediante estructuras de Lewis, la formacin del enlace entre Na (sodio, perteneciente al grupo I) y Cl (cloro perteneciente al grupo VII). qu tipo de enlace se forma, inico o covalente? Respuesta:
Na
Comentarios: Ambos elementos pertenecen a los extremos de la tabla peridica, adems uno es metal (Na) y el otro no metal (Cl), luego el tipo de enlace es inico. El sodio al ceder una carga elctrica negativa (electrn), se convierte en el catin sodio; el cloro al recibir esa carga elctrica negativa (electrn) se convierte en el anin cloruro. Cada elemento ha adquirido la configuracin del gas noble ms cercano en la tabla peridica. El Na+ tiene configuracin electrnica del nen (Ne) y el anin cloruro Cl- cloruro posee la configuracin electrnica del argn (Ar). Entre ambos tomos existe un par de electrones de enlace. Por ser sodio muy electropositivo, el par de electrones est muy inclinado hacia l, no hay comparticin de electrones de enlace.
Unidad 1
x x
x x
x x
Cl
x x
+ x x Na Cl x x x
UPV Quimica I
Ms ejercicios de estructuras de Lewis
2.-) Explique, mediante estructuras de Lewis, la formacin del enlace entre dos tomos de Cl (cloro, perteneciente al grupo VII), nmero atmico. qu tipo de enlace se forma, inico o covalente?cuntos electrones de enlace hay presentes en la molcula formada y cuntos electrones no enlazantes hay en ella? Respuesta:
Ambos tomos corresponden a un mismo tipo de tomo que pertenece al extremo derecho de la tabla peridica, adems este tomo es un no metal luego el tipo de enlace es covalente porque ambos tomos son no metales por lo tanto su diferencia de electroafinidad es cero. Como adems son tomos iguales, el enlace NO est polarizado hacia ninguno de los dos tomos, por lo tanto el enlace adems de ser covalente, es apolar. En la molcula formada hay 2 electrones enlazantes y 12 no enlazantes. Esta es la molcula de cloro y se simboliza como Cl2 porque est conformada por 2 tomos de cloro.
se podra haber resuelto el problema anterior de una manera ms sistemtica y no tan intuitiva? La respuesta es s. Mediante la siguiente frmula: N= 8n1+2n2-(V-q) N : nmero de electrones compartidos (o electrones enlazantes); n1 : nmero de tomos distintos al hidrgeno; n2 : nmero de tomos de hidrgeno; V : nmero total de electrones de valencia q : carga elctrica de la molcula formada. El nmero 8 se debe a la aplicacin de la regla del octeto y el nmero 2 se debe a la aplicacin de la regla del dueto para el hidrgeno. Luego para la molcula anterior (Cl2) tenemos que se trata de una molcula neutra, sin tomos de hidrgeno y formada por dos tomos de oxgeno, luego:
q = 0; n1 = 2 ; n2 = 0 V = 2(7)Cl = 14 N = 8(2) +2(0) - (14 - 0) = 2 (estos son los dos electrones enlazantes) N/2 = 1; (1 enlace simple) Por lo tanto posee 14-2 = 12 electrones no enlazantes.
Ms ejercicios de estructuras de Lewis
3.-) Explique, mediante estructuras de Lewis, la formacin del enlace entre los tomos que conforman el dixido de carbono, uno de los gases principalmente responsables del llamado Efecto Invernadero. DATOS: carbono, perteneciente al grupo IV y oxgeno, pertenece al grupo VI. Qu tipo de enlace se forma, inico o covalente?cmo es cada enlace, covalente polar o covalente apolar? o es inico? es esta molcula polar o apolar? Justifique su respuesta. Como dato adicional, considere que los tomos de esta molcula se muestran dispuestos espacialmente de la siguiente manera:
O C
Unidad 1
x x
x x
Cl
x x
Cl
x x
Cl
x x
Cl
x x
10
UPV Quimica I
DESARROLLO DE LA RESPUESTA: Al igual que antes, se colocan los electrones de valencia en un nmero igual del grupo al cual pertenece cada tomo en la tabla peridica:
Los electrones desapareados de un tomo se unirn a los desapareados del otro. Apliquemos la frmula recin vista para resolver este sistema molecular ms complejo:
q = 0; n1 = 3 ; n2 = 0 V = 2(6)Cl +1(4)C N = 8(3)+2(0) - (16 - 0) N/2 = 4; (4 enlaces) Por lo tanto posee 16-8 = 8 electrones no enlazantes. ser cierto? Procedemos entonces a comprobar esta respuesta llevando a cabo una construccin de los diagramas de Lewis para esta molcula. = 16 = 8
Los electrones desapareados de un tomo se unirn a los desapareados del otro tomo. La secuencia a seguir es:
Como puede observarse, primero nos preocupamos de aparear un par de tomos. En este ejemplo, hemos decidido aparear los tomos del lado izquierdo.
y el mismo procedimiento es aplicado para aparear el par de tomos del lado derecho. Puede observarse que existen 8 electrones enlazantes y 8 electrones no enlazantes. Justo son los nmeros que fueron predichos que encontraramos con la frmula matemtica aprendida.
Naturalmente existe una manera ms simplificada de dibujar esta estructura o diagrama de Lewis. Consiste en reemplazar cada pareja de electrones (enlazantes y no enlazantes) por una raya sencilla. En el caso del CO2 tenemos entonces:
Como puede verificarse, hay 8 electrones enlazantes y 8 no enlazantes.
A su vez, la notacin de rayitas para parejas de electrones permite suprimir los pares electrnicos no enlazantes.
Unidad 1
x xC x
11
UPV Quimica I
Esta molcula est formada por dos tipos de tomos: carbono, C y oxgeno, O. como ambos son no metales, los enlaces que existen entre estos tomos son de naturaleza covalente. Siendo el oxgeno ms electronegativo que el carbono, entonces los electrones enlazantes estarn ms inclinados a estar cerca del oxgeno que del carbono, por lo tanto cada enlace carbono - oxgeno estar polarizado hacia el oxgeno y en consecuencia cada uno de estos enlaces se clasificar como covalente polar. Las flechas rojas simbolizan los momentos de enlaces:
Luego habr una carga parcial negativa sobre cada tomo de oxgeno y una carga parcial positiva sobre el tomo de carbono:
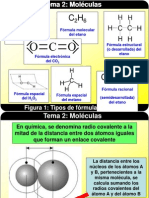
Al sumar los momentos de enlace, la resultante para el momento dipolar es cero, porque los dos vectores de momento de enlace estn la misma direccin, tienen el mismo mdulo, pero apuntan en sentidos opuestos. Este tipo de frmula con rayas para electrones enlazantes se denomina frmula molecular desarrollada
4. Masas atmicas y moleculares
Los elementos en la tabla peridica estn ordenados por nmero atmico no por masa atmica como pretendi hacerlo inicialmente Medeleev. Errneamente usamos la palabra peso para referirnos a la masa de algo, pero en realidad lo que se mida en la balanza es la masa, la cual es una cantidad escalar; el peso es una fuerza (cantidad vectorial) y por lo tanto, adems de una magnitud y unidad, requiere de una direccin y sentido para poder describir completamente una fuerza. La masa, mal llamada peso, se puede entender como el cuociente entre el peso y la aceleracin de gravedad. La masa es una medida entonces de la inercia.
4. Masas atmicas y moleculares
Por lo tanto cuando nos referimos a pesos atmicos en realidad estamos hablando de masas atmicas y ese ser el concepto que aprenderemos a usar frecuentemente. Con frecuencia al observar una tabla peridica, veremos que la masa se expresa en u.m.a. (unidades de masa atmica). En otras tablas, nos encontramos con la sorpresa que la masa atmica se expresa en unidades de g/mol, pero el nmero sigue siendo el mismo ! La unidad g/mol es de mayor utilidad pues permite conectar el mundo de lo muy pequeo (escala atmica) con el mundo de lo grande (nuestra escala).
Unidad 1
12
UPV Quimica I
4. Masas atmicas y moleculares
Habiendo explicado lo anterior, habr entonces una tercera y ms general forma de denominar a las masas atmicas y esa manera es la masa molar (atmica). La masa molar de un tomo no es otra cosa que la cantidad de masa expresada en gramos de un mol de tomos de un mismo elemento. Recordemos que un elemento es una sustancia pura formada por tomos del mismo tipo (ejemplo, barra de cobre; gas helio, etc.). En estequiometra aprenderemos ms sobre la unidad mol, por ahora nos ser suficiente saber que un mol es simplemente una cantidad fija de algo y cuyo nmero es 6,0221023:
4. Masas atmicas y moleculares
Cuando veamos en la tabla peridica que la masa atmica (o masa molar) del sodio (Na) es 22,99, eso en realidad significa que un mol de tomos de sodio marcar en una balanza 22,99 gramos. Si se nos pidiera calcular cunto es la masa de UN TOMO DE SODIO, desde un punto de vista prctico sera imposible de medirla ya que no habra una balanza que detectase una masa tan pequea, sin embargo sabiendo la masa molar podremos calcular la masa del tomo de sodio:
22,99 g mol
mol 6,0221023 t Na
1 t Na =
3,18210-23 g
4. Masas atmicas y moleculares
Como se pudo comprobar, la masa de un tomo de sodio es muy baja e imposible de medir, sin embargo fue igualmente posible de calcular. El uso de factores de conversin de unidades ser una actividad extremadamente comn no solo en qumica sino de la ingeniera en s.
Unidad 1
13
UPV Quimica I
RECUENTO La regla del octeto es en realidad una excepcin ya que la mayora de los elementos de la tabla peridica no la cumplen. Sin embargo, una enorme cantidad de compuestos muy comunes estn elaborados, natural o sintticamente de elementos pertenecientes a las dos primeras filas de la tabla peridica, en ellos es comn verificar que los elementos distintos al hidrgeno se tienden a rodear de 8 electrones en su capa ms externa a fin de conseguir la misma configuracin electrnica del gas noble ms cercano, ya que en el fondo lo que busca todo elemento al combinarse es la estabilidad energtica y los elementos ms estables son los que poseen configuracin de gases nobles.
RECUENTO El caso del hidrgeno es distinto: l tiende a adquirir la configuracin del gas noble ms cercano correspondiente al helio y en ese caso el nmero de electrones del cual se tiende a rodear es 2 razn por la cual se le denomina regla del dueto. Se puede afirmar que toda la qumica del carbono (qumica orgnica) cumple con la regla del octecto, sin embargo, muchos compuestos pertenecientes a la qumica inorgnica, en particular formados a partir de metales de transicin no cumplen con esta regla siendo en realidad ella misma una excepcin para el comportamiento qumico de la mayora de los elementos de la tabla peridica.
EJERCICIOS:
1.-) Dibuje el diagrama de Lewis del acetonitrilo, compuesto usado como disolvente en la industria farmacutica y en la fabricacin de pelculas para fotografa. Deduzca la frmula molecular desarrollada. Clasifique el enlace carbono-carbono y el enlace carbono-nitrgeno,cuntos electrones enlazantes hay entre el tomo de nitrgeno y su tomo de carbono directamente unido a l?la molcula es polar o apolar? En otras palabras, posee momento dipolar? Datos: nitrgeno pertenece al grupo V y carbono al VI.
Respuesta: enlace carbono-carbono es covalente apolar, enlace carbono-nitrgeno covalente ligeramente polar (ambos no difieren demasiado en sus electronegatividades). Entre C y N existen 6 electrones enlazantes. La molcula es polar.
Unidad 1
14
UPV Quimica I
2.-) Dibuje el diagrama de Lewis del tetrafluoroetileno, molcula empleada como materia prima para la fabricacin del tefln. Clasifique el enlace carbono-carbono y el enlace carbonoflor,cuntos electrones enlazantes hay entre cada tomo de flor y su tomo de carbono directamente unido a l?, cuntos electrones no enlazantes hay en toda esta molcula?cuntos electrones enlazantes se encuentran entre los dos tomos de carbono?la molcula es polar o apolar? Datos: flor pertenece al grupo VII y carbono al VI
Respuesta: enlace carbono-carbono es covalente apolar, enlace carbono-flor covalente polar (electrones enlazantes inclinados hacia el flor). Entre cada F y su respectivo C hay 2 electrones enlazantes. Hay 24 electrones no enlazantes. Entre los dos tomos de carbono hay 4 electrones enlazantes. Si bien la molcula posee 4 enlaces covalentes polares, la suma de esos momentos de enlace resulta ser cero por lo tanto la molcula en s es apolar (es decir, su momento dipolar es cero).
3.-) Dibuje el diagrama de Lewis para la acrolena, molcula empleada para la fabricacin de ciertos plsticos. cul es el enlace ms polar en esta molcula?, cuntos electrones enlazantes hay entre el tomo de oxgeno y el tomo de carbono directamente unido a l?, cuntos electrones no enlazantes hay en toda esta molcula?cuntos electrones enlazantes posee esta molcula? la molcula es polar o apolar? Datos: oxgeno pertenece al grupo VI, carbono al VI e hidrgeno al I.
Respuesta: El enlace carbono-oxgeno es el ms polar. Entre O y su respectivo C vecino hay 4 electrones enlazantes. Hay 4 electrones no enlazantes en toda la molcula y 18 electrones enlazantes. La molcula en s es polar.
EJERCICIOS propuestos a partir del texto Qumica por Raymond Chang. 10 edicin.Editorial McGraw-Hill, 2010
Pginas Ejercicios 401 402 403 404 405 9.44 9.74 9.92 9.102 9.122 a.-) 9.46 9.76 9.118 9.124 9.48
Unidad 1
15
You might also like
- DocxDocument2 pagesDocxJonny Santiago Gómez100% (3)
- OsazonasDocument4 pagesOsazonasLeón Guillermo Mondragón CarbajalNo ratings yet
- Dinamica de Las Particular PDFDocument19 pagesDinamica de Las Particular PDFJose Luis MoncadaNo ratings yet
- NCh0382 1998 PDFDocument229 pagesNCh0382 1998 PDFMonica BarrientosNo ratings yet
- 1 Fundamentos Ergonomia PDFDocument28 pages1 Fundamentos Ergonomia PDFJose Luis Moncada100% (1)
- Aseguramiento en NieveDocument10 pagesAseguramiento en NieveJose Luis MoncadaNo ratings yet
- 3 NQPQ Procesos Quimicos InduDocument17 pages3 NQPQ Procesos Quimicos InduJose Luis MoncadaNo ratings yet
- Aceros PDFDocument36 pagesAceros PDFFranklin PetitNo ratings yet
- Analisis Del VinoDocument84 pagesAnalisis Del VinoJose Luis Moncada100% (2)
- Estructura de Compuestos QuimicosDocument2 pagesEstructura de Compuestos QuimicosMash_marialeNo ratings yet
- 2da. Parte de Quimica)Document16 pages2da. Parte de Quimica)marggv82No ratings yet
- Fuerzas IntermolecularesDocument71 pagesFuerzas IntermolecularesCamyBorsiniNo ratings yet
- Formulación Inorgánica 2015-16Document48 pagesFormulación Inorgánica 2015-16Claudio Miranda PintoNo ratings yet
- Introducción A La Química Del Carbono-Dra Irma Rumela Aguirre ZaquinaulaDocument20 pagesIntroducción A La Química Del Carbono-Dra Irma Rumela Aguirre ZaquinaulaIrma AZNo ratings yet
- 05 Alquenos y AlquinosDocument27 pages05 Alquenos y Alquinosorlando paezNo ratings yet
- Trabajo Autonomo 1 OkDocument5 pagesTrabajo Autonomo 1 OkJoseLuisPoncRamir0% (1)
- Libro - QuimicaDocument526 pagesLibro - QuimicaRoberto Regidor Rincón100% (2)
- Quimica de Coordinacion FinalDocument76 pagesQuimica de Coordinacion FinalDiego Hard CoreNo ratings yet
- Unidad 4 Bonos y ObligacionesDocument18 pagesUnidad 4 Bonos y ObligacionesLETICIA ALVAREZ0% (1)
- Administración 14ed Harold Koontz Weihrich y CanniceDocument55 pagesAdministración 14ed Harold Koontz Weihrich y CanniceDARIONo ratings yet
- Quimica InorganicaDocument28 pagesQuimica InorganicaGeorge AdivinaNo ratings yet
- Tarea 1 qm2427-2007 PDFDocument2 pagesTarea 1 qm2427-2007 PDFGabrielaNo ratings yet
- Sintesis y Estudio de Isomeros de Enlace PDFDocument14 pagesSintesis y Estudio de Isomeros de Enlace PDFjacobo galicinoNo ratings yet
- Condensación AldólicaDocument10 pagesCondensación AldólicaRed_Eyes_Dragon24100% (1)
- Hidrolisis SalesDocument7 pagesHidrolisis Salesfrankys200No ratings yet
- Compuestos de CoordinaciónDocument19 pagesCompuestos de CoordinaciónSAMANTANo ratings yet
- Quimica 10 Quimica OrganicaDocument8 pagesQuimica 10 Quimica OrganicaEdwin Cirilo ChaucaNo ratings yet
- Alquenos y AlquinosDocument22 pagesAlquenos y AlquinosIsmael De CarliniNo ratings yet
- Lista de Algunos Reactivos Que Reaccionan Con Compuestos OrgánicosDocument2 pagesLista de Algunos Reactivos Que Reaccionan Con Compuestos OrgánicosKui ISabel Guerra0% (1)
- Nomenclatura QuimicaDocument33 pagesNomenclatura QuimicaCesar MenesesNo ratings yet
- Tarea Modulo 5Document6 pagesTarea Modulo 5Rouss BogranNo ratings yet
- Aporte IndividualDocument4 pagesAporte Individualraul cabreraNo ratings yet
- Estructura LewisDocument10 pagesEstructura LewisArturo VelascoNo ratings yet
- Anillos de 4 EslabonesDocument7 pagesAnillos de 4 Eslabonesapi-272198662No ratings yet
- 2.-Laboratorio 3 Bonos La Angustia, S.A. RESOLUCIONDocument5 pages2.-Laboratorio 3 Bonos La Angustia, S.A. RESOLUCIONKIMBERLI YASMIN PEREZ CASTAÑONNo ratings yet
- SN 2017IQ S PDFDocument30 pagesSN 2017IQ S PDFAlexisEstradaNo ratings yet
- MoleculasDocument78 pagesMoleculasAdriana González JuárezNo ratings yet