Professional Documents
Culture Documents
Física y Química 4º Eso T11. El Atomo
Uploaded by
fco_josenicolasOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Física y Química 4º Eso T11. El Atomo
Uploaded by
fco_josenicolasCopyright:
Available Formats
TEMA 11 EL TOMO
F Y Q 4 ESO
T11. EL TOMO Y SUS ENLACES
Ao Cientfico
Descubrimientos experimentales Durante el s.XVIII y principios del XIX algunos cientficos haban investigado distintos aspectos de las reacciones qumicas, obteniendo las llamadas leyes clsicas de la Qumica. Modelo atmico La imagen del tomo expuesta por Dalton en su teora atmica, para explicar estas leyes, es la de minsculas partculas esfricas, indivisibles e inmutables, iguales entre s en cada elemento qumico.
1808
John Dalton
Demostr que dentro de los tomos hay unas partculas diminutas, con carga elctrica negativa, a las que se llam electrones. De este descubrimiento dedujo que el tomo deba de ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones. (Modelo atmico de Thomson.)
1897
J.J. Thomson
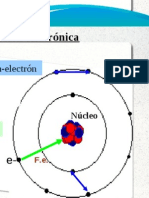
Demostr que los tomos no eran macizos, como se crea, sino que estn vacos en su mayor parte y en su centro hay un diminuto ncleo. Dedujo que el tomo deba estar formado por una corteza con los electrones girando alrededor de un ncleo central cargado positivamente. (Modelo atmico de Rutherford.)
1911
E. Rutherford
Propuso un nuevo modelo atmico, segn el cual los electrones giran alrededor del ncleo en unos niveles de energa designados con la letra n = 1, 2, Cuando un electrn pasa de un nivel de energa superior a uno inferior se emite un fotn. (Modelo atmico de Bohr.)
1913
Espectros atmicos discontinuos originados por la radiacin emitida por los tomos excitados de los elementos en estado gaseoso.
Niels Bohr
Partcula (smbolo) protn (p o p+) neutrn (n o no) electrn (e-)
Radio del tomo = 10
-10
Ubicacin
Masa aproximada (uma)
Carga (C)
Ncleo Ncleo Corteza
1 1 1/1800
-15
+1,610-19 0 -1,610-19
-27
1 u.m.a. (unidad de masa atmica) = 1,6610 m = 1 (Amstrong) Radio del ncleo atmico = 10 - 10
-14
Kg
Nmero atmico (Z): nmero de protones (=nmero de electrones en un tomo neutro) Nmero msico (A): suma del nmero de protones y de neutrones A = Nmero de protones + Nmero de neutrones A = Z + Nmero de neutrones
Istopos: tomos con el mismo nmero de protones (igual Z) y distinto nmero de neutrones (distinto A) Masa atmica de un tomo con varios istopos 1, 2, :
La configuracin electrnica de un tomo La configuracin electrnica en la corteza de un tomo es la distribucin de sus electrones en los distintos niveles y orbitales. Los electrones se van situando en los diferentes niveles y subniveles por orden de energa creciente hasta completarlos. Es importante saber cuntos electrones existen en el nivel ms externo de un tomo pues son los que intervienen en los enlaces con otros tomos para formar compuestos. Aunque los conocimientos actuales sobre la estructura electrnica de los tomos son bastante complejos, las ideas bsicas son las siguientes: 1. Existen 7 niveles de energa o capas donde pueden situarse los electrones, numerados del 1, el ms interno, al 7, el ms externo. 2. A su vez, cada nivel tiene sus electrones repartidos en distintos subniveles, que pueden ser de cuatro tipos: s, p, d, f. 3. En cada subnivel hay un nmero determinado de orbitales que pueden contener, como mximo, 2 electrones cada uno. As, hay 1 orbital tipo s, 3 orbitales p, 5 orbitales d y 7 del tipo f. De esta forma el nmero mximo de electrones que admite cada subnivel es: 2 en el s; 6 en el p (2 electrones x 3 orbitales); 10 en el d (2 x 5); 14 en el f (2 x 7). La distribucin de orbitales y nmero de electrones posibles en los 4 primeros niveles se resume en la siguiente tabla: Niveles de energa Subniveles Nmero de orbitales de cada tipo Denominacin de los orbitales Nmero mximo de electrones en los orbitales Nmero mximo de electrones por nivel 1 s 1 1s 2 2 2 sp 13 2s 2p 2-6 8 3 spd 135 3s 3p 3d 2 - 6 - 10 18 4 spdf 1357 4s 4p 4d 4f 2- 6- 10- 14 32
Orden de llenado de orbitales electrnicos y ltimo electrn esperado en la tabla peridica.
Ejemplo: la configuracin electrnica del vanadio (Z=23), con el diagrama obtenemos 1s 2s 2p 3s 3p 4s 3d (2 + 2 + 6 + 2 + 6 + 2 + 3 = 23 electrones) En la prctica, para simplificar la notacin, los niveles de energa completos se indican con la referencia al gas noble correspondiente (el de nmero atmico inmediatamente menor) al que se aade la distribucin de electrones en el nivel no completo. En el caso del vanadio: Gas noble precendente: 18 Ar: 1s 2s 2p 3s 3p
2 2 2 6 2 6 2 2 6 2 6 2 3
Configuracin elctrnica del vanadio: [Ar] 4s 3d
1
Excepciones: El cobre tiene una estructura electrnica 4s 3d en vez de la esperada 4s 3d . La razn de ello es que a las fuerzas de atraccin entre los protones del ncleo y los electrones, se aade la interferencia de las capas electrnicas interiores que resulta en una desviacin de los niveles de energa del ltimo electrn aadido y por tanto una configuracin electrnica ms estable distinta de la esperada.
10
You might also like
- ÁTOMODocument33 pagesÁTOMOAlfredo Hernandez OrtizNo ratings yet
- Química 4to: Estructura Atómica 2010Document5 pagesQuímica 4to: Estructura Atómica 2010Eduardo Genini100% (1)
- Configuración O Distribución ElectrónicaDocument7 pagesConfiguración O Distribución ElectrónicasantiagoariaseduardomeraNo ratings yet
- Los Elementos Químicos y La Tabla PeriódicaDocument12 pagesLos Elementos Químicos y La Tabla PeriódicaLaura Gemma Rodríguez PastorNo ratings yet
- Componentes del átomo y sus característicasDocument30 pagesComponentes del átomo y sus característicasnicNo ratings yet
- Guia Teoria Atómica - 02-2023 WVRCDocument22 pagesGuia Teoria Atómica - 02-2023 WVRCElena PerezNo ratings yet
- Orbitales, Num CuanticoDocument35 pagesOrbitales, Num CuanticoDebora GarciaNo ratings yet
- El Átomo y Su Estructura - INFODocument3 pagesEl Átomo y Su Estructura - INFOGufjfu YxyxyxyyNo ratings yet
- Examen resuelto de Física y Química 3o ESO sobre el modelo atómico de Dalton y RutherfordDocument2 pagesExamen resuelto de Física y Química 3o ESO sobre el modelo atómico de Dalton y RutherfordteresaNo ratings yet
- Guía de QuímicaDocument17 pagesGuía de QuímicaJonathan Xavier Alvarez CariñoNo ratings yet
- El Átomo. Estructura. Número Atómico y Masa Atómica. Isotopos. Modelos Atómicos. Radiación Electromagnética. Problemas de Aplicación.Document55 pagesEl Átomo. Estructura. Número Atómico y Masa Atómica. Isotopos. Modelos Atómicos. Radiación Electromagnética. Problemas de Aplicación.waldir marcelinoNo ratings yet
- Qui123!1!2015 - Clase Hasta Estructura LewisDocument117 pagesQui123!1!2015 - Clase Hasta Estructura LewisAdriana Toro RosalesNo ratings yet
- Estructura Atomica y Tabla Periódica PDFDocument35 pagesEstructura Atomica y Tabla Periódica PDFMartin MaddalenaNo ratings yet
- Química - Propiedades Periódicas de Los Elementos.Document23 pagesQuímica - Propiedades Periódicas de Los Elementos.Noel MatíasNo ratings yet
- Origen de La Teoría AtómicaDocument10 pagesOrigen de La Teoría Atómicamaria bayonaNo ratings yet
- Unidad 2Document11 pagesUnidad 2julietaaleromero629No ratings yet
- Tarea QuimicaDocument14 pagesTarea Quimicamigulchacon5No ratings yet
- Tercer Taller Quimica Decimos QUIMICADocument11 pagesTercer Taller Quimica Decimos QUIMICAMaria Ortiz ArandaNo ratings yet
- PAUEstructura EsDocument9 pagesPAUEstructura EsIGNACIONo ratings yet
- Estructura Atomica QGDocument19 pagesEstructura Atomica QGAntony YrigoinNo ratings yet
- Tema 1. El Átomo y El Sistema PeriódicoDocument8 pagesTema 1. El Átomo y El Sistema PeriódicoVictor Del Campo PerezNo ratings yet
- Teoría Atómica Guía QuímicaDocument7 pagesTeoría Atómica Guía QuímicaDiokerly MéndezNo ratings yet
- Naturaleza Electrica de La MateriaDocument5 pagesNaturaleza Electrica de La MateriaMarioSeverichZuritaNo ratings yet
- Tema 3 Fyq3ºDocument7 pagesTema 3 Fyq3ºalexia. bqzzzNo ratings yet
- Actividad de La Unidad 1. 1. Indica Las Configuraciones Electrónicas Que No Son PosiblesDocument9 pagesActividad de La Unidad 1. 1. Indica Las Configuraciones Electrónicas Que No Son PosiblesBryanDelgado100% (4)
- Guía N°2 Configuración Electrónica: Universidad Católica Del Norte - Facultad de Ciencias - Departamento de QuímicaDocument9 pagesGuía N°2 Configuración Electrónica: Universidad Católica Del Norte - Facultad de Ciencias - Departamento de Química5211241No ratings yet
- El Átomo y Su EstructuraDocument5 pagesEl Átomo y Su EstructurashofitanindaNo ratings yet
- Estructura Atómica y Tabla PeriódicaDocument96 pagesEstructura Atómica y Tabla Periódicaabril fondevilaaNo ratings yet
- Quimica Textos 2020 Unidades-1-4Document52 pagesQuimica Textos 2020 Unidades-1-4Leonel NoyaNo ratings yet
- Trabajo Practico de Quimica 6Document11 pagesTrabajo Practico de Quimica 6AxelMartinNo ratings yet
- Que Es El AtomoDocument10 pagesQue Es El AtomoDavidCovicNo ratings yet
- TEORICO PRACTICO #1 Estructura AtomicaDocument10 pagesTEORICO PRACTICO #1 Estructura AtomicaAlejandro RiosNo ratings yet
- Wiener Estructura Atomica Clase 2 2014 IDocument51 pagesWiener Estructura Atomica Clase 2 2014 IOmar Velasquez AtahuaNo ratings yet
- U 1 Estructura Atómica y Tabla Periódica PDFDocument10 pagesU 1 Estructura Atómica y Tabla Periódica PDFJoão HenriqueNo ratings yet
- QUIMICADocument33 pagesQUIMICAAndres MorenoNo ratings yet
- EL ATOMO PresentaciónDocument40 pagesEL ATOMO PresentaciónDanny ParedesNo ratings yet
- Modelo Mecánico CuánticoDocument5 pagesModelo Mecánico CuánticoRuth Monica Colipi JaraNo ratings yet
- Unidad N°1 Parte A - 3º Año A 2023Document5 pagesUnidad N°1 Parte A - 3º Año A 2023Leandro SagerNo ratings yet
- Atomo - Configuración Electrónica y TablaDocument6 pagesAtomo - Configuración Electrónica y Tablamaria1No ratings yet
- Estructura MateriaDocument8 pagesEstructura MateriaMiguel Angel Criado AlonsoNo ratings yet
- Estructira Del AtomoDocument11 pagesEstructira Del AtomoCristhian Yaranga ÑañaNo ratings yet
- Quimica General I Volumen 2007Document21 pagesQuimica General I Volumen 2007biologorogerNo ratings yet
- Configuración Electrónica. Sistema Periódico. Propiedades PeriódicasDocument64 pagesConfiguración Electrónica. Sistema Periódico. Propiedades PeriódicasIgnacio Vidal VergaraNo ratings yet
- Estructura Atomica PDFDocument6 pagesEstructura Atomica PDFMaricielo Bejarano PintadoNo ratings yet
- QuimicaDocument21 pagesQuimicaDylan Alcaraz MejíaNo ratings yet
- Estructura AtómicaDocument11 pagesEstructura AtómicaAMYNNXXXXNo ratings yet
- Química - Estructura AtómicaDocument5 pagesQuímica - Estructura AtómicaCesar Rozas FormandoyNo ratings yet
- Quimica DuvanDocument9 pagesQuimica DuvanDiego BoadaNo ratings yet
- Modelos Atomicos ResumenDocument43 pagesModelos Atomicos Resumensocorrovergaraa86% (71)
- Atomos Imprimir Todo PDFDocument7 pagesAtomos Imprimir Todo PDFMartin Gustavo Sanchez ReynosoNo ratings yet
- Estructura Atomica 2019 PDFDocument104 pagesEstructura Atomica 2019 PDFSeba MolinaNo ratings yet
- 1.1 - Átomo y TPDocument14 pages1.1 - Átomo y TPYeferson Anchari HuancaNo ratings yet
- QuimicaDocument29 pagesQuimicaIs Morales0% (1)
- Semana 3 - Configuracion ElectronicaDocument39 pagesSemana 3 - Configuracion ElectronicaCARMEN ROSA YARLEQUE MEJIANo ratings yet
- 1 1 Estructura Materia ADocument42 pages1 1 Estructura Materia AToni Vives BalaguerNo ratings yet
- Tarea de QumicaDocument5 pagesTarea de QumicaAneudis JavierNo ratings yet
- El Atomo y Enlaces QuimicosDocument8 pagesEl Atomo y Enlaces QuimicosAna lopezNo ratings yet
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaFrom EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaNo ratings yet
- Ejercicios HTML.2Document4 pagesEjercicios HTML.2fco_josenicolasNo ratings yet
- Ejercicios HTML.1Document2 pagesEjercicios HTML.1fco_josenicolasNo ratings yet
- EXCEL Estadistica Unidimensional.Document5 pagesEXCEL Estadistica Unidimensional.fco_josenicolasNo ratings yet
- Documental Comprar, Tirar, ComprarDocument1 pageDocumental Comprar, Tirar, Comprarfco_josenicolasNo ratings yet
- Prueba Excel 2007 EstadísticaDocument1 pagePrueba Excel 2007 Estadísticafco_josenicolasNo ratings yet
- Prueba Word 2007 Informática 4ºDocument2 pagesPrueba Word 2007 Informática 4ºfco_josenicolasNo ratings yet
- Estadística Con Excel 2007 PDFDocument1 pageEstadística Con Excel 2007 PDFfco_josenicolasNo ratings yet
- Apuntes HTML.2Document4 pagesApuntes HTML.2fco_josenicolasNo ratings yet
- Apuntes HTML.1 PDFDocument3 pagesApuntes HTML.1 PDFfco_josenicolas100% (1)
- EXCEL Estadística BidimiensionalDocument4 pagesEXCEL Estadística Bidimiensionalfco_josenicolasNo ratings yet
- U1 El Sistema OperativoDocument2 pagesU1 El Sistema Operativofco_josenicolasNo ratings yet
- U2 Redes de OrdenadoresDocument2 pagesU2 Redes de Ordenadoresfco_josenicolasNo ratings yet
- Prueba Word 2007 Informática 4ºDocument2 pagesPrueba Word 2007 Informática 4ºfco_josenicolasNo ratings yet
- Documental La Edad de La Ignorancia IDocument1 pageDocumental La Edad de La Ignorancia Ifco_josenicolasNo ratings yet
- Video Las 3RDocument1 pageVideo Las 3Rfco_josenicolasNo ratings yet
- Exposición Las Tr3s R AlumnosDocument2 pagesExposición Las Tr3s R Alumnosfco_josenicolasNo ratings yet
- Glaciares de Los PirineosDocument1 pageGlaciares de Los Pirineosfco_josenicolasNo ratings yet
- Prácticas Word 2007Document6 pagesPrácticas Word 2007fco_josenicolasNo ratings yet
- T1. A8-23Document3 pagesT1. A8-23fco_josenicolasNo ratings yet
- T1.P8 Comprueba El Estado Tu Sistema OperativoDocument4 pagesT1.P8 Comprueba El Estado Tu Sistema Operativofco_josenicolasNo ratings yet
- Línea de Comandos Help:: T1. El Sistema OperativoDocument2 pagesLínea de Comandos Help:: T1. El Sistema Operativofco_josenicolasNo ratings yet
- T1.P8 Comprueba El Estado Tu Sistema OperativoDocument4 pagesT1.P8 Comprueba El Estado Tu Sistema Operativofco_josenicolasNo ratings yet
- Programación INFORMÁTICA 4º ESODocument1 pageProgramación INFORMÁTICA 4º ESOfco_josenicolasNo ratings yet
- T1. A1-7Document1 pageT1. A1-7fco_josenicolasNo ratings yet
- P2. Realiza Tareas Comunes Con Carpetas: T1. El Sistema OperativoDocument1 pageP2. Realiza Tareas Comunes Con Carpetas: T1. El Sistema Operativofco_josenicolasNo ratings yet
- Reacciones QuimicasDocument19 pagesReacciones QuimicasmicaelaaaaaaaaaNo ratings yet
- Línea de Comandos Help:: T1. El Sistema OperativoDocument2 pagesLínea de Comandos Help:: T1. El Sistema Operativofco_josenicolasNo ratings yet
- P1. Actualiza Tu Sistema OperativoDocument1 pageP1. Actualiza Tu Sistema Operativofco_josenicolasNo ratings yet
- Programación ÁMBITO CIENTÍFICO TECNOLÓGICO 4ºDocument1 pageProgramación ÁMBITO CIENTÍFICO TECNOLÓGICO 4ºfco_josenicolasNo ratings yet
- Actividades Geogebra3Document23 pagesActividades Geogebra3fco_josenicolasNo ratings yet
- Caso LeasingkDocument3 pagesCaso LeasingkLiseth NonajulcaNo ratings yet
- Psicología Del Aprendizaje - Sem 2Document54 pagesPsicología Del Aprendizaje - Sem 2Sueños de LunaNo ratings yet
- Canasta de Bienes Que Le Permita Obtener El Mayor Grado de Satisfacción Posible A Partir de Su Presupuesto de ConsumoDocument1 pageCanasta de Bienes Que Le Permita Obtener El Mayor Grado de Satisfacción Posible A Partir de Su Presupuesto de ConsumodianaNo ratings yet
- Infección UrinariaDocument18 pagesInfección UrinariaPaola JimenezNo ratings yet
- Cuestionario CompletoDocument6 pagesCuestionario CompletoSarai EspinozaNo ratings yet
- Agua pura con luz solarDocument4 pagesAgua pura con luz solar120984No ratings yet
- RectificadoresDocument7 pagesRectificadoresEmanuel SuarezNo ratings yet
- Boletín - Oficial - 2.011 01 14 ContratacionesDocument16 pagesBoletín - Oficial - 2.011 01 14 ContratacionesalejandrorfbNo ratings yet
- Aerodinamica FCD 1Document6 pagesAerodinamica FCD 1Rolando RivasNo ratings yet
- Los Indicadores y Su Construccion RizoDocument15 pagesLos Indicadores y Su Construccion RizoAdriana Escalante RojanoNo ratings yet
- Dispositivos InformaticosDocument18 pagesDispositivos InformaticosClaudio R. MartínezNo ratings yet
- Rubrica para Evaluar Investigacin en WordDocument1 pageRubrica para Evaluar Investigacin en Wordapi-257093331No ratings yet
- Proyecto Modular Probabilidad y EstaDocument6 pagesProyecto Modular Probabilidad y EstaHeidi BahenaNo ratings yet
- Appolbook FINALDocument143 pagesAppolbook FINALCristian OrtizNo ratings yet
- Maq. Min 23 - Sem 2 - Equipos de Carga para Minería Subterránea ConvencionalDocument45 pagesMaq. Min 23 - Sem 2 - Equipos de Carga para Minería Subterránea ConvencionalAngelo David Reyes GamarraNo ratings yet
- Pruebas de Bondad y AjusteDocument4 pagesPruebas de Bondad y AjusteFernando Solís LeónNo ratings yet
- Actividad 2. Conceptos Fundamentales.Document5 pagesActividad 2. Conceptos Fundamentales.Andrea SantacruzNo ratings yet
- Comprobacion de Desgaste en El MotorDocument35 pagesComprobacion de Desgaste en El MotorMoises Garcia80% (5)
- Guia Ciclo Iii Unidades de Longitud - MetroDocument4 pagesGuia Ciclo Iii Unidades de Longitud - MetrowilsonNo ratings yet
- Definición de Eficiencia: Optimizar Recursos para Lograr MetasDocument3 pagesDefinición de Eficiencia: Optimizar Recursos para Lograr MetasRosa Luz Chavez Lopez86% (7)
- Ayudantía N°3.1 - Ing PDFDocument1 pageAyudantía N°3.1 - Ing PDFsdfghfgmjhfgdfdsNo ratings yet
- Res 412 2000Document9 pagesRes 412 2000lisethmcNo ratings yet
- El Mundo Era Tan Reciente, Que Muchas Cosas Carecían de Nombre, y para Mencionarlas Había Que Señarlarlas Con El Dedo.-Cien Años de Soledad de Gabriel García Marquez.Document2 pagesEl Mundo Era Tan Reciente, Que Muchas Cosas Carecían de Nombre, y para Mencionarlas Había Que Señarlarlas Con El Dedo.-Cien Años de Soledad de Gabriel García Marquez.Ross GallegosNo ratings yet
- I - Carga Eléctrica Ley de Coulomb y Principio de Conservacion de La CargaDocument6 pagesI - Carga Eléctrica Ley de Coulomb y Principio de Conservacion de La Cargaanavarro100% (31)
- ACTA 37-2016 Autoacordado Tramitación ElectrónicaDocument7 pagesACTA 37-2016 Autoacordado Tramitación ElectrónicaHector Segundo Valenzuela CastellanoNo ratings yet
- Municipio de ChimalhuacánDocument94 pagesMunicipio de ChimalhuacánMatias Cruz HumbertoNo ratings yet
- Lagos Linda U5T2Guia ContableDocument15 pagesLagos Linda U5T2Guia ContableLinda Lagos100% (1)
- Tasacion Comercial de InmuebleDocument5 pagesTasacion Comercial de InmuebleMARTINNo ratings yet
- Plan de Minado - Cantera Roca CalizaDocument23 pagesPlan de Minado - Cantera Roca Calizapercy geomaxNo ratings yet
- Nh3 Vs Freon GeaDocument14 pagesNh3 Vs Freon GeaEugenio DurbanNo ratings yet