Professional Documents
Culture Documents
Determinación Dureza Agua
Uploaded by
José Andrés Sosa DazaOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Determinación Dureza Agua
Uploaded by
José Andrés Sosa DazaCopyright:
Available Formats
Repblica Bolivariana de Venezuela Ministerio del Poder Popular Para la Educacin Superior Instituto Universitario de Tecnologa Industrial Rodolfo
Loero Arismendi Extensin Maturn Especialidad: Qumica Industrial
Informe de la prctica: Determinacin de la Dureza del Agua. Laboratorio de Qumica Analtica II
Profesora: Lcda. Juana Coa
Bachilleres: Fuentes Edgardo Ramrez Carlos Rendn Ysmar Villarroel Mariela
4to Semestre Seccin 4DQ
Maturn, enero de 2008
Aspectos Tericos En qumica, se denomina dureza del agua a la suma de las concentraciones de compuestos minerales, en particular sales de magnesio y calcio expresadas como CaCO3 en mg/L. Son stas las causantes de la dureza del agua, y el grado de dureza es directamente proporcional a la concentracin de sales metlicas. El rango de dureza varia entre 0 y cientos de mg/L, dependiendo de la fuente de agua y el tratamiento a que haya sido sometida. El agua dura (por contraposicin al agua blanda) es aquella que posee una dureza superior a 120 mg CaCO3/l. Es decir que contiene un alto nivel de minerales, en particular sales de magnesio y calcio. Es un agua que no produce espuma, con el jabn. El agua dura forma un residuo grisceo con el jabn, que a veces altera el color de la ropa sin poder lavarla correctamente, forma una dura costra en las ollas y en los grifos y, algunas veces, tienen un sabor desagradable. El agua dura contiene iones que forman precipitados con el jabn o por ebullicin. El agua dura puede volver a ser blanda, con el agregado de carbonato de sodio o potasio, para precipitarlo como sales de carbonatos, o por medio de intercambio inico con salmuera en presencia de zeolita o resinas sintticas. Tipos de dureza: La dureza del agua tiene una distincin compartida entre dureza temporal (o de carbonatos) y dureza permanente (o de no-carbonatos) Dureza temporal: La dureza temporal se produce por carbonatos y puede ser eliminada al hervir el agua o por la adicin de cal (hidrxido de calcio). La reaccin es la siguiente:
Dureza permanente: Esta dureza no puede ser eliminada al hervir el agua, es usualmente causada por la presencia del sulfato de calcio y magnesio y/o cloruros en el agua, que son ms solubles mientras sube la temperatura. La determinacin de la dureza del agua se lleva a cabo en el laboratorio mediante una volumetra complejomtrica. Las volumetras complejomtricas consisten en la medicin de volumen de solucin tipo, necesario para formar un complejo con un catin metlico del compuesto que se analiza.
Muchos cationes metlicos reaccionan con especies dadoras de electrones llamadas ligandos, para formar compuestos de coordinacin o complejos. El ligando debe tener por lo menos un par de electrones sin compartir. Los complejos llamados quelatos, se producen por la coordinacin de un catin y un ligando, en los que el catin (metlico) es parte de uno o varios anillos de cinco o seis miembros. Los compuestos orgnicos ms conocidos que forman quelatos utilizables en anlisis cuantitativo son el cido nitrilotriactico, el cido etilendiaminotetraactico (EDTA) y la sal disdica del EDTA; estos compuestos se conocen comercialmente con los nombres de Titriplex I, II, y III respectivamente; tambin se utilizan los nombres de Complexonas, Vercenos o Secuestrenos. El ms empleado de los anteriores compuestos es la sal disdica del EDTA, por la facilidad de disolucin en agua; la solucin se prepara por el mtodo directo dado el carcter de reactivo tipo primario de la sal disdica. El cido etilendiaminotetraactico EDTA contiene cuatro hidrgenos cidos; por esa razn se representa tambin como H4Y. El EDTA forma complejos estables con la mayora de los cationes y entra siempre en relacin molar 1:1 en la frmula del complejo, independiente de la carga del catin, como se muestra en las siguientes reacciones: Mg+2 + Y-4 MgY-2 Al+3 + Y-4 AlY-1 Ca+2 + Y-4 CaY- Ag+ + Y-4 AgY- Los iones formados en las reacciones anteriores son incoloros, de tal manera que para determinar el punto final se emplean indicadores llamados metalcrmicos. Estos tienen la propiedad de formar complejos con cationes como el Ca+2y el Mg+2, de distinto color al que presenta el indicador libre. Estos indicadores son cidos dbiles que se representan como Hin. Negro de Ericromo T: tambin es conocido como NET, es un indicador de iones metlicos, muy utilizado para titular diversos cationes comunes, comportndose como un cido dbil. Los complejos metlicos del NET frecuentemente son rojos
de pH entre 4 a 12, cuando est libre en solucin en un rango de pH menor a 10 su color es rosado, a pH igual a 10 es de color azul.
Objetivos Aplicar las tcnicas bsicas de las volumetras complejomtricas en la determinacin de la dureza del agua. Reforzar los conceptos relacionados con soluciones buffer. Determinar la dureza total, la dureza debida al magnesio, la dureza debida al calcio, de la muestra de agua. Materiales Bureta 50ml Matraces erlenmeyer 250ml Probeta 100ml Reactivos Solucin EDTA 0,01molar Indicador negro de ericromo T (NET) Solucin Buffer pH 10
Esquema de trabajo
Se midieron 100ml de agua en una probeta, luego se vertieron un matrz erlenmeyer
Se agreg al agua 1ml de solucin bruffer a pH 10 y una pizca del Indicador negro de ericromo T, se homogeneiz
Se procedi a valorar con la solucin EDTA 0,01M
Se repiti 3 veces y luego se procedi a realizar los clculos para determinar la dureza del agua
Toxicidades
Toxicidad del Negro de ericromo T (NET): irrita los ojos, es txico para los organismos acuticos, puede provocar a largo plazo efectos negativos en el medio ambiente. Toxicidad del Amonaco (NH3): los vapores producen irritacin de los ojos, su inhalacin produce edema pulmonar. Las formas de amonaco desionizado varan con el pH y la temperatura. Su toxicidad impacta mayormente sobre peces e invertebrados. Algunas de sus propiedades fsico-qumicas son: gas incoloro en condiciones normales temperatura de solidificacin: 77,7C temperatura de ebullicin: -33,4C calor latente de vaporizacin a 0C 302Kcal/Kg. presin de vapor a 0C: 4,1atm
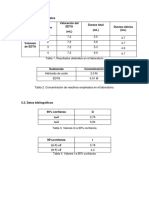
TABLAS DE VALORACIONES Valoraciones 1 2 Promedio (Vol. EDTA) = AGUA POTABLE Volumen EDTA gastado 14,5ml 15ml 14,75ml Volumen de agua 100ml 100ml
Valoraciones 1 2 Promedio (Vol. EDTA) =
AGUA DE CHORRO Volumen EDTA gastado 26,7ml 29ml 27,85ml
Volumen de agua 100ml 100ml
TABLAS DE CLCULOS Y RESULTADOS Determinacin del Calcio MEDTA = 0,01M Volumen EDTA gastado = 14,75ml Agua Potable Determinacin del Magnesio MEDTA = 0,01M Volumen EDTA gastado = 14,75ml
Peso molecular = 40,08g/mol Moles CaCO3= MEDTA Vol EDTA gastado
= 0,01mol/L 0,01475L = 1,475 10-4mol g/L muestra = 1,475 10-4mol 40,08g/mol = 5,912 10-3g
Dureza del agua (ppm)
5,912 *10 ^ 31000 0,1
Peso molecular = 24,32g/mol
Moles CaCO3= MEDTA Vol EDTA gastado
= 0,01mol/L 0,01475L
= 1,475 10-4mol
g/L muestra = 1,475 10-4mol
= 3,587 10-3g
Dureza del agua (ppm) =
24,32g/mol
3,587 *10 ^ 31000 0,1
35,87 ppm
59,12 ppm
59,12 + 35,87 2
Promedio ppm = Clasificacin del agua: dura
47,495 ppm
Agua de chorro Determinacin del Calcio Determinacin del Magnesio MEDTA = 0,01M MEDTA = 0,01M Volumen EDTA gastado = 27,85ml Volumen EDTA gastado = 27,85ml Peso molecular = 40,08g/mol Peso molecular = 24,32g/mol Moles CaCO3= MEDTA Vol EDTA gastado Moles CaCO3= MEDTA Vol EDTA gastado
= 0,01mol/L 0,02785L = 2,785 10-4mol g/L muestra = 2,785 10-4mol 40,08g/mol = 0,0112g
Dureza del agua (ppm)
0, 0112 1000 0,1
= 0,01mol/L 0,02785L
= 2,785 10-4mol
g/L muestra = 2,785 10-4mol 24,32g/mol
= 6,773 10-3g
Dureza del agua (ppm) =
6, 773*10 ^ 31000 0,1 112 + 67 , 73 2
112 ppm
67,73 ppm
Promedio ppm = Clasificacin del agua: muy dura
89,87 ppm
INTRODUCCIN El agua es el lquido ms abundante de nuestro planeta Tierra, ocupa el 71% de la superficie y se distribuye en aguas marinas e interiores. Se encuentra en la naturaleza como lquido, como slido (hielo y nieve) y como gas (vapor de agua) en la atmsfera. Es esencial para la vida; un 65% en masa del cuerpo humano es agua. El agua es el disolvente universal, con ella se llevan a cabo muchas reacciones qumicas. Asimismo se usa en gran manera para nuestro consumo, el
de las plantas y animales, ella juega un papel fundamental dentro del sistema tierra y sin su existencia no seria posible la vida. No obstante, el agua merece ser estudiada ya que contiene una serie de compuestos que de alguna u otra manera afectan o benefician la vida humana, numerosos procesos industriales y objetos. La dureza de las aguas es producida por sales de calcio y magnesio, y en menor proporcin por el hierro, aluminio y otros metales. La dureza que se debe a carbonatos y bicarbonatos de calcio y magnesio se denomina dureza temporal y se elimina por ebullicin. La dureza residual se denomina no carbnica o permanente, y se ablandan aadiendo carbonato de sodio y cal o con procesos de filtracin.
CONCLUSIONES La dureza del agua es la suma de las concentraciones de compuestos minerales, en particular sales de magnesio y calcio expresadas como CaCO3 en mg/L. El agua dura no produce espuma con el jabn, forma un residuo grisceo con el jabn, que a veces altera el color de la ropa sin poder lavarla
correctamente, forma una dura costra en las ollas y en los grifos y, algunas veces, tienen un sabor desagradable. Existen dos tipos de dureza, la causada por la presencia de carbonatos y bicarbonatos de calcio y magnesio, llamada dureza temporal. Y la causada por sulfatos de calcio y magnesio o cloruros en el agua. Para llevar a cabo esta prctica se realiz la tcnica de volumetra complejomtrica, en la cual juega un papel fundamental el cido etilendiaminotetractico (EDTA), este forma un complejo con el calcio y con el magnesio. El agua potable analizada en el laboratorio se clasific como dura, debido a que contena una cantidad considerable calcio y magnesio; ya que su valor est entre 32 y 54 (47,495ppm). El agua de chorro analizada en el laboratorio se clasific como muy dura, debido a que contena excesiva cantidad de calcio y magnesio; ya que su valor es mayor que 54 (89,87ppm).
REFERENCIAS BIBLIGRFICAS www.textoscietficos.com www.wikipedia.com www.monografias .com
www.fisicanet.com AULA SIGLO XXI. GEOGRAFA UNIVERSAL. EDICION 2001. EDITORIAL CULTURAL C.A.
You might also like
- Misa Pastoril de Jaro For Guagua Music MinDocument23 pagesMisa Pastoril de Jaro For Guagua Music MinEren Draco100% (4)
- Practica #07:DUREZA DEL AGUADocument19 pagesPractica #07:DUREZA DEL AGUACaroTaAr94% (17)
- Informe Analítica #5 Dureza AguaDocument7 pagesInforme Analítica #5 Dureza AguaDavid GarciaNo ratings yet
- Desalado-Electrostatico de CrudoDocument25 pagesDesalado-Electrostatico de CrudoJosé Andrés Sosa DazaNo ratings yet
- Seguridad de Reactores QuimicosDocument7 pagesSeguridad de Reactores QuimicosCarlos Enrique Hernandez FicachiNo ratings yet
- Herrero Sanchez Manuel Ed. Republicas yDocument49 pagesHerrero Sanchez Manuel Ed. Republicas yFidel Alfonso Rodriguez Velasquez100% (2)
- Determinacion de La DurezaDocument14 pagesDeterminacion de La DurezaYazman Dinver Laura HNo ratings yet
- Determinacion de La Dureza Del AguaDocument4 pagesDeterminacion de La Dureza Del AguaChristian LopezNo ratings yet
- 1 5123167742358192150Document15 pages1 5123167742358192150victor JavierNo ratings yet
- EXÁMENES DE GRADO QUÍMICADocument49 pagesEXÁMENES DE GRADO QUÍMICATopaciaHernandezNo ratings yet
- POLARIMETRIADocument12 pagesPOLARIMETRIALUZ KATERINE CONTRERAS FLOREZNo ratings yet
- Practica 04 - Determinación Dureza Del AguaDocument6 pagesPractica 04 - Determinación Dureza Del AguaBenigna Cuba Cuba0% (1)
- La Química Del AguaDocument12 pagesLa Química Del AguaLuchito Albinez BacaNo ratings yet
- Informe Quimica Analitica Dureza Del AguaDocument4 pagesInforme Quimica Analitica Dureza Del AguaDylan Martínez BernettNo ratings yet
- Labo 9 Solubilidad y Producto de SolubilidadDocument20 pagesLabo 9 Solubilidad y Producto de SolubilidadEricBryanDagninoReyesNo ratings yet
- PRÁCTICA 4 Determinacion Dureza en El AguaDocument11 pagesPRÁCTICA 4 Determinacion Dureza en El AguaWillmar AmayaNo ratings yet
- Uv VisDocument44 pagesUv ViserickNo ratings yet
- Informe Cinetica Enzimatica BiorreactoresDocument41 pagesInforme Cinetica Enzimatica BiorreactoresAlejandra Jimenez100% (1)
- Fermentación LácticaDocument9 pagesFermentación LácticaChristianChavezRamirezNo ratings yet
- Informe de AnaliticaDocument12 pagesInforme de AnaliticaCarlos Ricardo VelardeNo ratings yet
- Calculos EDTADocument3 pagesCalculos EDTAjuan jose calvacheNo ratings yet
- Feria095 01 Analisis de Coliformes Totales y Fecales en AguasDocument18 pagesFeria095 01 Analisis de Coliformes Totales y Fecales en AguasJose Condori PaytanNo ratings yet
- EspectrosDocument6 pagesEspectrosmarydj1408No ratings yet
- Prác - Eegg (1) 1Document28 pagesPrác - Eegg (1) 1Luis RamosNo ratings yet
- Bioquímica ModernaDocument2 pagesBioquímica ModernaSaul RodríguezNo ratings yet
- Labo 12Document27 pagesLabo 12Juan Diego Garcia Hancco100% (1)
- Dureza Del AguaDocument13 pagesDureza Del AguaeukenNo ratings yet
- Celdas Galvánicas y Su TermodinámicaDocument8 pagesCeldas Galvánicas y Su TermodinámicaMiguel Jiménez FloresNo ratings yet
- Guia de Operación de Procesos Industriales - ITSADocument35 pagesGuia de Operación de Procesos Industriales - ITSAEDITORIAL_ITSANo ratings yet
- Práctica Sólidos SuspendidosDocument19 pagesPráctica Sólidos SuspendidosbereniceNo ratings yet
- Informe 4 - Mesa 3Document7 pagesInforme 4 - Mesa 3Jorge Antonio Peche LeivaNo ratings yet
- Unidades primarias y escalas de temperaturaDocument106 pagesUnidades primarias y escalas de temperaturaDiego SantanderNo ratings yet
- Cinética de Las Reacciones EnzimáticasDocument27 pagesCinética de Las Reacciones EnzimáticasJavier HerreroNo ratings yet
- Practica Conduccion de CalorDocument27 pagesPractica Conduccion de CalorCristian ArangoNo ratings yet
- CentrifugaciónDocument9 pagesCentrifugaciónShirley Vargas RamosNo ratings yet
- Det. de Conductividad (Rev Cero)Document4 pagesDet. de Conductividad (Rev Cero)oscarNo ratings yet
- Informe de Tension Superficial Laboratorio de Fisica 2 UnmsmDocument19 pagesInforme de Tension Superficial Laboratorio de Fisica 2 UnmsmCristian Richard Saico CcopeNo ratings yet
- Determinación de La Dureza Del AguaDocument9 pagesDeterminación de La Dureza Del AguaAnonymous 28dbytNo ratings yet
- Conduct I Me TriaDocument8 pagesConduct I Me TriaElías AlexanderNo ratings yet
- DensidadDocument7 pagesDensidadapi-312957405No ratings yet
- Programa Balance de Materia y EnergiaDocument5 pagesPrograma Balance de Materia y EnergiaJMGHNo ratings yet
- TitulaciónDocument7 pagesTitulaciónOscar ArdilaNo ratings yet
- Anl115 ConductimetriaDocument27 pagesAnl115 ConductimetriaCarmen HernandezNo ratings yet
- Clase 10-Equilibrio de ComplejosDocument34 pagesClase 10-Equilibrio de ComplejosEduardoLalo MamaniNo ratings yet
- Fenómenos de Transporte II PDFDocument80 pagesFenómenos de Transporte II PDFEunice Carolina0% (1)
- EspectrofotometriaDocument40 pagesEspectrofotometriaANDRES FELIPE QUIROZ MENDEZNo ratings yet
- ColumbDocument13 pagesColumbKarenPatrocinioNo ratings yet
- Control de La Contaminación AmbientalDocument12 pagesControl de La Contaminación Ambientalanon_646854999No ratings yet
- Ia - Tarea 13 - Remediación de Suelos - Caracterización (2020)Document3 pagesIa - Tarea 13 - Remediación de Suelos - Caracterización (2020)George MoralesNo ratings yet
- Informe Conductimetria-Daniel Arias 174681 PDFDocument5 pagesInforme Conductimetria-Daniel Arias 174681 PDFDaniel AriasNo ratings yet
- Viii - Cinética de Degradación Del Ácido AscórbicoDocument18 pagesViii - Cinética de Degradación Del Ácido Ascórbicoteranhfelix20No ratings yet
- Determinación de sólidos en el agua: solidos totales, suspendidos y disueltosDocument6 pagesDeterminación de sólidos en el agua: solidos totales, suspendidos y disueltosMoises LorenzoNo ratings yet
- Beneficios de la toronja para la salud y nuevos productos a base de sus componentesDocument17 pagesBeneficios de la toronja para la salud y nuevos productos a base de sus componentesJonathan AlvaradoNo ratings yet
- Producción etanol fermentación glucosa 40cDocument10 pagesProducción etanol fermentación glucosa 40cJesús Miguel Jacinto NavaNo ratings yet
- Conductimetría Ácido Fuerte-Base FuerteDocument18 pagesConductimetría Ácido Fuerte-Base FuerteNaty GarciaNo ratings yet
- Problemas Cinetica Electroquimica - Erika MarinasDocument14 pagesProblemas Cinetica Electroquimica - Erika MarinasPablo HernándezNo ratings yet
- Guia 5. Cinetica Quimica - Velocidad de Reaccion y Equilibrio QuimicoDocument26 pagesGuia 5. Cinetica Quimica - Velocidad de Reaccion y Equilibrio QuimicoJhonnie GaonaNo ratings yet
- Determinación de La Dureza Del Agua EDTADocument5 pagesDeterminación de La Dureza Del Agua EDTAXimena AlemanNo ratings yet
- Quimica Analitica Practica 03Document8 pagesQuimica Analitica Practica 03Meléndez Meléndez John CharlesNo ratings yet
- Determinación de dureza y calcio en aguaDocument7 pagesDeterminación de dureza y calcio en aguaMiguel Perez AymaNo ratings yet
- Determinación de La Alcalinidad y Dureza Del Agua Laboratorio de FluidosDocument12 pagesDeterminación de La Alcalinidad y Dureza Del Agua Laboratorio de FluidosJorge Eduardo Jimenez RodasNo ratings yet
- DUREZA DEL AGUA GironDocument4 pagesDUREZA DEL AGUA GironISMAEL ALFONZO GUTIERREZ LLAPAPASCANo ratings yet
- Determinacion de Dureza TotalDocument11 pagesDeterminacion de Dureza TotalMiguel Murillo CanulNo ratings yet
- Proyecto-de-Quimica Obtenciòn Del MetanolDocument33 pagesProyecto-de-Quimica Obtenciòn Del MetanolJosé Andrés Sosa DazaNo ratings yet
- EsmeraldasDocument1 pageEsmeraldasJosé Andrés Sosa DazaNo ratings yet
- Proyecto-de-Quimica Obtenciòn Del MetanolDocument33 pagesProyecto-de-Quimica Obtenciòn Del MetanolJosé Andrés Sosa DazaNo ratings yet
- Balances de Materia y EnergiaDocument5 pagesBalances de Materia y EnergiaNico GarciaNo ratings yet
- Balance de VaporDocument14 pagesBalance de VaporJosé Andrés Sosa DazaNo ratings yet
- 39 Soluciones Ac SimdisDocument4 pages39 Soluciones Ac SimdisJosé Andrés Sosa DazaNo ratings yet
- Buenas Prácticas de Operación en El Lavado de Plantas y EquiposDocument62 pagesBuenas Prácticas de Operación en El Lavado de Plantas y EquiposAndrés HurtadoNo ratings yet
- 204 IngqDocument5 pages204 IngqAlis PastranaNo ratings yet
- Manual Practico de Combustion IndustrialDocument565 pagesManual Practico de Combustion IndustrialAdri AibarNo ratings yet
- Costo Marginal de La EnergíaDocument17 pagesCosto Marginal de La EnergíaJosé Andrés Sosa DazaNo ratings yet
- Operación de Bombas CentrífugasDocument8 pagesOperación de Bombas CentrífugasJosé Andrés Sosa DazaNo ratings yet
- Modelo CertificadoDocument1 pageModelo CertificadoJimmy SánchezNo ratings yet
- Biodiesel A Partir de Desechos OrganicosDocument7 pagesBiodiesel A Partir de Desechos OrganicosJosé Andrés Sosa DazaNo ratings yet
- Uso Seguro de Herramientas EléctricasDocument8 pagesUso Seguro de Herramientas EléctricasJosé Andrés Sosa DazaNo ratings yet
- Presentación Modelo de VaporDocument38 pagesPresentación Modelo de VaporJosé Andrés Sosa DazaNo ratings yet
- Exposicion de 502 Jose AndreDocument16 pagesExposicion de 502 Jose AndreJosé Andrés Sosa DazaNo ratings yet
- Como Citar Un TextoDocument12 pagesComo Citar Un TextoPaulina Zavala GarcíaNo ratings yet
- Apunte Prop TermodinamicasDocument47 pagesApunte Prop TermodinamicasdariojvrpioNo ratings yet
- Acondicionamiento Del Aire ComprimidoDocument6 pagesAcondicionamiento Del Aire ComprimidoVanessa GongoraNo ratings yet
- Listado de Tesis AlimentosDocument77 pagesListado de Tesis AlimentosJosé Andrés Sosa Daza100% (1)
- Perfil Contralor General EcuadorDocument5 pagesPerfil Contralor General EcuadorJosé Andrés Sosa DazaNo ratings yet
- Informacion Del BonoDocument10 pagesInformacion Del BonoJosé Andrés Sosa DazaNo ratings yet
- La Simulación de Procesos Es La Técnica de Representación Gráfica de Un Proceso Químico o FísicoDocument1 pageLa Simulación de Procesos Es La Técnica de Representación Gráfica de Un Proceso Químico o FísicoJosé Andrés Sosa DazaNo ratings yet
- Costo de Vapor Super ImportanteDocument1 pageCosto de Vapor Super ImportanteJosé Andrés Sosa DazaNo ratings yet
- Data Sheet BombaDocument1 pageData Sheet BombaJosé Andrés Sosa DazaNo ratings yet
- Descripción Proceso HidroDocument7 pagesDescripción Proceso HidroJosé Andrés Sosa DazaNo ratings yet
- Lluvia AcidaDocument1 pageLluvia AcidaJosé Andrés Sosa DazaNo ratings yet
- Yiyo TrabajoDocument2 pagesYiyo TrabajoJosé Andrés Sosa DazaNo ratings yet
- Botelho Gosalvez, Raúl - 1982 - AltiplanoDocument166 pagesBotelho Gosalvez, Raúl - 1982 - AltiplanoN. Senada64% (14)
- Updrs Calc NeurologiaDocument7 pagesUpdrs Calc NeurologiaRosa Elena CepedaNo ratings yet
- Manual PrepartoDocument75 pagesManual PrepartoAndrea TaberneroNo ratings yet
- Tema 9 (Malformaciones Anorrectales)Document6 pagesTema 9 (Malformaciones Anorrectales)Darliana Ospina DuarteNo ratings yet
- Matematicas para DesarrolarDocument10 pagesMatematicas para DesarrolarjklNo ratings yet
- Tablas de evaluación de riesgos laboralesDocument52 pagesTablas de evaluación de riesgos laboraleshenrybecerraNo ratings yet
- Solomos, Reyna & Freychet (Eds.) - Escuchando Lugares (UNL, 2021)Document306 pagesSolomos, Reyna & Freychet (Eds.) - Escuchando Lugares (UNL, 2021)WordsandMusicNo ratings yet
- La Prueba de OficioDocument3 pagesLa Prueba de OficioYomaira Sinahí Ñaño SalinasNo ratings yet
- Planificación Sala Cuna Menor Abril 2Document1 pagePlanificación Sala Cuna Menor Abril 2MaryQuezada100% (9)
- LEDESMA, María (2003) El Diseño Gráfico, Una Voz Pública - Capitulo2Document20 pagesLEDESMA, María (2003) El Diseño Gráfico, Una Voz Pública - Capitulo2Paloma AleuNo ratings yet
- ANEXOSDocument82 pagesANEXOSTaliaNo ratings yet
- Solidaridad y desarrollo personalDocument16 pagesSolidaridad y desarrollo personalhumberto borda0% (1)
- La Historia de La PenicilinaDocument2 pagesLa Historia de La PenicilinaYuli Salas100% (2)
- Preparatorio 3 Alexis Vaca Gr14Document3 pagesPreparatorio 3 Alexis Vaca Gr14Alexis VacaNo ratings yet
- Sistema de Frenos AbsDocument6 pagesSistema de Frenos AbsPableins FranciscoNo ratings yet
- Riesgos Psicosocial Ministerio DefensaDocument43 pagesRiesgos Psicosocial Ministerio DefensaRoberto Estrella MatamorosNo ratings yet
- Historiografía de La Revolución MexicanaDocument20 pagesHistoriografía de La Revolución MexicanaEsnaur Raizar100% (1)
- Robot CilindricoDocument9 pagesRobot CilindricoPame Espejo0% (2)
- El Sublime Maestre y El Hermano MayorDocument43 pagesEl Sublime Maestre y El Hermano MayorVíctor Alan100% (1)
- Género, ciudadanía y derechos humanos en América LatinaDocument4 pagesGénero, ciudadanía y derechos humanos en América LatinaAlicia IpiñaNo ratings yet
- Laboratorio de MRUVDocument2 pagesLaboratorio de MRUVRonnie Roger Anicama MendozaNo ratings yet
- Páncreas - HistologíaDocument22 pagesPáncreas - HistologíaHR LaloNo ratings yet
- Bloques CombinacionalesDocument5 pagesBloques CombinacionalesfedogonzalezNo ratings yet
- Caso No 2 - ReferenciaDocument173 pagesCaso No 2 - ReferenciaManuel Siles MelgaraNo ratings yet
- GUIA Ed.-Parvularia WebDocument148 pagesGUIA Ed.-Parvularia WebPriscila Alicia Gutierrez SepúlvedaNo ratings yet
- Manual de Convivencia Semana de Inducion (1) 2023Document15 pagesManual de Convivencia Semana de Inducion (1) 2023Ruby Margarita Alcala EspinosaNo ratings yet
- Evidencia 1 Estudio de CasoDocument3 pagesEvidencia 1 Estudio de CasoAndrea foreroNo ratings yet
- Medicina Veterinaria 5Document224 pagesMedicina Veterinaria 5436 calcosNo ratings yet