Professional Documents
Culture Documents
Experimento de Rutherfor1
Uploaded by
Alonso Marcelo Herrera VarasCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Experimento de Rutherfor1
Uploaded by
Alonso Marcelo Herrera VarasCopyright:
Available Formats
Experimento de Rutherford
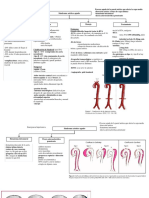
Ernest Rutherford utiliz este experimento en 1911 para corroborar su modelo atmico sobre la estructura de los tomos y a la vez rectificar el modelo atmico de Thompson. Este experimento constaba de tres piezas fundamentales: Primero, una caja cubierta de plomo (absorbedor de partculas radiactivas), que en su interior contena polonio, un elemento extremadamente radiactivo y de fcil desintegracin, y por ende, libera partculas alfas a gran velocidad. Las partculas o rayos alfa no son ms que ncleos de Helio. Es decir, una partcula alfa es un ncleo atmico de Helio en cuyo interior coexisten dos protones y dos neutrones. Al carecer de electrones, su carga elctrica es positiva. Segundo, una lmina de oro muy fina de aproximadamente 10 3 cm de espesor. Tercero, una barra de fosforo, ya que este tiene la capacidad de reaccionar ante el choque de las partculas con un chispazo y as poder determinar la trayectoria que las partculas alfas haban tomado. El experimento en s, consisti en bombardear con partculas alfas (que salan de una pequea abertura en la caja cubierta de plomo) la delgada lmina de oro. Rutherford esperaba que estos rayos la atravesaran sin desviacin o con una mnima desviacin pero no fue del todo as. La mayora de los rayos alfa al chocar con la lmina de oro seguan su trayectoria en lnea recta o sufran una pequea desviacin, pero otra pequea cantidad de rayos sufra grandes desviaciones e incluso en algunos casos rebotaban. Tal fue el asombro de Rutherford que describe los resultados con estas palabras: "Esto era lo ms increble que me haba ocurrido en mi vida. Tan increble como si un proyectil de 15 pulgadas, disparado contra una hoja de papel de seda, se volviera y le golpeara a uno" Todo lo ocurrido en el experimento puso a pensar a Rutherford y a explicarse porque ocurri lo sucedido, y lleg a una conclusin que la mayor parte del tomo se encuentra vaco y solo hay un pequeo punto donde la masa se encuentra contenida y lo llam ncleo, esto se debe a que las partculas alfas que salan y no chocaban con el ncleo del tomo seguan su trayectoria, pero las que si chocaban o rozaban en su trayectoria algn ncleo de algn tomo de la lmina de oro se desvan ya sea mucho o poco su trayectoria, entonces Rutherford supo que el budn de pasas era un modelo errneo y el tubo que crear su propio modelo a partir de las conclusiones que tenia de su experimento y que eran que
la mayora del tomo esta vaco y que solo hay un punto en el que se concentra su masa y es el ncleo y que las partculas al chocar con este desviaban su trayectoria ya que los rayos alfa que poseen carga positiva Como el peso atmico de los elementos tena un valor mucho mayor que el calculado a base de los protones del ncleo, Rutherford tambin sugiri que en los ncleos de los tomos tenan que existir otras partculas de masa casi igual a la del protn, pero sin carga elctrica, por lo que las llam neutrones. El neutrn fue descubierto experimentalmente en 1932 por Chadwick, quien, al bombardear el berilio con partculas alfas, observ que se producan unas partculas que las identific con los neutrones predichos por Rutherford.
Proteccin de plomo Partculas rebotadas
Lamina de oro
Partculas no desviadas
Fuente Radioactiva
Partculas desviadas
Pantalla fluorescente
En esta imagen podemos observar claramente los elementos que uso Rutherford en su experimento y que anteriormente mencion, tambin la direccin de los distintos rayos y que fue lo que llevo a concluir todo lo mencionado anteriormente.
You might also like
- PLAN CURRICULAR ANUAL 2022 - 2023 1ero Química Carlos MartínezDocument10 pagesPLAN CURRICULAR ANUAL 2022 - 2023 1ero Química Carlos MartínezCarlos Martinez100% (1)
- Electrotecnia Basica BachillerDocument156 pagesElectrotecnia Basica BachillerCampoverde Diaz Cristhian67% (3)
- 4.2 BradiarritmiasDocument3 pages4.2 BradiarritmiasAlonso Marcelo Herrera VarasNo ratings yet
- Hipertensión ArterialDocument4 pagesHipertensión ArterialAlonso Marcelo Herrera VarasNo ratings yet
- 4.1 ElectrocardiogramaDocument3 pages4.1 ElectrocardiogramaAlonso Marcelo Herrera VarasNo ratings yet
- 4.3 TaquiarritmiasDocument2 pages4.3 TaquiarritmiasAlonso Marcelo Herrera VarasNo ratings yet
- 4.3 TaquiarritmiasDocument3 pages4.3 TaquiarritmiasAlonso Marcelo Herrera VarasNo ratings yet
- Dolor Torácico en UrgenciasDocument3 pagesDolor Torácico en UrgenciasAlonso Marcelo Herrera VarasNo ratings yet
- Síndrome Coronario AgudoDocument2 pagesSíndrome Coronario AgudoAlonso Marcelo Herrera VarasNo ratings yet
- Síndrome Aórtico AgudoDocument3 pagesSíndrome Aórtico AgudoAlonso Marcelo Herrera VarasNo ratings yet
- 3.2 IAM Sin Supradesnivel Del STDocument2 pages3.2 IAM Sin Supradesnivel Del STAlonso Marcelo Herrera VarasNo ratings yet
- MATTERs Tranexamico HenorragiaDocument3 pagesMATTERs Tranexamico HenorragiaAlonso Marcelo Herrera VarasNo ratings yet
- Estudios EcologicosDocument17 pagesEstudios EcologicosAlonso Marcelo Herrera VarasNo ratings yet
- 4-Apuntes PeritoneoDocument10 pages4-Apuntes PeritoneoAlonso Marcelo Herrera VarasNo ratings yet
- 4 Reanimación Con Líquidos Guiadas Por ProtocolosDocument32 pages4 Reanimación Con Líquidos Guiadas Por ProtocolosAlonso Marcelo Herrera VarasNo ratings yet
- Wernicke Encephalopathy - UpToDateDocument16 pagesWernicke Encephalopathy - UpToDateAlonso Marcelo Herrera VarasNo ratings yet
- Acido Base - AbordajeDocument3 pagesAcido Base - AbordajeAlonso Marcelo Herrera VarasNo ratings yet
- Respirador Reutilizable Con FiltroDocument3 pagesRespirador Reutilizable Con FiltroAlonso Marcelo Herrera VarasNo ratings yet
- Estudios PrevalenciaDocument7 pagesEstudios PrevalenciaAlonso Marcelo Herrera VarasNo ratings yet
- Estudios Descriptivos Pruebas DiagnósticasDocument29 pagesEstudios Descriptivos Pruebas DiagnósticasAlonso Marcelo Herrera Varas0% (1)
- Circular 2010Document26 pagesCircular 2010Alonso Marcelo Herrera VarasNo ratings yet
- Metodo Epidemiologico 2Document22 pagesMetodo Epidemiologico 2Alonso Marcelo Herrera Varas0% (1)
- Resumen Gine EscencialDocument39 pagesResumen Gine EscencialAlonso Marcelo Herrera VarasNo ratings yet
- C10SES3T1CQALRSP0601Document14 pagesC10SES3T1CQALRSP0601angelica SHNo ratings yet
- Quimica Computacional Educativa PDFDocument60 pagesQuimica Computacional Educativa PDFJuma SanchezNo ratings yet
- Electricidad 01Document2 pagesElectricidad 01Mayer Castaño100% (3)
- Geometría SagradaDocument9 pagesGeometría SagradaAdriana Martins Pimentel100% (2)
- Analisis de La Materia y La EnergiaDocument120 pagesAnalisis de La Materia y La EnergiaLESLIE TAMAYO LIZARRAGANo ratings yet
- Wuolah Free Prehistoria de La Peninsula IbericaDocument45 pagesWuolah Free Prehistoria de La Peninsula IbericasantiagoNo ratings yet
- Materia+e+interacciones +Chabay+-+Sherwood +Tomo+I +cap+1 +interacciones+y+movimientoDocument53 pagesMateria+e+interacciones +Chabay+-+Sherwood +Tomo+I +cap+1 +interacciones+y+movimientoAngélica R.No ratings yet
- ActividadesDocument22 pagesActividadesEmy yay100% (3)
- 1 Clase Exploracion Del SubsueloDocument100 pages1 Clase Exploracion Del SubsueloJuan BettinNo ratings yet
- Trabajo Escrito TecnologiaDocument23 pagesTrabajo Escrito TecnologiaAlejandro GuzmánNo ratings yet
- ECUACIONES DIFERENCIALES ORDINARIAS - EnsayoDocument10 pagesECUACIONES DIFERENCIALES ORDINARIAS - EnsayoRoswmey ManzanaresNo ratings yet
- Triptico Informativo de Cientificos FisicosDocument2 pagesTriptico Informativo de Cientificos FisicosKeyder SanjurNo ratings yet
- Plan Anual Ciencias Naturales 8°Document8 pagesPlan Anual Ciencias Naturales 8°Daniela Soto ValleNo ratings yet
- Componentes de La Estructura Atómica de Los MaterialesDocument2 pagesComponentes de La Estructura Atómica de Los MaterialesluzmedinaNo ratings yet
- Plan Lector 3 Semana Junio.Document7 pagesPlan Lector 3 Semana Junio.Erick L. VegaNo ratings yet
- Ingeniería Química Linea Del TiempoDocument1 pageIngeniería Química Linea Del TiempoGABRIEL EDUARDO GARCIA SANDOVALNo ratings yet
- UNIVERSIDAD NACIONAL DE LA AMAZONIA PERUANA Infop5Document8 pagesUNIVERSIDAD NACIONAL DE LA AMAZONIA PERUANA Infop5FrankLeeNo ratings yet
- Ecuaciones Diferenciales Crecimiento y DecaimienDocument4 pagesEcuaciones Diferenciales Crecimiento y DecaimienCristian BenalcázarNo ratings yet
- Ejercicios Química-El ÁtomoDocument5 pagesEjercicios Química-El ÁtomoblenderistaNo ratings yet
- Análisis de Raymond ChangDocument6 pagesAnálisis de Raymond ChangDylan MoraNo ratings yet
- Curso Electricidad Domiciliaria BasicaDocument107 pagesCurso Electricidad Domiciliaria BasicaErwin Yañez Calfante100% (1)
- Introducción: Institución Educativa Jose Aquilino Duran Guía de Aprendizaje Autónomo #3Document2 pagesIntroducción: Institución Educativa Jose Aquilino Duran Guía de Aprendizaje Autónomo #3richard cañas100% (1)
- 4 - Quimica II 1roDocument24 pages4 - Quimica II 1roRenzo AntonioNo ratings yet
- Química ActualizadoDocument35 pagesQuímica ActualizadoNayeli Medina CenNo ratings yet
- Guia de Quimica - DecimoDocument4 pagesGuia de Quimica - DecimoVICTOR PEÑANo ratings yet
- Los ExperimentosDocument2 pagesLos ExperimentosOla Soy German TlvNo ratings yet
- Método DumasDocument6 pagesMétodo DumasAndrés EspinozaNo ratings yet
- Historia de Los Diferentes Modelos de AtomosDocument43 pagesHistoria de Los Diferentes Modelos de AtomosKevinNo ratings yet