Professional Documents
Culture Documents
Amines
Uploaded by
Darel NadjieraOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Amines
Uploaded by
Darel NadjieraCopyright:
Available Formats
Les Amines
Page 1 sur 31
Les Amines
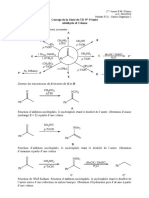
1. Structure. 1.1. Donnes Spectroscopiques. Les angles de liaisons sont voisins de 107 (pour 1.2. Isomrie optique )
Il ny a pas dnantiomrie pour les amines car lazote peut sinverser trs rapidement temprature ambiante E = 10% de lnergie de liaison 1.3. Proprits du doublet libre. Les amines sont des bases de Lewis. Nous tudierons donc les proprits lies leur basicit, et celles lies leur nuclophilie. 2. Nomenclature des amines. 2.1. Classes On distingue 3 classes damines, Iaires , IIaires , IIIaires . Ne pas confondre cette classification avec celles des alcools ou des drivs halogns: cest le nombre de groupements carbons substituant lazote qui indique la classe de lamine. Il existe des noms triviaux:
Les Amines
Page 2 sur 31
Lorsque lazote est substitu, on fait prcd le prfixe radicalaire de N- :
2.2. Sels dammonium - on les nomme comme des drivs de lion ammonium :
Lorsque lamine a un nom trivial, on ajoute ium au nom de lamine :
iodure de N,N-dimthyl-pipridinium :
2.3. Synthse des amines Les amines sont synthtises de diverses manires, gnralement par rduction de divers composs azots, ou par SN2 de lammoniac sur les drivs halogns. Voici, rsums, quelques ractions de synthse. particulirement la rduction des drivs nitrs. Amines I Alkylation RX + NH3 (excs) RNH2 Raction de Ritter Synthse de Gabriel Rduction alkylation rductive Ract dEschweil Puis nous tudierons plus
Amines II
Amines
Les Amines
Page 3 sur 31
Rarrangement
Rarrangement de Curtius Dgradation dHoffmann
2.4. Rduction des drivs nitrs. On utilise gnralement un mtal (Zn, Sn ou Fe) en milieu acide chlorhydrique concentr. On peut galement utiliser comme rducteur le dithionite de sodium Na2S2O4. La rduction passe par de nombreux intermdiaires ractionnels pouvant tre isols dans certaines conditions:
Les Amines
Page 4 sur 31
On sarrte lhydroxylamine par traitement du driv nitr par du zinc en prsence de chlorure dammonium. Si lon veut obtenir une hydrazine, on utilise du zinc en prsence de soude en milieu thanolique. 3. Proprits physiques. Les amines I et II ne donnent pas de liaisons hydrogne aussi fortes que celles des alcools. Leurs tempratures dbullition sont donc intermdiaires celles des alcools et des hydrocarbures correspondants. Elles possdent une odeur forte, une odeur de poisson. Elles ne sont solubles dans leau que si leur chane carbone comporte moins de 5 atomes. Leurs solutions sont basiques. Donc, presque toutes les amines sont solubles dans les acides dilus :
Voici quelques valeurs de pKa :
4. Ractivit des amines. Elle est centre essentiellement sur le doublet libre de lazote
4.1. Basicit. Ce sont toutes des bases plus fortes que lammoniac, car lazote subit les effets donneurs des groupements alkyles qui lui sont substitus, ce qui renforce sa charge partielle ngative et le rend plus nuclophile et plus basique (voir pKa). Ces amines sont toutes des acides trs faibles, car lion amidure correspondant est beaucoup moins stable que lion alcoolate par exemple, car lazote est moins lectrongatif que loxygne. Seules les amines aromatiques, o le doublet de lazote est conjugu avec le systme du cycle et est donc moins disponible, sont moins basiques (pKa = 5-6), et aussi plus acides :
Les Amines
Page 5 sur 31
laniline : est moyennement basique, alors que la diphnylamine est une base trs faible et que la triphnylamine est neutre. 4.2. Raction dHoffmann Cest une alkylation des amines par SN2 du doublet de lamine sur un driv halogn. Il peut tre intressant de se placer en excs dhalognure dalkyle (avec CH3Br par exemple). On a alors une "permthylation" et on obtient un sel dammonium quaternaire :
halognures peuvent parfois tre dshydrohalogns par les amines IIIaires
Si on se place en excs dammoniac, on se limite la formation des amines Iaires. Les
4.3. Acylation Les amines Iaires et IIaires peuvent tre facilement acyles en amides par les chlorures dacide. Les amides tant moins basiques que les amines, il ne peut y avoir quune seule acylation de lamine. Pour parfaire la raction, on rajoute une base dilues : NaOH, pyridine :
Les amines tertiaires donnent des ractions
Les Amines
Page 6 sur 31
complexes. Les anhydrides donnent le mme type de raction :
Le phosgne COCl2 ragit aussi sur les amines primaires en donnant un chlorure de carbamoyle qui perd facilement HCl. On obtient ainsi les isocyanates dalkyle.
Par exemple, ces isocyanates sont les prcurseurs des mousses de polyurthane :
4.4. Sulfonation Nous retrouvons ici une raction semblable la prcdente, mais avec les chlorures dacides sulfoniques, pour donner des sulfonamides :
La ractivit des sulfonamides est cependant diffrente de celle des carboxamides, et elle permet de mettre en uvre le test de "Hinsberg" qui permet de caractriser les trois classes damides :
Les Amines
Page 7 sur 31
- Les sulfonamides primaires portent un proton acide sur leur azote. En effet les effets inductifs attracteurs et msomres attracteurs du groupement SO2 sont bien plus puissants que ceux de CO. Ces effets stabiliseront donc facilement la charge ngative qui va se former : Le test de Hinsberg consiste donc crer la sulfonamide, la passer en milieu basique, puis revenir en milieu acide. Nous obtenons les rsultats suivants : type de lamine chauffage de lamine avec le traitement du mlange obtenu chlorure de paratolunesulfonyle par HCl concentr en milieu basique (NaOH) primaire dissolution (formation de prcipitation de
ion soluble dans leau secondaire apparition dun prcipit (formation Le prcipit reste insoluble dans de leau (Lazote nest plus assez basique pour capturer un proton)
qui est insoluble dans leau tertiaire pas raction de lamine. Le chlorure protonation de lamine tertiaire de paratolune sulfonyle est en hydrolys en paratolunesulfonate de sodium. Lamine reste insoluble dans leau qui se dissout
Lacide chlorosulfonique ragit de la mme faon :
Les Amines
Page 8 sur 31
4.5. Nitrosation Cest une des principales ractions des amines, qui conduit la synthse de nombreux composs industriels (colorants, etc...) La raction se fait en ajoutant une solution aqueuse de NaNO2 (nitrite de sodium), une solution aqueuse froide de lamine dans un acide dilu. 4.5.1. Agent de nitrosation Cest . La raction se fait en milieu acide :
4.5.2. Raction de
avec les amines IIaires.
On obtient une amine N-nitrose (gnralement bleue cause de la forte dlocalisation des lectrons dans le groupement N-NO :
4.5.3. Raction de
avec les amines IIIaires. La raction est complexe :
Les amines tertiaires aromatiques sont nitroses en para :
Les Amines
Page 9 sur 31
4.5.4. Amines Iaires. Les amines primaires conduisent toutes, par nitrosation, un sel de diazonium. Cependant, seuls les sels de diazonium aromatiques sont relativement stables. Formation du sel de diazonium:
Le bilan global est donc:
Les sels de diazonium aromatiques sont stabiliss par rsonance:
Ltude de ces sels est vue au 6 Les sels de diazonium aliphatiques ne sont pas stables et se dcomposent en passant par un carbocation. Celui-ci va donner des alcools, des alcnes, des composs cycliques, etc Cest la raction de Demyanov :
Les Amines
Page 10 sur 31
Autre exemple :
Des facteurs strochimiques interviennent dans cette raction qui est une SN2 de N2 par un doublet s dune liaison CC en position anti par rapport au groupe partant ex:
4.6. Addition - limination sur les aldhydes et ctones On obtient des a-hydroxylamines ou carbinolamines:
Celles drivant des amines primaires se dshydratent et donnent des imines Nsubstitues ou bases de SCHIFF: on obtient des aldimines ctimines ou des
Les Amines
Page 11 sur 31
Exemple: Les amines secondaires donnent les namines si on limine leau de la dshydratation grce au dyn-stark:
4.7. Oxydations Elles sont trs diverses. Les amines tertiaires donnent des oxydes damine:
Les N-oxydes aliphatiques peuvent subir llimination de Cope:
Exemple:
Les amines secondaires sont galement oxydes ainsi, mais se tautomrisent ensuite en N,N-dialkylhydroxylamines.
N-hydroxypipridine
Les Amines
Page 12 sur 31
Les amines aromatiques soxydent de manire complexe:
Les peracides oxydes les amines en drivs nitrs:
On passe dabord par un driv nitros. HO Cl est galement sensible lattaque nuclophile de lazote:
Les chloramines peuvent tre dshydrohalognes en imines:
4.8. Synthse des carbylamines Les amines, nuclophiles, ragissent galement avec les carbnes:
La rduction par H2/Pt donne des amines N-mthyles. 5. Proprits des sels dammonium quaternaires. Ce sont des composs ioniques qui ressemblent Na+ ou K+. Le compos une base forte. 5.1. Raction dlimination dHoffmann Cest la principale raction de ces composs (en dehors de la forte basicit de leurs hydroxydes) est
Les Amines
Page 13 sur 31
Elle napparat que si un des substituants de lazote porte un H en b. Sous leffet de la chaleur, les hydroxydes dammonium quaternaire sont dcompss en alcne et en amine tertiare. Ex:
Elle ne suit pas la rgle de Zaytseff. On obtient lalcne le moins substitu. Exemple:
Explications: Ltat de transition est diffrent de celui de la E2: en effet celui-ci prsente dj lbauche de la double liaison venir:
Dans llimination dHoffmann, lacidit des protons en b est augmente par la charge positive du groupe partant. On passe par un tat intermdiaire o cest lanion le plus stable qui va se former:
Donc ce sont les H des carbones les moins substitus par des groupements donneurs inductifs qui seront les plus acides. Pour synthtiser les sels dammonium quaternaires ncessaires cette limination, il faut traiter auparavant une amine par liodure de mthyle en excs: cest la permthylation dHoffmann. Exemple:
Les Amines
Page 14 sur 31
5.2. Substitution dun groupe N alkyle Lorsque lhydrogne en b de lazote est trs encombr, llimination selon Hoffmann ne peut se faire et on a une SN2:
Pour transformer un sel quaternaire en amine tertiaire, on utilise un compos bon nuclophile, mais base faible, par exemple le thiophnate:
6. Raction des sels de diazonium aromatiques On peut considrer deux types de ractions essentielles: celles avec dpart dazote et celles sans dpart dazote (formation des diazoques). Nous envisagerons aussi ltude des ylures de diazonium tels que le diazomthane 6.1. Ractions avec dpart dazote 6.1.1. Rduction Le chauffage de ces composs avec lthanol ou avec lacide hypophosphoreux H2POOH permet de remplacer N2 par H. Cest une bonne mthode pour supprimer une amine dun cycle aromatiqu
Les Amines
Page 15 sur 31
6.1.2. Hydrolyse. Synthse des phnols La solution aqueuse de sels de diazonium, synthtise froid, donne des phnols par rchauffement de cette solution. Le mcanisme semble tre du type SN1.
Il existe une autre mthode pour passer des amines aux phnols: la synthse de Bcherer:
6.1.3. Formation d'iodures, de nitrates Il sagit ici dune vritable SN2, grce la bonne nuclophilie de I :
6.1.4. Ractions de Sandmeyer Cl , Br , CN et ne sont pas aussi nuclophiles que I. Pour que N2 puisse tre substitu, il faut utiliser ces anions sous forme de sels cuivreux en milieu acide pour Cl et Br, neutre pour CN et basique pour . La raction semble tre radicalaire
Les Amines
Page 16 sur 31
Cette synthse des nitriles permet dobtenir facilement des acides carboxyliques par hydrolyse
6.1.5. Raction de Schiemann CuF nexiste pas (F trop oxydant). Donc la Sandmeyer est impossible. Cependant HBF4 et HPF6 prcipitent les cations diazonium en solution aqueuse:
Ces sels peuvent tre schs et manipuls sans danger ltat solide. En les chauffant doucement ltat sec, ils se dcomposent en fluorures aromatiques:
6.2. Ractions sans dpart d'azote 6.2.1. Rduction en hydrazine
Les Amines
Page 17 sur 31
6.2.2. Copulation diazoque Les sels de diazonium sont de pitres lectrophiles, mais ragissent avec les cycles aromatiques activs (phnols, phnates, arylamines). Les composs obtenus sont fortement conjugus, prsentent souvent des proprits acidobasiques, qui leur permettent de modifier leur conjugaison lors du passage dune forme lautre. Ce seront donc des colorants qui pourront servir parfois dindicateur color de pHmtrie.
Lazote de laniline est un bon nuclophile et ragit avec le cation diazonium si on opre incorrectement la diazotation:
Chauff quelques heures pH 6 7, le diazoaminobenzne sisomrise en paraaminoazobenzne 6.2.3. Colorants azoques Ce sont des structures complexes qui contiennent gnralement un groupement acide sulfonique, ce leur permet dtre solubles dans leau: Acide H
Les Amines
Page 18 sur 31
Un bon colorant doit tre absorb par la fibre. Les substituants polaires maintiennent la molcule la surface de la fibre par formation de liaisons hydrogne. Les groupements effet +E foncent la teinte par diminution de lnergie entre les plus hautes OM p pleines et les plus basses OM p antiliantes vides. Exemple:
De nombreux indicateurs de pH sont donc des colorants azoques, par exemple le Rouge Congo: bleu en milieu acide, rouge en milieu basique. PKi = 5
Les Amines
Page 19 sur 31
6.3. Ylures de diazonium 6.3.1. Structure
Ils sont stabiliss par les groupements attracteurs dlectrons. Exemple: les adiazoctones: 6.3.2. Synthse du diazomthane Il est synthtis partir de la N-mthyl-N-nitrosoure:
Le diazomthane est toxique et explosif. Cest un gaz jaune que lon manipule en solution. 6.3.3. Ractions du diazomthane Cest un nuclophile. Il permet ainsi de former des thers et des esters mthyls:
Les Amines
Page 20 sur 31
Cest la mme chose avec les alcools. Synthse des a-diazoctones:
HCl ragit ensuite avec le diazomthane en excs (voir supra) Raction avec les ctones Le diazomthane se comporte aussi comme un initiateur du carbne CH2. Celui-ci sinsre gnralement entre la fonction carbonyle et une des chanes carbones fixes sur ce carbonyle. Il y aussi formation de sous-produits tels des oxiranes:
Ce carbne peut tre form par irradiation du diazomthane par la lumire U.V. Dans ce cas, il peut y avoir raction avec les alcnes. 6.3.4. Rarrangement de Wolff : raction de Arndt-Eistert Les a-diazoctones, lorsquelles sont chauffes en prsence doxyde dargent, donnent un ctne par perte dazote. Cest un cas typique de transposition de Wolff, qui concerne les acylcarbnes et les acylnitrnes:
Les Amines
Page 21 sur 31
En prsence dthanol, le ctne est transform par addition en ester. La raction globale, partir dun acide, pour donner un ester comportant un carbone supplmentaire insr entre le carbonyle de la fonction acide et la chane carbone, sappelle la raction de Arndt-Eistert:
Les a-diazoctones cycliques donnent des ractions de contraction de cycle. Le rarrangement de Wolff est induit photochimiquement:
Voici le mcanisme de cette synthse:
Les Amines
Page 22 sur 31
6.3.5. Azotures On peut faire un bon parallle entre les diazoalcanes et les azotures, les uns tant des alkylures de diazonium, les autres des amidures de diazonium:
Ils sont obtenus par action de lion azoture tre par la suite hydrogns en amines) :
sur les halognures dalkyle(ils peuvent
Les acylazotures, de la mme manire que les a-diazoctones, donnent le rarrangement de Wolff aprs perte dazote: Cest la raction de Curtius-Schmitt. Il y a formation dun acylnitrne qui se rarrange, que lon retrouve dans les ractions de Lossen et dHoffmann. On obtient un isocyanate (voir infra) qui pourra donner des urthanes ou des amines.
Ces acylazotures peuvent aussi tre obtenus par diazotation des hydrazides RCONHNH2. 7. Raction des imines, isocyanates et namines. 7.1. Hydrolyse des imines En milieu acide:
7.2. Polymrisation Lthanaldimine et la mthanaldimine se polymrisent spontanment:
Les Amines
Page 23 sur 31
7.3. Rduction On obtient des amines. Les rducteurs utiliss sont HCOOH, NaBH4 , H2/Ni Exemple:
Les amines secondaires peuvent galement tre alkyles de cette faon:
Autre exemple: la raction dEschweiler-Clark. Cest une mthylation des amines IIaires par le mthanal en prsence dacide mthanoque comme rducteur.
7.4. Raction de Strecker Cette synthse permet de comprendre la synthse primitive (il y a 4 Milliards dannes) des acides amins:
7.5. Raction de Mannich Cest une condensation acidocatalyse sur les amines IIaires. Lion immonium
Les Amines
Page 24 sur 31
intermdiaire lactone:
va rendre le CH2 sensible lattaque nuclophile de lnol de
Cette base de Mannich peut se dshydrater sous leffet de la chaleur pour librer une a-none.
7.6. Raction de Wolff-Kischner Cest une rduction de ctones passant par lintermdiaire dune hydrazine :
7.7. Addition nuclophile sur les isocyanates
De formule R N = C = O . Le carbone central est trs lectrophile. Ces isocyanates dans de nombreuses ractions de dgradation des composs azots. Cest donc un
Les Amines
Page 25 sur 31
intermdiaire de synthse intressant. On peut lisoler et le librer en prsence deau pour donner des polyurthanes utiliss dans lisolation thermique. Exemples:
Les diisocyanates ragissent avec les polyols (diols ou plus) pour donner les polyurthanes. Lhydrolyse des isocyanates donnent des amines. Il faut viter que celles-ci ne ragissent sur lisocyanate restant en donnant des ures substitues si lon veut rcuprer les amines. On oprera donc en milieu acide, o les amines sont protones et nont plus de pouvoir nuclophile.
7.8. Alkylation des ctones par lintermdiaire des namines Les namines comportent un carbone activ par le pouvoir msomre donneur de lazote.
Elles pourront donc donner lieu des ractions de substitution nuclophiles sur les halognures dacyle et certains halognures dalkyle. Les ions immonium obtenus sont de plus faciles hydrolyser. On aura donc le schma ractionnel suivant:
Les Amines
Page 26 sur 31
namine + ractif lectrophile substitue 7.8.1. C alkylation
ion immonium substitu
hydrolyse en ctone
Ne se fait quavec les halognures ractifs: benzyliques, allyliques, a-carbonyls et CH3I
7.8.2. C acylation Tous les chlorures dacide ragissent avec les namines pour donner des b - dictones:
8. Ractions des nitriles. Ils sont caractriss par la liaison C N polarise comme C=O. Ils ragiront donc comme les drivs carbonyls, soit: comme acide de Lewis: le carbone fonctionnel comme base de Lewis: lazote comme acide de Brnstdt: le carbone en a du carbone fonctionnel. 8.1. Ractivit du carbone lectrophile 8.1.1. hydrolyse Elle est catalyse par les bases ou les acides: catalyse acide
Les Amines
Page 27 sur 31
Les hydroxyimines sont les formes tautomres instables des amides:
catalyse basique Dans les deux cas prcdents, les amides obtenues sont hydrolyses, en carboxylate en milieu basique, et en acide carboxylique en milieu acide En prsence de HCl sec, les alcools sadditionnent aux nitriles de deux manire, selon la stchiomtrie propose: 1 mole dalcool pour une mole de nitrile: on obtient un ester
- 3 moles dalcool pour une mole de nitrile: on obtient un orthoester R C(OEt)3
8.1.2. Raction des organomagnsiens
Les Amines
Page 28 sur 31
Ils sadditionnent une fois au nitrile, et lhydrolyse conduit aux ctones:
De la mme manire, ils rgissent avec les ortoesters pour donner des ctones:
8.1.3. Rduction des nitriles Elles conduisent gnralement aux amines primaires. On peut utiliser divers agents: H2/Ni raney dans EtOH en prsence dammoniac, LiAlH4 dans lther, Na dans EtOH 8.2. Ractivit de lhydrogne en a du groupement nitrile. Cest une ractivit comparable celle des H en a des carbonyles des esters (Claisen):
Raction de Thorpe: (voir la raction de Dieckmann)
8.3. Raction de Ritter Le nitrile ragit avec lalcool tertiobutylique en milieu acide (ce qui donne un carbocation tertiaire stable) pour donner une amine primaire:
Les Amines
Page 29 sur 31
9. Ractions des amides. 9.1. Alkylation de lazote Les carboxamides ne sont pas assez acides pour tre transformes en anions par HO aqueux. Par contre les sulfonamides le sont:
Cet anion est un bon nuclophile:
La phtalimide, qui est une dicarboxamide, prsente galement cette proprit. Lhydrolyse de limide substitue obtenue permet dobtenir une amine primaire: Cest la synthse de Gabriel:
9.2. Nitrosation
Les Amines
Page 30 sur 31
Lazote de lamide est suffisamment nuclophile pour ragir avec
+
NO. On obtient alors un compos de diazonium qui se dcompose immdiatementen acide:
Pour liminer lacide nitreux prsent en excs dans les mlanges ractionnels (Sandmeyer), on utilise de lure qui est une diamide:
Les amides monosubstitues donnent des drivs N-nitross, prcurseurs des diazoalcanes:
9.3. Dgradation dHoffmann Les amides possdant un proton au moins sur lazote ragissent avec les hypohalognures:
Sil reste un hydrogne sur lazote, la raction continue avec la base: cest la dgradation dHoffmann:
Les Amines
Page 31 sur 31
Lisocyanate, dans les conditions opratoires (prsence deau et de soude), est gnralement hydrolys en amines et
You might also like
- Identification Spectrométrique de Composés Organique - SilversteinDocument30 pagesIdentification Spectrométrique de Composés Organique - SilversteinMahmoudSfarHancha20% (5)
- MetauxDocument13 pagesMetauxDarel NadjieraNo ratings yet
- 14-Fascicule PC Tle S IA PG-CDC Février 2020 (VF)Document232 pages14-Fascicule PC Tle S IA PG-CDC Février 2020 (VF)Mouhamadou Tidiane Seck100% (2)
- Chimie Oraganique 2 SMC4Document126 pagesChimie Oraganique 2 SMC4Yc YacineNo ratings yet
- Proprietés Physique Meca Des MateriauxDocument206 pagesProprietés Physique Meca Des Materiauxabderazak_2008100% (1)
- SoufreDocument8 pagesSoufreDarel NadjieraNo ratings yet
- StereochimieDocument17 pagesStereochimieDarel NadjieraNo ratings yet
- CCMDocument4 pagesCCMDarel NadjieraNo ratings yet
- ChloreDocument18 pagesChloreDarel NadjieraNo ratings yet
- Derives CarbonylesDocument31 pagesDerives CarbonylesDarel Nadjiera100% (1)
- RpeDocument47 pagesRpeDarel Nadjiera100% (1)
- ChloreDocument18 pagesChloreDarel NadjieraNo ratings yet
- CCMDocument4 pagesCCMDarel NadjieraNo ratings yet
- DA2008Document171 pagesDA2008neculaitarabutaNo ratings yet
- TPI-06 DonneesDocument1 pageTPI-06 DonneesElyne ChloéNo ratings yet
- Test IdentDocument1 pageTest IdentMagatte Sow100% (2)
- AlcyneDocument5 pagesAlcyneloloNo ratings yet
- TD #9 Suite Corrigé 2018-2019Document4 pagesTD #9 Suite Corrigé 2018-2019Ikram GrNo ratings yet
- ReactiviteDocument48 pagesReactiviteHaithem BrahemNo ratings yet
- Wa0006Document135 pagesWa0006Yc Yacine100% (1)
- Série 5 Et CorrigéDocument7 pagesSérie 5 Et CorrigéChoaib NouhyNo ratings yet
- smc5 Session 1 2020Document7 pagessmc5 Session 1 2020adnanNo ratings yet
- AlcoolsDocument4 pagesAlcoolsOumar TraoréNo ratings yet
- AcidesDocument20 pagesAcidesKhalil LasferNo ratings yet
- BAC - C 2021 - Elément de Réponse Et Grille VFDocument12 pagesBAC - C 2021 - Elément de Réponse Et Grille VFMontcho HounlononNo ratings yet
- Site TS C 10 Esterification Et Hydrolyse D'un EsterDocument9 pagesSite TS C 10 Esterification Et Hydrolyse D'un EsterPecorellaNo ratings yet
- L2 Chimie VF 26-05-18Document34 pagesL2 Chimie VF 26-05-18AndyTeck Pro (Android)No ratings yet
- ChimieDocument5 pagesChimieHhimedaneNo ratings yet
- Cours de Chimie Organique Chapitre IIDocument15 pagesCours de Chimie Organique Chapitre IIzahramathlouthi127No ratings yet
- Boky Sujets Poly 1Document190 pagesBoky Sujets Poly 1Christopher ZaraNo ratings yet
- Reactions Chimie OrgaDocument47 pagesReactions Chimie OrgafluiddynamicNo ratings yet
- OrganometalliquesDocument13 pagesOrganometalliquesabdelouahed.rhaouiNo ratings yet
- Synthèse Chimie - Les Grandes Réactions ChimiquesDocument21 pagesSynthèse Chimie - Les Grandes Réactions ChimiquesAdrien StandaertNo ratings yet
- Chap 02 NomenclatureDocument9 pagesChap 02 NomenclatureCendrey Grace KoutoumaNo ratings yet
- Exposer de PétrochimieDocument37 pagesExposer de PétrochimieNoureddine FrhNo ratings yet
- ComplDocument126 pagesComplInesNo ratings yet
- PDF CHIMIE PDFDocument22 pagesPDF CHIMIE PDFBenjamen Ç FiloNo ratings yet
- COF - Fascicule de TP Printemps 2018Document11 pagesCOF - Fascicule de TP Printemps 2018Silvia Costa50% (2)
- Synthese de La Menthone A Partir Du Menthol Sans CalculatriceDocument3 pagesSynthese de La Menthone A Partir Du Menthol Sans Calculatricelinachikhaoui27No ratings yet