Professional Documents
Culture Documents
Desormes
Uploaded by
Cristhian VillavicencioOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Desormes
Uploaded by
Cristhian VillavicencioCopyright:
Available Formats
ESCUELA SUPERIOR POLITCNICA DEL LITORAL
INSTITUTO DE CIENCIAS FSICAS
LABORATORIO DE FISICA B
PROFESOR:
Ing. Carlos Martnez B.
TTULO DE LA PRCTICA:
Experimento de Clement y
Desormes
ALUMNO:
Cristhian Ernesto Villavicencio Perero
INTEGRANTES:
Abraham Vinueza
Genesis Figueroa
Carlos Aguirre
CORREO:
cevillav@espol.edu.ec
FECHA DE ENTREGA DEL INFORME:
Guayaquil, Martes 24 de Enero del 2012
PARALELO: 8
Ao Lectivo
2011 2012
Parmetros Calificacin
Resumen
Objetivos
Marco terico
Procedimiento
Resultados
Conclusin
RESUMEN:
En este experimento, con el objetivo de medir la relacin de los calores especficos
del aire a presin y volumen constante, pudimos calcular las diferentes presiones por
medio de este aparato este dispositivo consta de un baln de vidrio provisto de dos
vlvulas de bronce y un manmetro sumergido en un recipiente que contiene un lquido
(puede ser agua, cido sulfrico, mercurio, etc.). La graduacin en el manmetro
depender del lquido que se utilice. Este dispositivo se conecta mediante su vlvula
lateral con una bomba de vaco que permite que el gas que se encuentra en el interior
del baln est a una presin suficientemente baja como para considerar que el gas
acte como un gas ideal. La vlvula superior conecta el baln directamente con la
atmsfera.
Abstract
In this experiment, in order to measure the ratio of specific heats of air pressure
and constant volume, we calculate the different pressures by means of this device
this device consists of a glass ball with two brass valves and gauge immersed in a
vessel containing a liquid (can be water, sulfuric acid, mercury, etc.).. Graduation
depends on the gauge of the liquid used. This device is connected through its side
valve with a vacuum pump that allows the gas that is inside the ball is at a pressure
low enough to consider that the gas acts as an ideal gas. The top valve connects the
ball directly into the atmosphere.
OBJETIVOS:
Calcular experimentalmente la relacin de los calores especficos del aire a presin
constante y volumen constante () de acuerdo al mtodo de Clement y Desormes.
INTRODUCCIN:
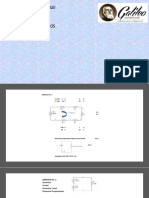
Considere una masa de gas encerrada en un recipiente (R) con una presin P1,
levemente superior a la presin atmosfrica P0. La presin manomtrica del gas se
mide por la diferencia en las alturas (h1) de las dos columnas de un manmetro que
contiene un lquido con densidad , as.
(1)
h P P
g
1 0 1
+ =
La temperatura inicial del gas es T1, es decir la temperatura del ambiente. Luego se
destapa el recipiente brevemente, permitiendo que el gas alcance la presin
atmosfrica. El cambio de presin se produce tan rpidamente que no hay
transferencia de calor hacia o desde fuentes externas y se dice que el proceso es
adiabtico. El gas comprimido en el envase efecta un trabajo cuando hace salir un
poco del gas del envase durante la expansin. Por consiguiente, inmediatamente
despus de cerrar el recipiente, la temperatura del gas que queda est por debajo de
la temperatura del ambiente. Si ahora se permite que el gas se caliente hasta la
temperatura ambiente, entonces la presin P2 en este estado est dada por:
(2)
Sean V1, Vi y V2, el volumen inicial, intermedio y final de una masa de gas en el
recipiente, de modo que en cada caso se considere la misma masa de gas. Ya que se
efecta un proceso adiabtico desde el estado inicial al intermedio, la ecuacin que
relaciona la presin y el volumen en dichos estados es:
(3)
Donde es la relacin de los calores especficos del gas a presin constante y el
volumen constante. Como el gas en el estado inicial est a la misma temperatura que en
el estado final, la relacin entre la presin y el volumen est dada por la Ley de Boyle:
(4)
Haciendo uso de las ecuaciones1, 2, 3 y 4, encontraremos una ecuacin q nos permite
calcular el valor de as:
De la ecuacin 3 se obtiene:
Sabiendo que Vi=V2, entonces
(5)
h P P
g
2 0 2
+ =
V P V P i i
=
1 1
V P V P 2 2 1 1
=
P
P
V
V
i
i
1
1
=
|
|
.
|
\
|
P
P
V
V
i
1
2
1
=
|
|
.
|
\
|
De la ecuacin 4 se obtiene
(6)
Sustituyendo (6) y (5):
(7)
Luego restando la ecuacin (2) de (1) se
obtiene:
(8)
Despejando P0 de la ecuacin (1) y sabiendo que P0=P1 se obtiene:
(9)
Reemplazando las ecuaciones 8 y 9 en la 7 se obtiene:
[
Bajo la consideracin de que:
Se puede desarrollar el binomio con la siguiente aproximacin:
De esto se desprende que:
P
P
V
V
1
2
2
1
=
P
P
P
P
i
1
1
2
=
|
.
|
\
|
( )
h h P P
g
2 1 2 1
=
( )
h h P P
g
2 1 1 2
=
h P P
g
i 1 1
=
PROCEDIMIENTO EXPERIMENTAL:
1. Bombee al frasco una pequea cantidad de aire y cierre la conexin a la bomba
con la abrazadera de compresin, la diferencia del nivel del liquido en los
brazos del manmetro debe ser del orden 15 cm.
2. Espere a que el aire en el frasco llegue a la temperatura ambiente y asegrese
de que no este escapando aire; entonces registre h1 en la tabla de datos de
este experimento.
3. Abra el frasco momentneamente a la atmsfera, deslizando la placa de metal
por medio segundo.
4. Vuelva a colocar la varilla y tapones de caucho de modo que la placa haga
presiona contra el vidrio.
5. Despus de un momento registre h2 en la tabla.
MATERIALES:
- Frasco
- Inflador
- Manometro
- Abrazadera de compresin
RESULTADOS:
Toma de Datos.
Para h
1
Para h
2
h
1
=y h
2
=y
y= y
2-
y
1
y= y
2-
y
1
y= y
2
+y
1
y= y
2
+y
1
1.
y= 17.8
y= 3.8
y=0.2 y=0.2
h
1
= (17.80.2) cm. h
2
= (3.80.2) cm.
2.
y= 14.5
y= 3.0
y=0.2 y=0.2
h
1
= (14.50.2) cm. h
2
= (3.00.2) cm.
3.
y= 15.4
y= 2.9
y=0.2 y=0.2
h
1
= (15.40.2) cm. h
2
= (2.90.2) cm.
4.
y= 14.2
y= 3.1
y=0.2 y=0.2
h
1
= (14.20.2) cm. h
2
= (3.10.2) cm.
5.
y= 18.5
y= 3.2
y=0.2 y=0.2
h
1
= (18.50.2) cm. h
2
= (3.20.2) cm.
6.
y= 15.3
y= 3.2
y=0.2 y=0.2
h
1
= (15.30.2) cm. h
2
= (3.20.2) cm.
7.
y= 17.0
y= 3.3
y=0.2 y=0.2
h
1
= (17.00.2) cm. h
2
= (3.30.2) cm.
8.
y= 17.6
y= 3.9
y=0.2 y=0.2
h
1
= (17.60.2) cm. h
2
= (3.90.2) cm.
TABLA DE DATOS
N h
1
(cm)
h
2
(cm)
1 17.80.2
3.80.2
1.27
2
14.50.2 3.00.2 1.26
3
15.40.2 2.90.2 1.23
4
14.20.2 3.10.2 1.28
5
18.50.2 3.20.2 1.21
6
15.30.2 3.20.2 1.27
7
17.00.2 3.30.2 1.26
8
17.60.2 3.90.2 1.29
1.27
Clculos de los valores de
=
2 1
1
h h
h
=
c
h1
c = h
1
+ h
2
1. c = h
1
-h
2
c = 17.8-3.8= 14.0
= 17.8/14.0= 1.27
= 1.27
2. c = h
1
-h
2
c = 14.5-3.0= 11.5
= 14.5/11.5= 1.26
= 1.26
3. c = h
1
-h
2
c = 15.4-2.9= 12.5
= 15.4/12.5= 1.23
= 1.23
4. c = h
1
-h
2
c = 14.2-3.1= 11.1
= 14.2/11.1= 1.28
= 1.28
5. c = h
1
-h
2
c = 18.5-3.2= 15.3
= 18.5/15.3= 1.21
= 1.21
6. c = h
1
-h
2
c = 15.3-3.2= 12.1
= 15.3/12.1= 1.27
= 1.27
7. c = h
1
-h
2
c = 17.0-3.3= 13.7
= 17.0/13.7= 1.26
= 1.26
8. c = h
1
-h
2
c = 17.6-3.3= 13.7
= 17.6/13.7= 1.29
= 1.29
Calcular los valores de
| |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| |
a) Si un globo de helio al principio a temperatura ambiente se pone en una
congeladora, su volumen aumenta, disminuye o queda igual? Explique
Antes de entrar el globo al congelador tena una presin interior similar a la
presin atmosfrica que es, evidentemente, mayor que la del interior del
congelador. Este proceso, de aumento de volumen del globo y disminucin de
presin en su interior, durar hasta que la presin de la goma del globo hacia el
interior del globo se iguale con la presin del gas al interior del globo. Por lo
tanto, el helio al interior del globo primero mantendr la temperatura, mientras
se compensa el aumento de volumen con la disminucin de presin, y luego la
disminuir cuando la presin y el volumen del globo se estabiliza, entonces la
energa trmica de la que sigue desprendindose le disminuir su temperatura.
b) Qu le pasa a un globo lleno de helio que se suelta en el aire? Se
expandir o se contraer? Dejara de ascender a cierta altura? Explique
El aire es ms denso que el helio. Y el conjunto Helio ms goma del globo es
menos denso que el aire. Por ello el globo con Helio se elevar. Al elevarse, para
pequeos tramos, la temperatura no vara mucho, pero la presin atmosfrica
vara ms rpido, disminuyendo, con la altura. Entonces la presin al interior del
globo, que antes de elevarse era similar a la atmosfrica, empuja a la goma del
globo y el globo aumenta su volumen. As seguir. Ms arriba disminuir la
temperatura pero no alcanza el ritmo de disminucin de la presin. Se puede
entender el proceso como isotrmico. Disminuye la presin.... aumenta el
volumen.
El proceso de aumento de volumen del globo tiene un lmite. La presin que la
goma del globo ejerce sobre el gas en su interior. Entonces si el globo sigue
subiendo la presin en su interior vencer la resistencia que ofrece la goma y
"reventar". El Helio en contacto con el aire a una presin muy baja hervir casi
de inmediato.
DISCUSIN
En el mtodo de Clment y Desormes se produce una rpida compresin de un gas a
baja presin y temperatura ambiente contenido en un recipiente, que puede entonces
suponerse en principio adiabtica, despus se deja que el gas vuelva a su temperatura
inicial.
Se suele cometer errores durante el proceso de registrar las presiones manomtricas
del gas: la inicial, la resultante despus de la compresin y la final, al volver el gas a la
temperatura ambiente.
Otro punto muy importante que se debe considerar es, que la vlvula que permite el
ingreso de aire a presin atmosfrica no debe tener ninguna fuga de aire ya que si lo
existiera los resultados no sern los esperados.
Para esta practica se recomienda realizar al menos unas ocho mediciones par que as
nuestra practica en conjunto presente un bajo margen de error
CONCLUSIONES
Para un gas ideal que evolucione adiabticamente el producto (PV)^ se mantiene
constante, donde P es la presin, V el volumen, y es la relacin entre el calor
especfico a presin constante y el calor especfico a volumen constante
Considerando al gas como ideal, se demuestra que es aproximadamente igual, a la
relacin entre las diferencias de alturas manomtricas; es decir la diferencia entre la
altura inicial h0 y la obtenida al comprimir el gas, h1, dividida por la diferencia entre la
primera y la altura final del gas a temperatura ambiente h2
ANEXOS
FOTOS DE LA PRCTICA
Equipo usado durante la prctica
Se procede a comprimir el aire dentro del botelln de vidrio
Se registran las correspondientes alturas h1 y h2
BIBLIOGRAFA
- Gua de Laboratorio Fsica B
- Fsica Universitaria Sear Zemansky
- www.wikipedia.org
You might also like
- Ecuaciones Diferenciales de Primer OrdenDocument36 pagesEcuaciones Diferenciales de Primer OrdenMiguel Flores100% (25)
- Sta Margarita 1-ModelDocument1 pageSta Margarita 1-ModelCristhian VillavicencioNo ratings yet
- Calibración EstáticaDocument7 pagesCalibración EstáticaCristhian VillavicencioNo ratings yet
- CasoRicoMani PDFDocument9 pagesCasoRicoMani PDFNicole ValverdeNo ratings yet
- Ensayo 20 MillionDocument1 pageEnsayo 20 MillionCristhian VillavicencioNo ratings yet
- Proyecto EconomiaDocument16 pagesProyecto EconomiaCristhian VillavicencioNo ratings yet
- Laboratorio 5Document8 pagesLaboratorio 5Cristiam GutierrezNo ratings yet
- Taller 2 MecánicaDocument5 pagesTaller 2 MecánicaSebastian CastellanosNo ratings yet
- CPP. PROPIEDADES FUNDAMENTALES (28-Sep-21)Document17 pagesCPP. PROPIEDADES FUNDAMENTALES (28-Sep-21)????????????No ratings yet
- Parámetros de Funcionamiento de Un Transformador Monofásico de Baja PotenciaDocument8 pagesParámetros de Funcionamiento de Un Transformador Monofásico de Baja PotenciaOSMEL ENRIQUE OLASCOAGA PADILLANo ratings yet
- Mru Mrua Mcu McuaDocument7 pagesMru Mrua Mcu McuaEloy RicouzNo ratings yet
- FM 07 - Dinámica y Estática SA-7 - PDFDocument35 pagesFM 07 - Dinámica y Estática SA-7 - PDFKevinDx KevinGxNo ratings yet
- 2019 06 Coi Madrid Fisica Exam Criterios SolucionesDocument9 pages2019 06 Coi Madrid Fisica Exam Criterios Solucioneskenichi shukehiroNo ratings yet
- ElectrostáticaDocument32 pagesElectrostáticaAnonymous iE9rUn9mNo ratings yet
- A PDFDocument2 pagesA PDFJhefer FuarkNo ratings yet
- EJEMPLOSDocument11 pagesEJEMPLOSBryan Antonio Tandazo YaguanaNo ratings yet
- Curso de Montaje de AscensoresDocument85 pagesCurso de Montaje de Ascensoresantonio100% (3)
- Zapatas Conectadas PDFDocument7 pagesZapatas Conectadas PDFjorge renatoNo ratings yet
- Estabilidad de Sistemas de PotenciaDocument56 pagesEstabilidad de Sistemas de PotenciaCarlos MezaNo ratings yet
- Multimetros DigitalesDocument16 pagesMultimetros DigitalesRodolfo VicenteNo ratings yet
- Clases de MedidasDocument14 pagesClases de MedidasJuan Fernandez HornaNo ratings yet
- Diseño Y Analisis Teorico Y Experimental de Un Autogiro A EscalaDocument62 pagesDiseño Y Analisis Teorico Y Experimental de Un Autogiro A EscalaHector MuñozNo ratings yet
- Metodos de Investigacion MixtaDocument17 pagesMetodos de Investigacion MixtaStivenMartínezNo ratings yet
- Proyecto de Grado - Intalacion Delta Estrella de Transformadores TrifasicosDocument13 pagesProyecto de Grado - Intalacion Delta Estrella de Transformadores TrifasicosADONIS BURNHAMNo ratings yet
- Coeficiente de Dilatación AguaDocument3 pagesCoeficiente de Dilatación AguaDaniela FPNo ratings yet
- OSCILADORESDocument4 pagesOSCILADORESJuanJoseVasquezCastilloNo ratings yet
- Masjl-Ele-Mc-003 - Puesta TierraDocument24 pagesMasjl-Ele-Mc-003 - Puesta TierraluisNo ratings yet
- Informe - Leyes de KirchhoffDocument6 pagesInforme - Leyes de KirchhoffBianchiNo ratings yet
- Lab 1 Maquinas RotativasDocument12 pagesLab 1 Maquinas RotativasantonioNo ratings yet
- Circ. Elect Serie Paralelo - Pedro Cojulún - Circ. EléctDocument15 pagesCirc. Elect Serie Paralelo - Pedro Cojulún - Circ. EléctPedro CojulunNo ratings yet
- Pasito 3Document11 pagesPasito 3Leydi yulissa Quispe PérezNo ratings yet
- Acc16 Eval Acc CA VF & Foc STDDocument23 pagesAcc16 Eval Acc CA VF & Foc STDAnibal ValenzuelaNo ratings yet
- Gaviones 2Document3 pagesGaviones 2Arturo VerNo ratings yet
- Unidad 1 - Fase 2Document11 pagesUnidad 1 - Fase 2claudia ximena lozanoNo ratings yet
- FisícaDocument2 pagesFisícacarolina león falzoneNo ratings yet
- PRÁCTICA 11 BioelectricidadDocument8 pagesPRÁCTICA 11 BioelectricidadRonaldo AtanacioNo ratings yet