Professional Documents
Culture Documents
Entropia
Uploaded by
Ivan SandovalOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Entropia
Uploaded by
Ivan SandovalCopyright:
Available Formats
Universidad de Carabobo
Facultad de Ingeniera
Escuela de Ingeniera Mecnica
Departamento de Trmica y Energtica
Termodinmica I
Entropa
INTEGRANTES:
GARAY RONALD
MARQUEZ RICARDO
ORTEGA ALBERTO
RODRIGUEZ GUILLERMO
SANCHEZ CLEMENTE
NAGUANAGUA, Septiembre 2008
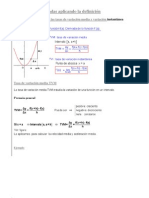
Origen: Rudolf Clausius
Ecuacin General:
Cambio de entropa:
0 s
}
T
Q o
rev
T
Q
dS
int
|
.
|
\
|
=
o
Entropa:
}
|
.
|
\
|
= =
2
1
1 2
rev Int
T
Q
S S S
o
Caso especial, Procesos isotrmicos de transferencia de calor
internamente reversibles:
Ejemplo:
Un dispositivo cilindro-mbolo contiene una mezcla de liquido y
vapor de agua a 300K. Durante un proceso a presin constante se
transfiere al agua 750KJ de calor. Evaporando todo el lquido.
Determine el cambio de entropa.
0
T
Q
S =
KJ Q
const K T
750
300
=
= =
La desigualdad de Clausius nos permite definir una nueva propiedad:
}
=
|
.
|
\
|
0
rev
T
Q o
El hecho de que esta integral cclica sea 0 indica que la cantidad en el integrando
Es la diferencial de una funcin de estado, a diferencia del calor y del trabajo
que son funciones de la trayectoria.
} }
} } }
|
.
|
\
|
=
|
.
|
\
|
=
|
.
|
\
|
+
|
.
|
\
|
=
|
.
|
\
|
2
1
2
1
1
2
2
1
0
B A
B A rev
T
Q
T
Q
T
Q
T
Q
T
Q
o o
o o o
Definicin de entropa
}
|
.
|
\
|
= = A
|
.
|
\
|
=
2
1
1 2
rev rev
T
Q
S S S
T
Q
dS
o o
En un proceso de transferencia de calor isotermo y reversible el cambio de entropa
es igual.
T
Q
S = A
Consideremos el siguiente ciclo formados por dos procesos: uno reversible y el
otro arbitrario.
} } }
s
|
.
|
\
|
+
|
.
|
\
|
s 0 0
1
2
2
1 rev
T
Q
T
Q
T
Q o o o
Este es el enunciado matemtico de la segunda ley de la termodinmica para una masa fija.
La igualdad se cumple para los procesos reversibles y la desigualdad para los irreversibles.
El signo de la desigualdad nos indica que el cambio de entropa de un sistema
cerrado durante un proceso reversible siempre es mayor que la transferencia de
entropa, es decir, se genera entropa durante un proceso irreversible. A esta
entropa generada se le denomina generacin de entropa.
( )
}
> + =
2
1
1 2
0 ;
gen gen
S S
T
Q
S S
o
La entropa de un sistema aislado siempre aumenta durante un proceso o, en el caso de
procesos reversibles, permanece constante
Un sistema y sus alrededores pueden ser los dos subsistemas de un sistema aislado, y el
cambio de entropa de un sistema aislado durante un proceso es igual a la suma de los
cambios de entropa del sistema y su entorno, lo cual recibe el nombre de cambio de
entropa total o generacin de entropa. El principio del incremento de entropa para
cualquier proceso se expresa como:
0 > A + A = A =
entorno sistema total gen
S S S S
Esta es la forma general del principio de cambio de entropa y es aplicable tanto a
sistemas abiertos como cerrados. Este principio establece que el cambio de entropa
total asociado con un proceso debe ser positivo para los procesos irreversibles
y cero para los reversibles
La ecuacin anterior no implica que la entropa de un sistema o de su entorno no puedan
disminuir. El cambio de entropa de un sistema o de sus alrededores puede ser negativo
durante el proceso, pero su suma no. El principio del aumento de entropa. Puede
resumirse como sigue:
ALGUNOS COMENTARIOS SOBRE LA ENTROPIA
Los procesos slo suceden en una direccin, no en cualquier direccin.
Un proceso debe seguir su curso en la direccin que cumpla con el principio del
incremento de entropa, es decir, Sgen 0. Un proceso que viola este principio
es imposible. Este principio frecuentemente obliga a que las reacciones qumicas
se interrumpan antes de alcanzar su terminacin.
La entropa es una propiedad que no se conserva y no hay postulado
como el principio de la conservacin de la entropa. La entropa solo se
conserva durante el proceso reversible idealizado y aumenta durante todos los
procesos reales. En consecuencia la entropa del universo aumenta
continuamente.
El desempeo de los sistemas de ingeniera se degrada por la presencia
de irreversibilidades y la generacin de entropa es una medida de las
magnitudes de las irreversibilidades, tanto mayor resulta la generacin de entropa
durante ese proceso. Cuanto mayor es el grado de las irreversibilidades, tanto
mayor resulta la generacin de entropa. Por consiguiente, la entropa puede
usarse como una medida cuantitativa de irreversibilidades asociadas con un
proceso.
CAMBIO DE ENTROPIA DE SUSTANCIAS PURAS
La entropa es una propiedad, y por lo
tanto el valor de la entropa se fija una ves
que el sistema se fija. El hecho de
especificar dos propiedades intensivas
independientes fija el estado de un
sistema compresible sencillo, y por lo
tanto tambin el valor de la entropa, as
como tambin los valores de otras
propiedades en ese estado.
El valor de la entropa en un estado especifico se determina del mismo modo que
cualquier otra propiedad.
En las regiones de mezcla saturada, se determina de
Cuando se carece de datos de lquido comprimido, la entropa de liquido
comprimido se calcula:
El cambio de entropa de una masa m (como sistema cerrado) es:
Procesos Isoentrpicos
Son procesos internamente reversibles y adiabticos, por lo tanto, la entropa se
mantiene constante.
Proceso Isoentrpico: s = 0 s
2
= s
1
Es decir, cuando una sustancia tenga el mismo valor de entropa tanto al
final del proceso como al inicio del proceso se lleva a cabo de una manera
isoentrpica.
Un proceso adiabtico reversible necesariamente es Isoentrpico (s
2
= s
1
),
pero uno isoentrpico no es necesariamente un proceso adiabtico
reversible.
P1 = 5MPa
T1 = 450C
Turbina de
Vapor
Wsalida = ?
P2 = 1.4MPa
Ejemplo: Expansin isoentrpica de vapor en una turbina.
En una turbina adiabtica entra vapor a una presin P1 y a una temperatura T1; y sale a una
presin P2. Determine el trabajo de salida de la turbina por unidad de masa de vapor si el
proceso es reversible.
Solucin:
De una manera reversible, el vapor se expande en una turbina adiabtica a una presin
especificada. Se determinar el trabajo de salida de la turbina.
Suposiciones:
1.- ste es un proceso de flujo estable porque no hay cambio con respecto al tiempo en
cualquier punto, por lo tanto mvc = 0, Evc = 0
2.- El proceso es reversible.
3.- Las energas cinticas y potencial son insignificantes.
4.- La turbina es adiabtica.
5.- Como es un proceso reversible y adiabtico, entonces es Isentrpico:
Svc = 0
Anlisis:
Se toma la turbina como el sistema (VC), se observa que slo hay una entrada y una salida,
por lo tanto, m1 = m2 = m
Wsalida = m ( h1 h2 )
P1 = 5MPa
T1 = 450C
Turbina de
Vapor
Wsalida = ?
P2 = 1.4MPa
Wsalida = m ( h1 h2 )
Estado 1:
P1 = 5MPa
T1 = 450C
Wsalida = m ( h1 h2 )
Estado 1:
P1 = 5MPa
T1 = 450C
h1 = 3317.2 kJ/Kg
S1 = 6.8210 kJ/Kg . K
Wsalida = m ( h1 h2 )
Estado 1:
Estado 2:
P1 = 5MPa
T1 = 450C
h1 = 3317.2 kJ/Kg
S1 = 6.8210 kJ/Kg . K
P2 = 1.4MPa
Wsalida = m ( h1 h2 )
Estado 1:
Estado 2:
P1 = 5MPa
T1 = 450C
h1 = 3317.2 kJ/Kg
S1 = 6.8210 kJ/Kg . K
P2 = 1.4MPa
S2 = S1
Wsalida = m ( h1 h2 )
Estado 1:
Estado 2:
P1 = 5MPa
T1 = 450C
h1 = 3317.2 kJ/Kg
S1 = 6.8210 kJ/Kg . K
P2 = 1.4MPa
S2 = S1
h2 = 2967.4 kJ/Kg
Wsalida = m ( h1 h2 )
Estado 1:
Estado 2:
P1 = 5MPa
T1 = 450C
h1 = 3317.2 kJ/Kg
S1 = 6.8210 kJ/Kg . K
P2 = 1.4MPa
S2 = S1
h2 = 2967.4 kJ/Kg
Entonces, el trabajo de salida de la turbina por unidad de masa
de vapor se convierte en:
wsalida = h1 h2 = 349.8 kJ/Kg
Cambio de Entropa de Lquidos y Slidos
Los lquidos y slidos pueden aproximarse a sustancias incompresibles, dado que sus
volmenes especficos permanecen casi constantes durante un proceso. Por lo tanto,
dV = 0, para lquidos y slidos.
En las relaciones T ds tenemos que:
ds = du/T + PdV/T
Nos queda:
ds = du/T = c dT/T
Ya que Cp = Cv =C y du = C dT para sustancias incompresibles.
Entonces el cambio de entropa durante un proceso es determinado por
integracin como:
Donde Cprom es el calor especifico de la sustancia a lo largo de un intervalo de
temperatura dado.
____________________________________________________________________
Una relacin para procesos isoentpicos de lquidos y slidos se obtiene igualando la
relacin del cambio de entropa a cero, lo que da:
Es decir, la temperatura de una sustancia verdaderamente incompresible permanece
constante durante un proceso isentrpico. Por consiguiente, el proceso isentrpico de
una sustancia incompresible es tambin isotrmico. Este comportamiento se acerca
mucho a lquidos y slidos.
} |
|
.
|
\
|
~ =
2
1
1
2
1 2
) (
T
T
CpromLn
T
dT
T C s s
kJ/Kg.K
1 2
1
2
1 2
0 T T
T
T
CpromLn s s = =
|
|
.
|
\
|
=
Cambio de entropa de Gases Ideales.
Las expresiones para el cambio de entropa puede obtenerse mediante
las ecuaciones:
T
vdP
T
dh
ds
T
Pdv
T
du
ds
=
+ =
Mediante las relaciones de propiedades para gases ideales siguientes:
CpdT dh
CvdT du
RT Pv
=
=
=
Tomando:
T
Pdv
T
du
ds + =
Sustituyendo:
CvdT du
v
RT
P
=
=
Resulta:
v
dv
R
T
dT
Cv ds + =
El cambio de entropa para un proceso se
obtiene integrando esta relacin entre los
estados extremos:
}
+ =
2
1
1
2
1 2
) (
v
v
RLn
T
dT
T Cv s s
De manera similar a lo
anterior, tomando:
T
vdP
T
dh
ds =
Sustituyendo:
CpdT dh
P
RT
v
=
=
Resulta:
P
dP
R
T
dT
Cp ds =
El cambio de entropa para un proceso se
obtiene integrando esta relacin entre los
estados extremos:
}
=
2
1
1
2
1 2
) (
P
P
RLn
T
dT
T Cp s s
Calores especficos constantes
(tratamiento aproximado).
Los calores especficos de gases ideales, con la excepcin de gases monoatmicos,
dependen de la temperatura.
Las relaciones de cambio de entropa para gases ideales bajo la suposicin de calor
especifico constante se obtienen al sustituir C
v
(T) y C
p
(T) por C
vprom
y C
pprom .
1
2
1
2
, 1 2
1
2
1
2
, 1 2
P
P
RLn
T
T
Ln C s s
v
v
RLn
T
T
Ln C s s
prom p
prom v
=
+ =
(kJ/Kg K)
(kJ/Kg K)
Los cambios de entropa tambin se pueden expresar por mol al multiplicar
estas relaciones por la masa molar.
1
2
1
2
, 1 2
1
2
1
2
, 1 2
P
P
Ln R
T
T
Ln C s s
v
v
Ln R
T
T
Ln C s s
u
prom p
u
prom v
=
+ =
(kJ/Kmol K)
(kJ/Kmol K)
Calores especficos variables
(tratamiento exacto).
Cuando el cambio de temperatura durante un proceso es grande y los calores especficos
del gas ideal no varan linealmente dentro del intervalo de temperatura, la suposicin de
calores especficos constantes puede conducir a errores considerables en los clculos del
cambio de entropa.
Se ha definido:
1 2
2
1
) ( s s
T
dT
T Cp =
}
1
2
1 2 1 2
P
P
RLn s s s s =
Puede expresarse con base molar:
1
2
1 2 1 2
P
P
Ln R s s s s
u
o o
=
(kJ/Kg.K)
(kJ/Kmol.K)
Calores especficos constantes, procesos
isoentrpicos
(tratamiento aproximado).
Diversas relaciones para los procesos de gases ideales se pueden
obtener igualando a cero las relaciones del cambio de entropa.
De la ecuacin:
Igualando a cero:
1
2
1
2
, 1 2
v
v
RLn
T
T
Ln C s s
prom v
+ =
1
2
1
2
v
v
Ln
C
R
T
T
Ln
v
=
v
C
R
v
v
Ln
T
T
Ln
|
|
.
|
\
|
=
2
1
1
2
Relacin entre los calores
especficos de un gas ideal.
Cv
Cp
K
Cv Cp R
=
=
1
2
1
1
2
=
|
|
.
|
\
|
=
|
|
.
|
\
|
k
ctte s
v
v
T
T
Primera relacin isoentrpica
para gases ideales.
De la ecuacin:
Igualando a cero:
1
2
1
2
v
v
Ln
C
R
T
T
Ln
v
=
p
C
R
v
v
Ln
T
T
Ln
|
|
.
|
\
|
=
2
1
1
2
1
2
1
2
, 1 2
P
P
RLn
T
T
Ln C s s
prom p
=
K K
ctte s
P
P
T
T
/ ) 1 (
1
2
1
2
=
|
|
.
|
\
|
=
|
|
.
|
\
|
Segunda relacin isoentrpica
para gases ideales.
Tercera relacin isoentrpica para gases
ideales.
Se obtiene igualando la primera y la segunda relacin
isoentrpica.
K
ctte s
v
v
P
P
|
|
.
|
\
|
=
|
|
.
|
\
|
=
2
1
1
2
VALIDAS
PARA:
1
2
1
/ ) 1 (
1
2
1
2
=
|
|
.
|
\
|
=
|
|
.
|
\
|
=
|
|
.
|
\
|
k K K
ctte s
v
v
P
P
T
T
Gases Ideales.
Procesos isoentrpicos.
Calores especficos constantes.
Calores especficos variables
(tratamiento exacto).
Cuando no es apropiada la suposicin de calor especifico constante, las relaciones
isoentrpicas antes desarrolladas producirn resultados que no son muy exactos. En
tales casos, se debe utilizar la siguiente relacin isoentrpica:
1
2
1 2
1
2
1 2
0
P
P
RLn s s
P
P
RLn s s
+ =
=
Presin relativa y Volumen especifico
relativo.
) / exp(
) / exp(
1
2
1
2
R s
R s
P
P
=
La cantidad se define
como la presin relativa Pr,
transformndose lo anterior en:
) / exp( R s
1
2
1
2
r
r
cte s
P
P
P
P
=
|
|
.
|
\
|
=
1
2
1
2
r
r
cte s
v
v
v
v
=
|
|
.
|
\
|
=
1 1
2 2
1
2
/
/
r
r
P T
P T
v
v
=
La cantidad T/P es una cantidad
solo de la temperatura y se
define como el volumen
especifico relativo v
r.
You might also like
- Raices de Ecuaciones LinealesDocument8 pagesRaices de Ecuaciones LinealesIvan SandovalNo ratings yet
- Analizador SintacticoDocument14 pagesAnalizador SintacticoIvan SandovalNo ratings yet
- Calculo de LimitesDocument26 pagesCalculo de LimitesAndres HernandezNo ratings yet
- Clase1-2011 Conceptos de Programación ConcurrenteDocument16 pagesClase1-2011 Conceptos de Programación ConcurrenteIvan SandovalNo ratings yet
- Matriz ComparativaDocument8 pagesMatriz Comparativacesar230388No ratings yet
- Calculo de LimitesDocument26 pagesCalculo de LimitesAndres HernandezNo ratings yet
- 1 Teoria de Los SistemasDocument7 pages1 Teoria de Los SistemasIvan SandovalNo ratings yet
- Elasticidad PDFDocument11 pagesElasticidad PDFIvan SandovalNo ratings yet
- Principios de Geometría Analítica y Algebra LinealDocument45 pagesPrincipios de Geometría Analítica y Algebra LinealAna Maria QuinteroNo ratings yet
- Resumen DerivadasDocument26 pagesResumen DerivadasIvan SandovalNo ratings yet
- Calculo de expresiones, condicionales y funciones en PythonDocument16 pagesCalculo de expresiones, condicionales y funciones en Pythonfrancisco ramonNo ratings yet
- Guía Ejercicios 11 Equilibrio Precipitación y ComplejaciónDocument3 pagesGuía Ejercicios 11 Equilibrio Precipitación y ComplejaciónfranciscoNo ratings yet
- Tarea 1Document4 pagesTarea 1jefferson anguloNo ratings yet
- Lab4 Ley de OHM UNMSMDocument8 pagesLab4 Ley de OHM UNMSMDavid Albres PabloNo ratings yet
- MovimientoDocument3 pagesMovimientoYUZULY ANDREA AMAYA HERNANDEZNo ratings yet
- Informe de Medicion de Resistividad para Puesta A Tierra y PararrayosDocument7 pagesInforme de Medicion de Resistividad para Puesta A Tierra y PararrayosVictor SantosNo ratings yet
- Ley Gauss EjerciciosDocument4 pagesLey Gauss EjerciciosJose YeahNo ratings yet
- Informe (Teorema de Toricelli)Document13 pagesInforme (Teorema de Toricelli)Jeremy EscandonNo ratings yet
- Experiencia N 2: Material TeoricoDocument4 pagesExperiencia N 2: Material TeoricoFranco CarballoNo ratings yet
- Resumen Practica4Document4 pagesResumen Practica4Freddy PaladinesNo ratings yet
- Partes de Un Motor CCDocument10 pagesPartes de Un Motor CCElLoko EduNo ratings yet
- Cuestionarios Examen Tercer ParcialDocument16 pagesCuestionarios Examen Tercer ParcialJavier LeeNo ratings yet
- 4 Presión Requerida para El Transporte de HidrocarburosDocument30 pages4 Presión Requerida para El Transporte de HidrocarburosSonya Mamani ChambiNo ratings yet
- 2.4 Cascada de CalorDocument14 pages2.4 Cascada de CalorPEDRO JOAQUIN S�NCHEZ TENORIONo ratings yet
- Clase #13 ExamenDocument3 pagesClase #13 ExamenJavier JoseNo ratings yet
- Hoja 4Document2 pagesHoja 4Nicolás KozakNo ratings yet
- Taller 01 Mediciones Electricas Formacion ComplementariaDocument3 pagesTaller 01 Mediciones Electricas Formacion Complementariafernando torregrozaNo ratings yet
- TPN 22018Document7 pagesTPN 22018Cristian PaterninaNo ratings yet
- Monografia - Refrigeracion Por Absorsion - Grupo 4Document25 pagesMonografia - Refrigeracion Por Absorsion - Grupo 4Fluidos FRRQNo ratings yet
- 4 DensidadDocument4 pages4 DensidadAndrea AbellaNo ratings yet
- Ad y Tono Del SonidoDocument1 pageAd y Tono Del SonidoRaúl Avila67% (3)
- Controlador Fase DimmerDocument6 pagesControlador Fase DimmerEdwin JamiNo ratings yet
- LB Práctica 8 Ago-Dic 2021 Grupo.513Document7 pagesLB Práctica 8 Ago-Dic 2021 Grupo.513Pedro Pablo BautistaNo ratings yet
- Informe 5 Maquinas Electricas 1 Estructura y Materiales en Las Maquinas Electricas EstaticasDocument12 pagesInforme 5 Maquinas Electricas 1 Estructura y Materiales en Las Maquinas Electricas EstaticasEnrique Santiago MaldonadoNo ratings yet
- Ejercicios 1Document1 pageEjercicios 1Raul Ivan Mamani AycaNo ratings yet
- Examen Extraordinario de Ecuaciones DiferencialesDocument1 pageExamen Extraordinario de Ecuaciones DiferencialesLeobardo JimenezNo ratings yet
- Ley de CoulombDocument3 pagesLey de CoulombJhosue Nelson Diaz OliversNo ratings yet
- Examen parcial de Reservorio I optimizado paraDocument15 pagesExamen parcial de Reservorio I optimizado paraJhon Alexander Carballo LeónNo ratings yet
- Examen Redes Eléctricas Sistemas Potencia PreguntasDocument1 pageExamen Redes Eléctricas Sistemas Potencia PreguntasYsabel Salinas ValdiviaNo ratings yet