Professional Documents
Culture Documents
Sesion #13 y 14 Soluciones.
Uploaded by
farmedickOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Sesion #13 y 14 Soluciones.
Uploaded by
farmedickCopyright:
Available Formats
Mag Antonio Leonardo DELGADO ARENAS
QUIMICA
SESION N 13 y 14
soluciones
DIRECCION DE ESTUDIOS BASICOS Y COMPLEMENTARIOS
UNW- Quimica- ALDA - 2014 1
MEZCLAS
Una mezcla est formada por la
unin de sustancias en cantidades
variables y que no se encuentran
qumicamente combinadas.
Por lo tanto, una mezcla no tiene
un conjunto de propiedades nicas,
sino que cada una de las sustancias
constituyentes aporta al todo con sus
propiedades especficas.
2
UNW- Quimica- ALDA - 2014
UNW- Quimica- ALDA - 2014
3
Caractersticas de las mezclas
Las mezclas estn compuestas
por una sustancia, que es el
medio, en el que se encuentran
una o ms sustancias en menor
proporcin. Se llama fase
dispersante al medio y fase
dispersa a las sustancias que
estn en l
CLASIFICACIN DE LAS MEZCLAS
UNW- Quimica- ALDA - 2014
4
MEZCLA HOMOGENEA
Sus componentes no
pueden observarse a
simple vista y, por
ende, cada porcin de
la mezcla posee las
mismas propiedades
UNW- Quimica- ALDA - 2014
5
MEZCLAS
HETEROGNEAS:
Sus componentes no estn
uniformemente distribuidos
y conservan sus
propiedades individuales.
Se clasifican como coloides,
suspensiones y emulsiones
CLASIFICACIN DE LAS MEZCLAS
UNW- Quimica- ALDA - 2014
6
EMULSIONES:
Conformada por
2 fases lquidas
inmiscibles.
Ejemplos:
agua y aceite,
leche,
mayonesa.
UNW- Quimica- ALDA - 2014
7
SUSPENSIONES:
Conformada por una
fase slida insoluble en
la fase dispersante
lquida, por lo cual
tiene un aspecto opaco.
Ejemplos: Arcilla,
tinta china (negro de
humo y agua), pinturas
al agua, cemento.
UNW- Quimica- ALDA - 2014
8
COLOIDES
Coloide es una sustancia cuyas
partculas pueden encontrarse en
suspensin en un lquido, merced al
equilibrio coloidal.
FASES DE UN SISTEMA COLOIDAL
Fase dispersa: Es la fase que forman
las partculas, puede ser lquida, slida
o gaseosa; y
Medio dispersante: Es el medio en el
cual las partculas se hallan dispersas,
este ultimo puede ser lquido, slido o
gaseoso.
EJEMPLOS DE COLOIDES
UNW- Quimica- ALDA - 2014
9
Fase Dispersa Fase Dispersante Nombre Ejemplo
Slido Lquido Gel o sol Gelatina
Slido Gas Aerosol Humo
Lquido Lquido Emulsin Crema
Lquido Gas Aerosol lquido Niebla
Lquido Slido Emulsin slida Manteca
Gas Slido Espuma slida Esponja
Gas Lquido Espuma lquida
Crema de
afeitar
SOLUCIONES
QUIMICAS
UNW- Quimica- ALDA - 2014
10
SOLUCIONES
mezclas homogneas de dos sustancias
SOLUTO
SOLVENTE
SEGN EL ESTADO FISICO DEL SOLVENTE
SOLIDA LIQUIDA GASEOSA
puede ser
componentes
CLASIFICACION DE SOLUCIONES SEGN
EL ESTADO FISICO DEL DISOLVENTE
UNW- Quimica- ALDA - 2014
11
a)Solucin Liquida:
Cuando el solvente es
liquido
Slido en liquido
Ejemplo: ClNa en agua
Liquido en liquido:
Ejemplo: alcohol en agua
Gas en liquido
Ejemplo: co
2
en agua
UNW- Quimica- ALDA - 2014
12
b) Solucin Solida:
cuando el solvente es solido:
Solido en solido:
Ejemplo: las aleaciones
Liquido en solido:
Ejemplo: mercurio en
oro(amalgama)
Gas en solido:
- Ejemplo: hidrogeno en paladio
CLASIFICACION DE SOLUCIONES SEGN
EL ESTADO FISICO DEL DISOLVENTE
UNW- Quimica- ALDA - 2014
13
c) Solucin Gaseosa
cuando el solvente es gas:
gas en gas:
Ejemplo: el aire
Liquido en gas:
Ejemplo: vapor de agua en aire
Solido en gas:
Ejemplo: partculas de polvo en
el aire
CLASIFICACION DE SOLUCIONES SEGN
EL ESTADO FISICO DEL DISOLVENTE
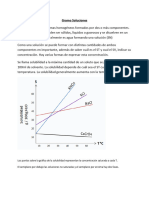
CONCENTRACIN DE UNA SOLUCIN
UNW- Quimica- ALDA - 2014
14
La relacin entre la cantidad de
sustancia disuelta (soluto) y la
cantidad de disolvente se
conoce como concentracin.
Esta relacin se expresa
cuantitativamente en forma de
unidades fsicas y unidades
qumicas, debiendo
considerarse la densidad y la
masa molecular del soluto
UNIDADES
FISICAS
UNW- Quimica- ALDA - 2014
15
1) Porcentaje en masa (m/m): Cantidad de gramos de
soluto disuelto en 100 gramos de solucin.
2) Porcentaje en volumen (V/V): Volumen en mililitros
de soluto disuelto en 100 mililitros de solucin.
UNW- Quimica- ALDA - 2014
16
3) Porcentaje masa a volumen (m/V):
Cantidad de gramos de soluto disuelto en
100 mililitros de solucin.
4) Partes por milln (ppm): Cantidad de
miligramos de soluto disuelto en 1 litro ( 1
Kg) de solucin.
m
soluto
ppm = -------- 110
6
m
solucin
En estas soluciones muy diluidas es tan pequea la
cantidad de soluto que la densidad de la solucion
es muy cercana a la del agua y se considera 1
g/mL.
Ejemplo:
Una muestra de 825 mL de agua contiene 3,5 mg de iones fluoruro
(F
-
). Calcular las partes por milln de ion fluoruro en la muestra.
3,5mg F
-
1 mL muestra 1 g muestra
ppm = ---------------- ---------------- -------------------- 10
6
=
825 mL muestra 1 g muestra 1000 mg de muestra
ppm = 4,2
UNW- Quimica- ALDA - 2014
17
Calcular los miligramos de ion fluoruro (F
-
). en 1,25 L de una
muestra de agua que tiene 4 ppm de ion fluoruro.
1000 mL muestra 1g muestra 1000 mg muestra 4 mg F
-
1,25 L muestra ------------------------ ---------------------- ----------------------------- -------------------------
1 L muestra 1 mL muestra 1g muestra 1.10
6
mg muestra
= 5 mg F
-
UNW- Quimica- ALDA - 2014
18
PROBLEMAS
01. Se disuelven 35 g de cloruro de magnesio (MgCl
2
) en 150 g
de agua dando una solucin cuya densidad es de 1,12 g/cm
3
.
Expresar la concentracin de la solucin resultante en:
a) % m/m, b) % m/v , c) g sto/L sol.
Rpta.: a) 18,92% m/m; b) 21,19% m/v c) 233,33 g sto/L sol
02. Una solucin acuosa de nitrato de potasio (KNO
3
) tiene una
composicin de 42% m/v y una densidad igual a 1,16 g/mL
Calcular su composicin expresada en: a) g sto/100 g ste;
b) g sto/kg sol.
Rpta: a) 56,76 g sto/100 g ste b) 362,07 g sto/kg sol
UNW- Quimica- ALDA - 2014
19
3. Una solucin acuosa de vinagre (CH3COOH) 0,4 % p/v tiene:
a) 0,4 gramos de vinagre en 1000 ml de solucin.
b) 0,4 gramos de vinagre en 1000 ml de solvente.
c) 0,4 moles de vinagre en 100 ml de solucin.
d) 0,4 moles de vinagre en 100 ml de solvente.
e) 0,4 gramos de vinagre en 100
4. . Calcule % p/v si se dispone de 250 ml de una solucin que
contiene 15 g de HCN.
a) 6,0 % p/v b) 0,6 % p/v c) 60 % p/v
d) 66 % p/v e) 0,06 % p/v
UNW- Quimica- ALDA - 2014
20
5. Los solutos y los solventes pueden presentarse en cualquiera
de los estados fsicos de la materia, de modo que al
mezclarlos se obtienen varios tipos de soluciones. De
acuerdo con lo sealado, indique la solucin representativa
del tipo lquido slido.
a) Sal en agua. b) Mercurio en cadmio.
c) Hidrgeno ocluido en platino. d) Oxgeno en agua (l).
e) Hidrgeno en agua (s).
6. Para recuperar la sal disuelta en el agua de mar, convendra
a) filtrar la solucin. b) decantar la solucin.
c) electrolizar el agua de mar. d) centrifugar la solucin.
e) evaporar el agua.
UNW- Quimica- ALDA - 2014
21
7. Algunas de las caractersticas de las soluciones son:
I. No debe existir reaccin qumica entre soluto y solvente.
II. Debe ser homognea desde el punto de vista
macroscpico.
III. El soluto puede separarse por decantacin.
a) Slo I b) Slo II c) Slo III d) Slo I y II e) I,
II y III
8. El % m/V de una solucin de KCl que tiene una concentracin
del 40%m/m ( = 1,5 g/mL), es:
a) 20% b) 40% c) 60% d) 80% e) 90%
9. Calcular la cantidad de gramos de agua que debe aadirse a
10 g de fenol para preparar una solucin acuosa de fenol al
2% m/m
UNW- Quimica- ALDA - 2014
22
10. Un producto de limpieza de uso domstico que no daa el medio
ambiente contiene 25% v/v de aceite de pino, 30% v/v de cido
actico, 15% v/v de aceite de palma y el resto de alcohol.
Cuntos mL
habr que tomar de cada sustancia para obtener 75
mL de solucin limpiadora?
Rpta.: 18,75 mL; 22,5 mL; 11,25 m; 22,5 mL
respectivamente.
11. Qu cantidad de dos disoluciones al 25%m/m y 15%m/m de
acido ntrico se deben mezclar para obtener 1 kg de acido
ntrico al 20%m/m.
12. Se dispone de una solucin al 30% m/m de bromuro de litio
(LiBr), qu masa de agua habr que agregar a 150 g de la
solucin original para obtener una solucin al 10% m/m?
Rpta. 300g
UNW- Quimica- ALDA - 2014
23
13. 400 mL de una solucin acuosa de sulfato de cinc (ZnSO
4
)
al 20% m/v y densidad 1,18 g/mL se mezclan con 200mL
de
agua. Calcular la composicin de la solucin resultante
expresndola en: a) g sto/kg sol; b) g sto/L
ste
Rpta.: a) 119,05 g sto/kg sol b) 135,14 g sto/L ste
14. Calcular el volumen de solucin acuosa de alcohol amlico al
95% m/m ( = 0,80 g/mL) que se necesita para preparar 125
mL de solucin al 30% m/m ( = 0,95 g/mL).
Rpta.: 46,9 mL
UNW- Quimica- ALDA - 2014
24
UNIDADES QUIMICAS
Molaridad (M): se define como la cantidad de sustancia
de soluto, (en moles) por unidad de volumen de
disolucin expresada en litros
UNW- Quimica- ALDA - 2014
25
UNIDADES QUIMICAS
Normalidad (N): Es el nmero de equivalentes
gramo de soluto por unidad de volumen de
disolucin expresada en litros
UNW- Quimica- ALDA - 2014
26
# Eq-g
sto
N = --------------------------------
V
sol
Molalidad (m): se define como la cantidad de
sustancia de soluto, (en moles) por cantidad
de masa del disolvente expresado en
kilogramos.
UNW- Quimica- ALDA - 2014
27
n
sto
mol
sto
m = ---------------- ----------
m
dste
kg
dste
Fraccin Molar (Y): se define como la
relacin entre la cantidad de sustancia
(expresada en moles) de un componente y la
cantidad de sustancia total ( moles totales)
presentes en la solucin.
UNW- Quimica- ALDA - 2014
28
Y
sto
+ Y
ste
= 1
Y
ste
Y
sto
Dilucin: Es la disminucin de la concentracin de una
disolucin donde se agrega disolvente. Si la solucin
es acuosa se le agrega agua destilada; se sabe, la
cantidad de moles del soluto es la misma en la
disolucin inicial y final, solo ha cambiado la cantidad
de disolvente.
Dilucin es: C
1
V
1
= C
2
V
2
Titulacin: Es el proceso completo de la adicin de un
cido o una base a una base o un cido y la
determinacin del punto final o punto de equivalencia;
en el cual el cido o la base ha sido totalmente
neutralizado.
UNW- Quimica- ALDA - 2014
29
Una solucin bsica contiene iones hidroxilo (OH
-
) y una solucin
cida contiene protones (H
+
). Al caer los iones H
+
(OH
-
) sobre
los OH
-
(H
+
) se producir una reaccin llamada de Neutralizacin
segn la ecuacin:
H
+
+ OH
-
Acido + Base Sal + agua
Al neutralizarse la solucin se tiene:
#Eq-g
acido
= #Eq-g
base
Pero:
#Eq-g = NV, que proviene de la ecuacin de normalidad. Luego en
la reaccin de neutralizacin se cumple
N
a
V
a
= N
b
V
b
UNW- Quimica- ALDA - 2014
30
El punto de
equivalencia se
observa mediante el
cambio de color del
indicador.
Indicador: Es una
sustancia de
estructura compleja,
cuyo color es distinto
segn se este en
presencia de un cido
o de una base.
UNW- Quimica- ALDA - 2014
31
UNW- Quimica- ALDA - 2014
32
SITUACIONES
PROBLEMATICAS
La cantidad de plomo permitida
en el agua por la
organizacin Mundial de la
Salud (OMS) es de 1,3 ppm.
Una muestra de 300 mL
( = 1 g/mL) de agua de un
punto de muestreo cercana a
una empresa minera contiene
88.92 mg de iones Pb
+2
.
Calcule la concentracin de
estos iones en ppm.
Un estudiante del curso de Qumica
trata de preparar una solucin
similar al vinagre mezclando 10 g
de cido actico (CH
3
COOH, masa
molecular = 60 g/mol, = 1,02
g/mL) y 200 g de agua ( = 1
g/mL). Determinar:
a) %m/m de la disolucin resultante.
NOTA. El vinagre contiene
tpicamente una concentracin que va
de 3% al 5% de cido actico
b) molaridad de la solucin.
UNW- Quimica- ALDA - 2014
33
SITUACIONES
PROBLEMATICAS
UNW- Quimica- ALDA - 2014
34
1. Cuntos equivalentes gramo hay en 2 litros de una solucin NaOH 2N?
a) 2 b) 4 c) 6 d) 8 e) 10
2. Se tienen 1,5 litros de una solucin de CuSO
4
2M Cuntos equivalentes
tiene?
a) 6 b) 2 c) 3 d) 4 e) 5
3. Una solucin de HCl se prepara a partir de 20g HCl Y 480 g de H
2
O. Hallar el
porcentaje de masa de HCl en agua.
a) 4 b) 8 c) 12 d) 16 e) 20
4. Una solucin de NaOH es preparada a partir de de 40mL de NaOH y 760mL
de H
2
O Cul es el porcentaje en volumen de NaOH?
a) 1% b) 5% c) 10% d) 15% e) 20%
5. Hallar el porcentaje en volumen de solucin (%V/V) de Al(OH)
3
si el volumen
de solucin es tres veces de volumen de Al(OH)
3
a) 90% b) 60% c) 33,33% d) 66,66% e) 99%
UNW- Quimica- ALDA - 2014
35
06. Hallar la molaridad y normalidad de una solucin de 2000 mL que
contiene 400g NaOH
a) 1; 1 b) 3; 3 c) 5; 5 d) 7; 7 e) N.A
07. Se tiene 500 mL de una solucin de 0.8 molar de NaOH Cuntos
litros de agua debemos agregar para obtener una solucin de 0,02
molar de NaOH?
a) 95 L b) 100L c) 150L d) 195L e) 205L
08. Calcule la normalidad de una solucin que contiene 29,4g de yoduro
de calcio (CaI
2
) por litro
a) 0,1 N b) 0,2 N c) 0,3 N d) 3 e) 2N
09. Qu cantidad de NaOH se necesita para preparar 0,5 L de
disolucin 3,5 N?
a) 35g b) 40g c) 50g d) 70g e) 100g
UNW- Quimica- ALDA - 2014
36
10. Cuntos gramos de NaOH y agua se requieren para preparar 150
gramos de una solucin de NaOH al 15,6% en peso?
a) 23,4 g b) 126,6 g c) 2,34 g d) 234 e) N.A
126,6 g 23,4 g 12,66 g 1266
11. Hallar la molaridad de una solucin que contiene 78 gramos de
H
3
AsO
4
en 450 mL de una solucin.
a) 12,2M b) 0,122M c) 1,22M d) 1M e) N.A
12. Calcular la masa de (NH
4
)
2
SO
4
que se requiere para preparar 1,5
litros de solucin de (NH
4
)
2
SO
4
de 0,388 M
a) 7,68g b) 76,82g c) 768,2g d) 7682g e) N.A
13. Halle la masa de NaOH que se requiere para preparar 3,5 L de
solucin NaOH de 2,54 M
a) 7,25g b) 72,5g c) 35,56g d) 355,6g e) N.A
UNW- Quimica- ALDA - 2014
37
14. Determine la normalidad de una solucin preparada a partir de
80 g de NaCl, los que se disuelven hasta obtener 1,5 litros de
solucin.
a) 0,5 N b) 0,25 N c) 0,91 N d) 2 N e) N.A
15. Calcular la normalidad de una solucin que contiene 380 g de
cido fosfrico H
3
PO
4
en dos litros de solucin.
a) 5,82N b) 1,94N c) 3N d) 2,5N e) N.A
16. Qu masa de Na
2
SO
4
, existe en 750 mL de una solucin 2M de
Na
2
SO
4
?
a) 2,13 g b) 21,3 g c) 213 g d) 0,213 g e) N.A
UNW- Quimica- ALDA - 2014
38
You might also like
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadFrom EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadNo ratings yet
- Dick, Philip K. - La Penultima VerdadDocument119 pagesDick, Philip K. - La Penultima VerdadDan AragonzNo ratings yet
- Tarea de Quimia-Quispe Torres MarianellaDocument21 pagesTarea de Quimia-Quispe Torres MarianellaEsther Canchari aurisNo ratings yet
- Soluciones Disoluciones y Diluciones ProblemasDocument10 pagesSoluciones Disoluciones y Diluciones ProblemasMartín LeivaNo ratings yet
- Test Quimica AnaliticaDocument14 pagesTest Quimica AnaliticaRichard ParkerNo ratings yet
- Lista de Precios 2017 CrocDocument10 pagesLista de Precios 2017 CrocFRANCISCO JAVIER OCAÑA SANTIAGO100% (5)
- MonografiaDocument18 pagesMonografiaMeyling GarcíaNo ratings yet
- Soluciones Concentraciones by Jose GomezDocument10 pagesSoluciones Concentraciones by Jose GomezJosheloteNo ratings yet
- Guia N°1 Unidades de Concentracion FisicasDocument4 pagesGuia N°1 Unidades de Concentracion FisicassonyNo ratings yet
- IV Bim. 3er. Año - QUIM. - Guia #1 - Soluciones IDocument5 pagesIV Bim. 3er. Año - QUIM. - Guia #1 - Soluciones IDavidSalazar25% (4)
- Guia Nº1 % P-P, P-V y V-VDocument4 pagesGuia Nº1 % P-P, P-V y V-VAylichi Orteaga100% (1)
- FMH Chi 2012.-SolucionesDocument84 pagesFMH Chi 2012.-SolucionesFranklin Guevara75% (4)
- QuimicaDocument13 pagesQuimica01-IC-HU-ROMEL JESUS QUIJADA URIBARRINo ratings yet
- Taller Soluciones 2019Document5 pagesTaller Soluciones 2019Mario Jiménez OrozcoNo ratings yet
- PRACTICA 10 SolucionesDocument10 pagesPRACTICA 10 SolucionesJesus CastilloNo ratings yet
- Copia de Guia N° 9 - SolucionesDocument6 pagesCopia de Guia N° 9 - SolucionesJorge RopónNo ratings yet
- EjerciciosdesolucionesDocument6 pagesEjerciciosdesolucionesKathy V TorresNo ratings yet
- GUIA Unidades Fi769sicas de Concentracio769nDocument1 pageGUIA Unidades Fi769sicas de Concentracio769nLilian Andrea Carreño OrellanaNo ratings yet
- GUIA Unidades Fi769sicas de Concentracio769nDocument1 pageGUIA Unidades Fi769sicas de Concentracio769nLilian Andrea Carreño Orellana100% (1)
- DisolucionesDocument7 pagesDisolucionesCamila OlarteNo ratings yet
- Laboratorio de Quimica (Titulación)Document11 pagesLaboratorio de Quimica (Titulación)Kahoris100% (1)
- Modulo 6 - 2020Document18 pagesModulo 6 - 2020Gisex Von LouzerNo ratings yet
- Ejer Cici OsDocument4 pagesEjer Cici Osbrenda sanchez arroyoNo ratings yet
- Solsem 10Document10 pagesSolsem 10Jorge Cesar Rojas RamosNo ratings yet
- SolucionesDocument15 pagesSolucionesBelén Ornelas100% (1)
- Clase ModeloDocument27 pagesClase ModeloMareliChavezAlNo ratings yet
- Soluciones 1515170404Document13 pagesSoluciones 1515170404ChelseaSaavedra50% (2)
- SolucionesDocument3 pagesSolucionesGloria Fuentes CastilloNo ratings yet
- Concentracion de Disoluciones FinalDocument38 pagesConcentracion de Disoluciones FinalErikaVargasNo ratings yet
- IQ2012-Guia 7Document10 pagesIQ2012-Guia 7Elizabeth RamosNo ratings yet
- Anexo 21Document10 pagesAnexo 21Liz Herrera Milian100% (1)
- 1Document11 pages1Cristian MoraNo ratings yet
- Practica n5Document11 pagesPractica n5Revin Mamani Salamanca100% (1)
- FMH - Chi - 2014.-SolucionesDocument96 pagesFMH - Chi - 2014.-SolucionesSergio Leonel Moran StechmannNo ratings yet
- Guía de Actividades - DisolucionesDocument3 pagesGuía de Actividades - DisolucionesZachaNo ratings yet
- Unidad 5Document7 pagesUnidad 5German YaibonaNo ratings yet
- Guía 4 Paola LizamaDocument8 pagesGuía 4 Paola LizamaDiego Andres DiazNo ratings yet
- SerieDocument4 pagesSerieLuciana NeirotNo ratings yet
- VERP2Document3 pagesVERP2tenoriojantonioNo ratings yet
- Clase 8 - QuímicaDocument69 pagesClase 8 - QuímicaAlexSanchezSantosNo ratings yet
- Unidades de Concentracion 10°Document39 pagesUnidades de Concentracion 10°MN LPXNo ratings yet
- FMH Chi 2012 SolucionesDocument84 pagesFMH Chi 2012 SolucionesasummathNo ratings yet
- Semana 11 SolucionesDocument35 pagesSemana 11 SolucionesJhon HSNo ratings yet
- Agroquimica JorgeLuisCruzOrdoñez PDFDocument7 pagesAgroquimica JorgeLuisCruzOrdoñez PDFRodrigo Estudillo LopezNo ratings yet
- Practica Laboratorio Preparacion y Valoración de SolucionesDocument7 pagesPractica Laboratorio Preparacion y Valoración de SolucionesRatata PatataNo ratings yet
- Taller de SolucionesDocument2 pagesTaller de SolucionesMaickoll ValorNo ratings yet
- Estado LiquidoDocument19 pagesEstado LiquidoFernando R QquelccaNo ratings yet
- Guía de Ejercicios de Unidades de Concentracion FisicasDocument3 pagesGuía de Ejercicios de Unidades de Concentracion FisicasCamila Barrera MenesesNo ratings yet
- Soluciones Taller y GuíaDocument8 pagesSoluciones Taller y GuíaJaiider AmadoNo ratings yet
- Guia Lab 7-Preparación de Soluciones PDFDocument3 pagesGuia Lab 7-Preparación de Soluciones PDFKarina Ardila PardoNo ratings yet
- Formas de Expresar La ConcentraciónDocument3 pagesFormas de Expresar La ConcentraciónValeria MeldyNo ratings yet
- Apartado2 - QUIMICADocument21 pagesApartado2 - QUIMICAJose L. Montenegro P.No ratings yet
- Soluciones Ingreso 26-8-2021Document13 pagesSoluciones Ingreso 26-8-2021verocatebielNo ratings yet
- Tema 1 - Unidades de Concentracion Fisica y QuimicasDocument8 pagesTema 1 - Unidades de Concentracion Fisica y QuimicasluishugoNo ratings yet
- GuiadesolucionesDocument4 pagesGuiadesolucionesMiguel Oscar Silva PachecoNo ratings yet
- Soluciones 2022Document21 pagesSoluciones 2022Benítez Lanchimba Joshua SebastiánNo ratings yet
- Preparacion de Soluciones QuimicasDocument12 pagesPreparacion de Soluciones QuimicasKELLY FLORESNo ratings yet
- Guia Con Soluciones QuimicasDocument4 pagesGuia Con Soluciones QuimicasBrianda AndreaNo ratings yet
- SOLUCIONES Q DxI 2020Document9 pagesSOLUCIONES Q DxI 2020Cristhian Andres SolarteNo ratings yet
- Taller Concentracion de Soluciones Ciencias 9Document5 pagesTaller Concentracion de Soluciones Ciencias 9jalilie nayibe0% (1)
- Guia de Problemas Nº4 PDFDocument6 pagesGuia de Problemas Nº4 PDFMaxy VeraNo ratings yet
- Cap 6 - SolucionesDocument6 pagesCap 6 - SolucionesEfrim Diak Montesinos PerezNo ratings yet
- Cap 6 - SolucionesDocument6 pagesCap 6 - SolucionesHilary RamosNo ratings yet
- Tarea No 1 Estadistica InferencialDocument6 pagesTarea No 1 Estadistica InferencialElías ParedesNo ratings yet
- Actividad 3 PDFDocument4 pagesActividad 3 PDFeagualtero0% (2)
- Asepsia Quirurgica 2017-Ii Marina XlviDocument61 pagesAsepsia Quirurgica 2017-Ii Marina Xlvileyto123No ratings yet
- FUNDICIONESDocument31 pagesFUNDICIONESTordoya Valda Paolo AugustoNo ratings yet
- HERBICIDOLOGÍADocument6 pagesHERBICIDOLOGÍAedgardagronomoNo ratings yet
- Estatica - 1Document10 pagesEstatica - 1Erika Cisneros JimenezNo ratings yet
- CurBat Constr 1a20Document21 pagesCurBat Constr 1a20BetancourtNo ratings yet
- Informe de Transiciones Electronicas - 02Document16 pagesInforme de Transiciones Electronicas - 02Kevin SánchezNo ratings yet
- LipidosDocument78 pagesLipidosLuciano SernaNo ratings yet
- Carlos Magno Chavarry-Vallejos: CorrespondenciaDocument30 pagesCarlos Magno Chavarry-Vallejos: CorrespondenciaIvonNo ratings yet
- Corte DirectoDocument13 pagesCorte DirectoIsrael RodriguezNo ratings yet
- Resumen Equilibrios de SilvaDocument7 pagesResumen Equilibrios de SilvaGabo Alejo AguirreNo ratings yet
- Especificaciones Tecnicas Planta de TratamientoDocument4 pagesEspecificaciones Tecnicas Planta de TratamientoCsd Saprissa De GuatemalaNo ratings yet
- REVISTA Lista para ImprimirDocument10 pagesREVISTA Lista para ImprimirpatyNo ratings yet
- El CompusDocument2 pagesEl CompusELIAZAR FRANCISCO CHOQQUE TTITONo ratings yet
- Reconocimiento de CompresoresDocument4 pagesReconocimiento de CompresoresLenin PillajoNo ratings yet
- Microscopia de MenaDocument14 pagesMicroscopia de MenaTito Méndez SandovalNo ratings yet
- Proyecto Papaya FinalDocument52 pagesProyecto Papaya FinalYevis Danibys Peluffo Segura94% (16)
- ADITIVOSDocument14 pagesADITIVOSDaniela RodriguezNo ratings yet
- PCBs-aceite de Transformadores PDFDocument16 pagesPCBs-aceite de Transformadores PDFmapsengineeringNo ratings yet
- Guia Ciclo Del Fosforo 1HDocument4 pagesGuia Ciclo Del Fosforo 1HGloria Angelica Acuña Delgado100% (2)
- ArenasDocument21 pagesArenasMichel DominguezNo ratings yet
- Proceso de Temple para CincelDocument3 pagesProceso de Temple para CincelJezz AmoresNo ratings yet
- Radicales OrganicosDocument7 pagesRadicales OrganicosPedroCruzdePiedraNo ratings yet
- Proceso CurtiembreDocument34 pagesProceso CurtiembreJose StefaniaNo ratings yet
- Ohanian Fisica 3e Capitulo Muestra 22Document28 pagesOhanian Fisica 3e Capitulo Muestra 22Carlos RochaNo ratings yet