Professional Documents
Culture Documents
Compuestos-Aromaticos y Alcvoholes Exposicion
Uploaded by
Sidalia Mercedes Taveras0%(1)0% found this document useful (1 vote)
93 views13 pagesalcoholes
Copyright
© © All Rights Reserved
Available Formats
PPT, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this Documentalcoholes
Copyright:
© All Rights Reserved
Available Formats
Download as PPT, PDF, TXT or read online from Scribd
0%(1)0% found this document useful (1 vote)
93 views13 pagesCompuestos-Aromaticos y Alcvoholes Exposicion
Uploaded by
Sidalia Mercedes Taverasalcoholes
Copyright:
© All Rights Reserved
Available Formats
Download as PPT, PDF, TXT or read online from Scribd
You are on page 1of 13
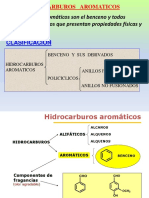
COMPUESTOS AROMATICOS
Los hidrocarburos aromáticos son compuestos insaturados de
un tipo especial. Originalmente recibieron el nombre de
aromáticos debido al aroma que algunos poseen. Sin embargo
no todos son odoríferos y muchos compuestos fragantes no son
de tipo aromático.
Uno de los compuestos más simples y que se conoció primero
con la estructura especial característica de los compuestos
aromáticos fue el hidrocarburo benceno.
NOMENCLATURA
En muchos de los casos de los derivados del benceno , basta con
anteponer el nombre del grupo sustituyente a la palabra benceno
por ejemplo:
Nomenclatura
El sistema IUPAC de nomenclatura para los hidrocarburos
aromáticos conserva un gran número de nombres comunes Así
aunque los compuestos siguientes se podrían nombrar como
bencenos sustituidos , los nombres comunes que se muestran son de
uso casi universal.
Si el anillo bencénico tiene unidos a él más de dos grupos se utilizan
números para indicar sus posiciones relativas, por ejemplo:
Todo benceno disustituido tiene tres isómeros constitucionales, y
existen dos métodos aceptables para escribir la orientación
relativa de los sustituyentes: mediante el uso de números de
posición relativa, y empleando las designaciones orto, meta y para
que se suelan abreviar como o, m y p.
Si los dos grupos son diferentes y ninguno de ellos confiere un grupo
especial a la molécula se nombran sucesivamente y se termina con la
palabra benceno.
Si uno de los dos grupos es del tipo que le da a la molécula un nombre
especial el compuesto se denomina como un derivado de aquella
sustancia especial:
Estructura del benceno
1. 1825, descubierto por Faraday: líquido de p.e. 80ºC
2. 1834, Mitscherlich lo sintetiza y determina su fórmula
molecular C6H6
3. 1866 Kekulé propuso una estructura cíclica de
ciclohexatrieno:
4. No se comporta como insaturado:
- no decolora Br2/Cl4C Br
- no se oxida con KMnO4
Br2
+ H
H
Cl4C
Br
Br
Br2
Br2, FeBr3
HBr + + No hay reacción
Cl4C Cl4C
Regla de Hückel. Comp. aromáticos y
antiaromáticos
Son compuestos
Son compuestos aromáticos los antiaromáticos si cumplen
que los tres primeros criterios,
pero:
cumplen los siguientes criterios:
La deslocalización de
Compuesto cíclicos y electrones p sobre el anillo,
completamente conjugados causa un aumento de la Ep,
siendo menos estable que el
Cada carbono del anillo debe correspondiente compuesto
tener un orbital p no hibridado de cadena abierta. Ej.:
Los orbitales p no hibridados
deben solapar para formar un
anillo continuo de orbitales
paralelos. La estructura debe ser menos estable que
plana o casi plana para que el
solapamiento de los orbitales p
sea efectivo.
La deslocalización de electrones
p origina una disminución de la Ep
(mayor estabilidad) Ej.: benceno
Regla de Hückel (1931) permite predecir cuando un compuesto
cíclico, plano, con dobles enlaces alternados es aromático:
•Si el nº de electrones p es 4n+2, el sistema es aromático
•Si el nº de electrones p es 4n, el sistema es antiaromático
Propiedades físicas y químicas de los
alcoholes
Alcoholes: Se producen al sustituir uno o mas átomos de hidrogeno por
grupos hidroxilo (OH) en los Hidrocarburos saturados y no saturados.
Propiedades físicas:
Solubilidad: La formación de puentes de hidrógeno cuando los oxígenos
unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las
del agua permite la asociación entre las moléculas de alcohol. A partir del
hexanol son solubles solamente en solventes orgánicos.
Punto de ebullición: Aumenta con la cantidad de átomos de carbono y
disminuye con el aumento de las ramificaciones.
Punto de fusión: Aumenta a medida que aumenta la cantidad de carbonos.
Densidad: La densidad de los alcoholes aumenta con el número de carbonos
Propiedades químicas:
ESHIDRATDACIÓN: Es una propiedad de los alcoholes mediante la cual
podemos obtener éteres o alquenos.
HALOGENACIÓN: El alcohol reacciona con el ácido hidrácido para formar
haluros de alquilo mas agua.
DESHIDROGENACIÓN: Los alcoholes primarios y secundarios cuando se
calientan en contacto con ciertos catalizadores, pierden átomos de
hidrógeno para formar aldehídos o cetonas.
OXIDACIÓN: La oxidación es la reacción de alcoholes para producir ácidos
carboxílicos, cetonas o aldehídos dependiendo de el tipo de alcohol y de
catalizador.
You might also like
- Aromaticos 14 PDFDocument45 pagesAromaticos 14 PDFOscar CuestasNo ratings yet
- Hidrocarburos Alifáticos y Aromáticos TrabajoDocument6 pagesHidrocarburos Alifáticos y Aromáticos TrabajoRossanaMarquezDiazNo ratings yet
- Guia AromaticosDocument8 pagesGuia AromaticosReyna RomanoNo ratings yet
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaFrom EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaRating: 5 out of 5 stars5/5 (1)
- BecenosDocument6 pagesBecenosAlex Gutierrez MarquezNo ratings yet
- Clase Tema 1 - Nomenclatura-1Document37 pagesClase Tema 1 - Nomenclatura-1Camila SanchezNo ratings yet
- Tema 2Document40 pagesTema 2liliNo ratings yet
- Compuestos Aromaticos - Quimica OrganicaDocument64 pagesCompuestos Aromaticos - Quimica OrganicaHarry Alonso Avellaneda LizanaNo ratings yet
- Hidrocarburos AromáticosDocument7 pagesHidrocarburos AromáticosAna Paola Q VNo ratings yet
- Nomenclatura Orgánica - Hidrocarburos Aromáticos (Completo)Document17 pagesNomenclatura Orgánica - Hidrocarburos Aromáticos (Completo)Abel Contreras MaytaNo ratings yet
- Tema 1.1Document11 pagesTema 1.1Yhoselyn MareñoNo ratings yet
- Hidrocarburos AromaticosDocument82 pagesHidrocarburos AromaticosCesar AvilaNo ratings yet
- Importante Síntesis de Laboratorio Anillos Aromáticos - 211Document14 pagesImportante Síntesis de Laboratorio Anillos Aromáticos - 211CarlosNo ratings yet
- Los Hidrocarburos y Su ClasificaciónDocument18 pagesLos Hidrocarburos y Su Clasificaciónlourdes peñaNo ratings yet
- Libro Ultimo QuimicaDocument210 pagesLibro Ultimo Quimicaprografic.3020No ratings yet
- Guia AromaticosDocument10 pagesGuia AromaticosYolehidis Franchesca Sena VasquezNo ratings yet
- Guia 11°-Quimica Organica IntroduccionDocument5 pagesGuia 11°-Quimica Organica IntroduccionAnselmo Correa HernandezNo ratings yet
- Compuestos - Aromaticos 20-21Document42 pagesCompuestos - Aromaticos 20-21Manuel GordilloNo ratings yet
- Cap. 15 AromáticosDocument25 pagesCap. 15 AromáticosCésar GastélumNo ratings yet
- Compuestos AromaticosDocument50 pagesCompuestos Aromaticoseuaa_9201100% (6)
- Alcanos, Alquenos y AlquinosDocument0 pagesAlcanos, Alquenos y AlquinosRoberto RivasNo ratings yet
- QC-12 Quimica OrganicaDocument24 pagesQC-12 Quimica OrganicaDania Alvo DueñasNo ratings yet
- Hidrocarburos AromaticosDocument14 pagesHidrocarburos AromaticosSidalia Mercedes TaverasNo ratings yet
- Hidrocarburos Aromaticos III 2020Document11 pagesHidrocarburos Aromaticos III 2020Jessenia Ponce VillatoroNo ratings yet
- Compuestos Aromaticos DerivadosDocument25 pagesCompuestos Aromaticos DerivadosAndrea Vivianna Alcalá ValcárcelNo ratings yet
- 11-3 Karol González Taller de Recuperación 4 Periodo QuímicaDocument11 pages11-3 Karol González Taller de Recuperación 4 Periodo QuímicaJosé MorenoNo ratings yet
- AromaticidadDocument6 pagesAromaticidadMilagros Valinotti GaunaNo ratings yet
- Informe Hidrocarburos Aromaticos Chamaco Mamani Leslie LisbethDocument15 pagesInforme Hidrocarburos Aromaticos Chamaco Mamani Leslie LisbethJhoselyn Isabel Usmayo QuispeNo ratings yet
- Aromaticidad TautomeriaDocument11 pagesAromaticidad TautomeriaceabymmbtNo ratings yet
- Hidrocarburos AromáticosDocument82 pagesHidrocarburos AromáticosLuis E Aguilar RNo ratings yet
- Importante Síntesis de Laboratorio para Obtener Anillos Aromáticos - 034Document21 pagesImportante Síntesis de Laboratorio para Obtener Anillos Aromáticos - 034CarlosNo ratings yet
- HIDROCARBUROS SAT. INSAT y AROMAT.Document30 pagesHIDROCARBUROS SAT. INSAT y AROMAT.Kade CadeNo ratings yet
- Hidrocarburos AromaticosDocument69 pagesHidrocarburos AromaticosElvis Rogers PakitaNo ratings yet
- 18 Hidrocarburos Aromaticos 2019 IfddcDocument35 pages18 Hidrocarburos Aromaticos 2019 IfddcDocente Juanpablino 31No ratings yet
- Grupos Funcionales 11°Document12 pagesGrupos Funcionales 11°Fredys RivasNo ratings yet
- Unidad III. Introduccion A Los Compuestos OrgánicosDocument37 pagesUnidad III. Introduccion A Los Compuestos Orgánicosabigail.ramirez.herreraNo ratings yet
- AlcanosDocument14 pagesAlcanosSofi SofiNo ratings yet
- Clase Alquenos, Alquinos, AromaticosDocument21 pagesClase Alquenos, Alquinos, Aromaticosnobody :bNo ratings yet
- Actividad 2. Quimica Informe. HIDROCARBUROS CÍCLICOS Y AROMÁTICOS, HALUROS DE ALQUILO, ALCOHOLES, ÉTERESDocument13 pagesActividad 2. Quimica Informe. HIDROCARBUROS CÍCLICOS Y AROMÁTICOS, HALUROS DE ALQUILO, ALCOHOLES, ÉTERESMara100% (1)
- Funciones Químicas de Los HidrocarburosDocument13 pagesFunciones Químicas de Los HidrocarburosJangel M. LeónNo ratings yet
- Química Del CarbonoDocument12 pagesQuímica Del CarbonoJesus DiazNo ratings yet
- Informe de Laboratorio de Hidrocarburos AromaticosDocument20 pagesInforme de Laboratorio de Hidrocarburos Aromaticosalejandro50% (2)
- Arenos y BencenosDocument15 pagesArenos y BencenosChavaCoconBernardoNo ratings yet
- Clasificacion y Propiedades de Los Compuestos Organicos PDFDocument16 pagesClasificacion y Propiedades de Los Compuestos Organicos PDFJonathan RicoNo ratings yet
- Introducción A La Química OrgánicaDocument41 pagesIntroducción A La Química OrgánicaIleana GómezNo ratings yet
- Introduccion A La Quimica OrganicaDocument43 pagesIntroduccion A La Quimica OrganicaQuinterosNo ratings yet
- Compuestos Aromáticos 2Document9 pagesCompuestos Aromáticos 2Betzy Valery Poma PerezNo ratings yet
- Sesión 6. AromáticosDocument30 pagesSesión 6. AromáticosDayana AhumadaNo ratings yet
- Unidad 1.Parte1.QuimicaCompOxi Sept-Oct 2019Document114 pagesUnidad 1.Parte1.QuimicaCompOxi Sept-Oct 2019Luis DominguezNo ratings yet
- Felix Marco Teorico FinalDocument11 pagesFelix Marco Teorico FinalstainNo ratings yet
- Hidrocarburos CiclicosDocument5 pagesHidrocarburos CiclicosMario Tenorio PerezNo ratings yet
- Hidrocarburos AromaticosDocument120 pagesHidrocarburos AromaticosHeidy EspejoNo ratings yet
- Quimica OrganicaDocument24 pagesQuimica OrganicaPamela SalasNo ratings yet
- Inocuidad de Los Alimentos - Aseguramiento de La CalidadDocument25 pagesInocuidad de Los Alimentos - Aseguramiento de La Calidadjannie100% (1)
- Trabajo de Psicologia de La Motivacion AndreaDocument7 pagesTrabajo de Psicologia de La Motivacion AndreaSidalia Mercedes TaverasNo ratings yet
- KeidyDocument9 pagesKeidySidalia Mercedes TaverasNo ratings yet
- Diagrama de Flujo de ProcesosDocument3 pagesDiagrama de Flujo de ProcesosSidalia Mercedes TaverasNo ratings yet
- Inocuidad de Los Alimentos - Aseguramiento de La CalidadDocument25 pagesInocuidad de Los Alimentos - Aseguramiento de La Calidadjannie100% (1)
- Formulario para Control de Agua HidromedDocument1 pageFormulario para Control de Agua HidromedSidalia Mercedes TaverasNo ratings yet
- Casos de Produccion Copy0101Document10 pagesCasos de Produccion Copy0101Sidalia Mercedes TaverasNo ratings yet
- Obtención Del EtanolDocument6 pagesObtención Del EtanolJose Eduardo CaceresNo ratings yet
- Curriculum DentistaDocument1 pageCurriculum DentistaLutby Emilio GaitánNo ratings yet
- Dibujo Industrial ResumenDocument11 pagesDibujo Industrial ResumenSidalia Mercedes TaverasNo ratings yet
- Ley Productos FarmaceuticosDocument89 pagesLey Productos FarmaceuticosSidalia Mercedes TaverasNo ratings yet
- Programacion Lineal EnteraDocument50 pagesProgramacion Lineal EnteraÁlvaro_cayetanoNo ratings yet
- Clase 1 - Qué Es Una Operación UnitariaDocument19 pagesClase 1 - Qué Es Una Operación UnitariaYuliet A.No ratings yet
- CAPITULO 2 - Tipos de MantenimientoDocument9 pagesCAPITULO 2 - Tipos de MantenimientoDanielIncisoNo ratings yet
- Compuestos-Aromaticos y Alcvoholes ExposicionDocument13 pagesCompuestos-Aromaticos y Alcvoholes ExposicionSidalia Mercedes Taveras0% (1)
- Segundo Trabajo de Casos de ProduccionDocument12 pagesSegundo Trabajo de Casos de ProduccionSidalia Mercedes TaverasNo ratings yet
- Como Generar Ideas Mi Parte Del TrabajoDocument1 pageComo Generar Ideas Mi Parte Del TrabajoSidalia Mercedes TaverasNo ratings yet
- Como Generar Ideas Mi Parte Del TrabajoDocument2 pagesComo Generar Ideas Mi Parte Del TrabajoSidalia Mercedes TaverasNo ratings yet
- Cuestionario Pagina 6Document1 pageCuestionario Pagina 6Sidalia Mercedes TaverasNo ratings yet
- Ingenieria Ambiental Trabajo TerminadoDocument9 pagesIngenieria Ambiental Trabajo TerminadoSidalia Mercedes TaverasNo ratings yet
- Dibujo Industrial ResumenDocument11 pagesDibujo Industrial ResumenSidalia Mercedes TaverasNo ratings yet
- Analisis y Evaluacion de Puestos SidaliaDocument9 pagesAnalisis y Evaluacion de Puestos SidaliaSidalia Mercedes TaverasNo ratings yet
- Programacion Lineal EnteraDocument2 pagesProgramacion Lineal EnteraSidalia Mercedes TaverasNo ratings yet
- Mapa Mental Sobre Las Caracteristicas Del EmprendedorDocument1 pageMapa Mental Sobre Las Caracteristicas Del EmprendedorSidalia Mercedes TaverasNo ratings yet
- Analisis y Evaluacion de Puestos SidaliaDocument1 pageAnalisis y Evaluacion de Puestos SidaliaSidalia Mercedes TaverasNo ratings yet
- Exposicion Psicologia Analisis de Puestos de TrabajoDocument17 pagesExposicion Psicologia Analisis de Puestos de TrabajoSidalia Mercedes TaverasNo ratings yet
- Exposicion Psicologia Analisis de Puestos de TrabajoDocument17 pagesExposicion Psicologia Analisis de Puestos de TrabajoSidalia Mercedes TaverasNo ratings yet
- Trabaj Espa 2Document3 pagesTrabaj Espa 2Sidalia Mercedes TaverasNo ratings yet
- Trabaj Espa 2Document3 pagesTrabaj Espa 2Sidalia Mercedes TaverasNo ratings yet
- Trabajo de Ingenieria de Costo 2do ParcialDocument11 pagesTrabajo de Ingenieria de Costo 2do ParcialSidalia Mercedes TaverasNo ratings yet
- Autooxidación QuímicaDocument1 pageAutooxidación QuímicaAlex OwenNo ratings yet
- Analisis Funcional PDFDocument23 pagesAnalisis Funcional PDFFlorencia PeñaNo ratings yet
- Tema 5Document60 pagesTema 5TonyFontana100% (1)
- Actividades de Amae-03Document8 pagesActividades de Amae-03Wilberth A. Gomez SilvaNo ratings yet
- Guía # 1. Grado 11Document3 pagesGuía # 1. Grado 11placido10No ratings yet
- EpoxidosDocument5 pagesEpoxidosNadia AuzsaNo ratings yet
- Reguladores de AcidezDocument4 pagesReguladores de AcidezAngie Gabriela Julca CastroNo ratings yet
- Acidos CarboxilicosDocument30 pagesAcidos Carboxilicosyidhy llanosNo ratings yet
- OrganohalogenurosDocument20 pagesOrganohalogenurosJONATHAN CHOQUE CORONADONo ratings yet
- Grupos Funcionales Con Enlaces Múltiples Al CarbonoDocument43 pagesGrupos Funcionales Con Enlaces Múltiples Al CarbonoLezlie MartinezNo ratings yet
- Laboratorio 5 Aldehidos y CetonasDocument11 pagesLaboratorio 5 Aldehidos y CetonasFernanda MartinezNo ratings yet
- Hidrocarburos Cíclicos - CicloalcanosDocument22 pagesHidrocarburos Cíclicos - CicloalcanosBRIGADIER SEMANANo ratings yet
- Informe 2-Fenilindol DiegoDocument13 pagesInforme 2-Fenilindol DiegoDiego Giraldo BoteroNo ratings yet
- Practica 3 MetilnaftaliticoDocument15 pagesPractica 3 MetilnaftaliticoAle Maldonado SantosNo ratings yet
- Modulo Quimica Grado 11Document29 pagesModulo Quimica Grado 11Angel MorenoNo ratings yet
- El Poema Del PedoDocument5 pagesEl Poema Del PedoStarplex Antonio73% (11)
- Nomenclatura de Los AlquinosDocument4 pagesNomenclatura de Los AlquinosLyam Van-shtralenNo ratings yet
- Upos Funcionales 1 EmvDocument58 pagesUpos Funcionales 1 EmvJocelyn Grisel García GonzálezNo ratings yet
- AldehidosDocument3 pagesAldehidoskaledNo ratings yet
- Lipidos Clase 7Document69 pagesLipidos Clase 7Sergio ForgioneNo ratings yet
- Biomoléculas OrgánicasDocument9 pagesBiomoléculas OrgánicasDavid ReynosoNo ratings yet
- Alquenos ExpoDocument8 pagesAlquenos ExpoSandra Sierra ZamoraNo ratings yet
- Nomenclatura de Alcanos AciclicosDocument4 pagesNomenclatura de Alcanos AciclicosMiguel GonzalezNo ratings yet
- ALQUINOS QuimicaDocument4 pagesALQUINOS QuimicaNahum BarreraNo ratings yet
- Caracterización de Aldehídos y CetonasDocument5 pagesCaracterización de Aldehídos y CetonasJohan ArcilaNo ratings yet
- Tarea ELECTREDocument1 pageTarea ELECTREDiana HernándezNo ratings yet
- Acidos Carboxilicos02Document41 pagesAcidos Carboxilicos02Ronald Remon Cruz100% (1)
- Historia de La Química OrganometálicaDocument15 pagesHistoria de La Química OrganometálicaJuan Gabriel FernándezNo ratings yet
- Universidad Nacional José Faustino Sánchez CarriónDocument2 pagesUniversidad Nacional José Faustino Sánchez CarriónLuis Rolando Álvarez ChávezNo ratings yet
- HeterociclosDocument13 pagesHeterociclosThalizNo ratings yet