Professional Documents
Culture Documents
Clase 01 - Atomo de Carbono
Uploaded by
Alonso Javier Frías León0 ratings0% found this document useful (0 votes)
18 views56 pagesCopyright
© Attribution Non-Commercial (BY-NC)
Available Formats
PPT, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Attribution Non-Commercial (BY-NC)
Available Formats
Download as PPT, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
18 views56 pagesClase 01 - Atomo de Carbono
Uploaded by
Alonso Javier Frías LeónCopyright:
Attribution Non-Commercial (BY-NC)
Available Formats
Download as PPT, PDF, TXT or read online from Scribd
You are on page 1of 56
Prof. Dr. Oney Ramrez Rodrguez.
Ctedra # 1: tomo de Carbono.
Orbitales atmicos e hibridacin.
Orbitales moleculares.
Energas, ngulos y longitudes de enlace.
Otros tomos en las molculas
orgnicas.
Mecnica Cuntica
Erwin Schrdinger
(Universidad de Zurich)
1926
Mecnica
Cuntica
Desarrollo de expresiones matemticas que describen el movimiento
del electrn en funcin de su energa.
Las expresiones matemticas se conocen como ecuaciones de onda y
se asume el comportamiento dual del electrn onda y partcula.
Las soluciones de la ecuacin de onda se llaman funciones de onda y
se representan con la letra griega + (psi). Cada una corresponde a un
nivel de energa diferente para cada electrn.
+ = + H E
^
+ = + H E
^
Mecnica Cuntica
+ : Funcin de onda: Revela la
probabilidad de encontrar al electrn
en una zona determinada del espacio.
Orbital
Es la zona del espacio donde es mxima la
probabilidad de encontrar un electrn.
+ = + H E
^
Mecnica Cuntica
Cuatro nmeros cunticos
Describen los electrones
n l m
s
Nmero
cuntico
principal
Energa
del
orbital
Nmero
cuntico
secundario
Orbital
Nmero
cuntico
magntico
Diferentes
orientaciones
espaciales de un
orbital
Nmero
cuntico de
spin
Momento
magntico
asociado al giro
Mecnica Cuntica
n 1 a infinito, no tiene cota.
l 0 (n-1).
m l m l + s s
s + -
Distribucin electrnica
n l
x
l = 0 Orbital s 1 orbital 2 e
-
.
l = 1 Orbital p 3 orbitales 6 e
-
.
l = 2 Orbital d 5 orbitales 10 e
-
.
l = 3 Orbital f 7 orbitales 14 e
-
.
Z Nmero atmico
Cantidad de protones en
el ncleo de un tomo.
Mecnica Cuntica
x
y
z
p
x
p
y
p
z
1s
2s
x
y
z
p
y
x
y
z
p
z
y
z
p
x
x
Teora de los Orbitales Moleculares
Los orbitales moleculares se forman por superposicin de orbitales atmicos.
Se forman tantos orbitales moleculares como orbitales atmicos interacten
por una combinacin lineal de estos (CLOA).
Ejemplo: tomo y molcula de hidrgeno
1s
H
1s
H
H H =
H H
d = 0,74 La molcula de hidrgeno resultante contiene 104kcal/mol
menos de energa que los tomos a partir de los cuales fue
construida.
Enlace H H d = 0,74 - Energa de enlace: 104kcal/mol
Teora de los Orbitales Moleculares
Los orbitales moleculares se forman por superposicin de orbitales atmicos.
Se forman tantos orbitales moleculares como orbitales atmicos interacten
por una combinacin lineal de estos (CLOA).
1s
H
1s
H
H H
Orbital
enlazante
Orbital
antienlazante
Interaccin
frontal
Enlace o
Todos los enlaces en los que
participa un tomo de
hidrgeno son de tipo o
Caractersticas
del enlace o
Se forma por superposicin
frontal de los orbitales
Hay libre rotacin
a su alrededor
Existe un solo enlace de
tipo o entre dos tomos
Es el enlace de
menor energa
Teora de la hibridacin
BeCl
2
Molcula lineal ngulo (Cl-Be-Cl) = 180
Be Cl Cl
Teora de la hibridacin
BeCl
2
Molcula lineal ngulo (Cl-Be-Cl) = 180
Be (Z=4) 1s
2
2s
2
No tiene electrones desapareados
No se pueden formar enlaces
Be* (Z=4) 1s
2
2s
1
2p
x
1
Be* (Z=4) 1s
2
2(sp)
1
2(sp)
1
Promover 1 e
-
Hibridar
Se formarn tantos orbitales
hbridos como orbitales
atmicos interacten
2s 2p
Teora de la hibridacin
2sp 2sp
Be
Cl Cl
Be
Cl Cl Be
Enlace o Enlace o
Teora de la hibridacin
BCl
3
Molcula trigonal plana ngulo (Cl-B-Cl) = 120
B
Cl
Cl Cl
Teora de la hibridacin
BCl
3
Molcula trigonal plana ngulo (Cl-B-Cl) = 120
B (Z=5) 1s
2
2s
2
2p
x
1
Un electrn desapareado
Puede formar un solo enlace
B* (Z=5) 1s
2
2s
1
2p
x
1
2p
y
1
B* (Z=5) 1s
2
2(sp
2
)
1
2(sp
2
)
1
2(sp
2
)
1
Promover 1 e
-
Hibridar
Se formarn tantos orbitales
hbridos como orbitales
atmicos interacten
2s 2p
B
Teora de la hibridacin
x
y
p
x
p
y
B
2(sp
2
)
2(sp
2
)
2(sp
2
)
Cl
Cl
Cl
B Cl
Cl
Cl
Enlace o
Enlace o
Enlace o
Teora de la hibridacin
CCl
4
Molcula tetradrica ngulo (Cl-C-Cl) = 109,5
Teora de la hibridacin
CCl
4
Molcula tretradrica ngulo (Cl-C-Cl) = 109,5
C (Z=6) 1s
2
2s
2
2p
x
1
2p
y
1
Dos electrones desapareados
Puede formar dos enlaces
C* (Z=6) 1s
2
2s
1
2p
x
1
2p
y
1
2p
z
1
C* (Z=6) 1s
2
2(sp
3
)
1
2(sp
3
)
1
2(sp
3
)
1
2(sp
3
)
1
Promover 1 e
-
Hibridar
Se formarn tantos orbitales
hbridos como orbitales
atmicos interacten
Teora de la hibridacin
C
2
H
4
Molcula plana Todos los ngulos ~ 120
Estructura
del C
2
H
4
Estructura
del BCl
3
C (Z=6) 1s
2
2s
2
2p
x
1
2p
y
1
Dos electrones desapareados
Puede formar dos enlaces
C* (Z=6) 1s
2
2s
1
2p
x
1
2p
y
1
2p
z
1
C* (Z=6) 1s
2
2(sp
2
)
1
2(sp
2
)
1
2(sp
2
)
1
2p
z
1
Promover 1 e
-
Hibridar
Se formarn tantos orbitales
hbridos como orbitales
atmicos interacten
Teora de la hibridacin
C
2
H
4
Molcula plana Todos los ngulos ~ 120
2s 2p
C
Teora de la hibridacin
x
y
p
x
p
y
C
2(sp
2
)
2(sp
2
)
2(sp
2
)
C
2(sp
2
)
2(sp
2
)
2(sp
2
)
Enlace o
C
sp2
C
sp2
H
H
H
H
4 Enlaces o
C-H
Teora de la hibridacin
A cada carbono le queda un orbital 2p
z
con un electrn
C C
H
Enlace o
Enlace o
Enlace o
H
H
H
Enlace o
Enlace o
H H
Interaccin lateral de los
orbitales 2p
z
de cada carbono
Enlace t H H
Teora de la hibridacin
Hay un doble enlace Carbono Carbono en la molcula de C
2
H
4
formado
por un enlace tipo o(C
sp2
C
sp2
)
y un enlace de tipo t
p-p
C C
H
H H
H
o
t
o
o o
o
Cualquier doble enlace
est formado por un
enlace o y un enlace t
Todos los enlaces
simples son de tipo o
Teora de la hibridacin
C
2
H
2
Molcula lineal Todos los ngulos son de 180
Estructura
del C
2
H
2
Estructura
del BeCl
2
Teora de la hibridacin
C
2
H
2
Molcula lineal Todos los ngulos son de 180
C (Z=6) 1s
2
2s
2
2p
x
1
2p
y
1
Dos electrones desapareados
Puede formar dos enlaces con ngulos de 90
C* (Z=6) 1s
2
2s
1
2p
x
1
2p
y
1
2p
z
1
C* (Z=6) 1s
2
2(sp)
1
2(sp)
1
2p
y
1
2p
z
1
Promover 1 e
-
Hibridar
Se formarn tantos orbitales
hbridos como orbitales
atmicos interacten
Teora de la hibridacin
C
2
H
2
Molcula lineal Todos los ngulos son de 180
2s 2p
C
2sp 2sp
C
2sp 2sp
C
Enlace o
C
sp
C
sp
H H
C H C
Enlace o(Csp-Csp) Enlace o(C-H)
H
Enlace o(C-H)
x
y
z
p
z
x
z
p
x
p
x
p
z
Teora de la hibridacin
A cada carbono le quedan dos orbitales p con un electrn
Interaccin lateral de los
orbitales 2p de cada carbono
Enlace t
C H C
Enlace o Enlace o
H
Enlace o
Dos enlaces tipo t
Teora de la hibridacin
Hay un triple enlace Carbono Carbono en la molcula de C
2
H
2
formado
por un enlace tipo o(C
sp
-C
sp
)
y dos enlaces de tipo t
p-p
Cualquier triple enlace
est formado por un
enlace o y dos enlaces t
Caractersticas
del enlace t
Se forma por superposicin
lateral de los orbitales
No hay libre rotacin
a su alrededor
Puede existir ms de un enlace
de tipo t entre dos tomos
Tiene ms energa
que el enlace o
H
H
H
H H
H H
H
H
H
H
H
o(Csp
3
Csp
3
) 1 2
1 2
o(Csp
2
Csp
2
) 1
o(Csp
3
H) 1 2 3 4 5 7 10
o(Csp
2
H) 1 2
1 t(Csp
2
-Csp
2
)
Representar los orbitales de esta molcula
o(Csp
3
Csp
2
)
Resumen de hibridacin del Carbono
Cantidad de
elementos a los
que se enlaza
Tipos de enlace y
cantidad Geometra Hibridacin
4 (CX
4
) 4 enlaces o Tetradrica sp
3
3 (CX
3
) 3 enlaces o
1 enlace t
Trigonal
plana
sp
2
ngulos de
enlace
~109,5
~120
2 (CX
2
) 2 enlaces o
2 enlace t
Lineal sp
180
Un enlace
doble y dos
simples
Un enlace triple y
uno simple o dos
dobles
Ejemplos
H
3
C
H
2
C
H
2
C
H
2
C C
H
CH
2
sp
3
sp
3
sp
3
sp
3
sp
2
sp
2
H
3
C
H
2
C
H
2
C
H
2
C C CH
sp
3
sp
3
sp
3
sp
3
sp
sp
H
3
C
H
2
C
H
2
C C
H
C CH
2
sp
3
sp
3
sp
3
sp
2
sp
sp
2
CH
4
C
2
H
6
Energa y longitud de enlace
Etano CH
3
CH
3
d(C-C)=1,53 109,5 E(C-C)=88kcal/mol
d(C-H)=1,112 E(C-H)=98kcal/mol
Eteno CH
2
= CH
2
d(C=C)=1,34 H-C-H = 117,5 E(C=C)=163kcal/mol
d(C-H)=1,103 H-C-C = 121 E(C-H)=108kcal/mol
Etino H C C H d(CC)=1,21 180 E(CC)=198kcal/mol
d(C-H)=1,08
Compuesto
Distancia
de enlace
ngulos
de enlace
Energas
de enlaces
Otros tomos en molculas orgnicas
Nitrgeno: N (Z=7) 1s
2
2s
2
2p
x
1
2p
y
1
2p
z
1
sp
3
: Si tiene tres enlaces simples.
CH
3
NH
2
CH
3
CH
2
CH
2
NH CH
2
CH
3
sp
2
: Si tiene un enlace doble.
CH
3
CH
2
N = O
N H
3
C
O
O
H
3
N
H
N
O
O
N
H
O
O
OH
Ala - Val - Ser
sp: Si tiene un enlace triple.
CH
3
C N
sp
2
: Si tiene tres enlaces simples, pero se enlaza al grupo carbonilo
formando el grupo amida, y en el anillo de pirrol.
H
3
C C
N
O
H
H
Otros tomos en molculas orgnicas
N
H
Pirrol
Otros tomos en molculas orgnicas
Oxgeno: O (Z=8) 1s
2
2s
2
2p
x
2
2p
y
1
2p
z
1
sp
3
: Si tiene dos enlaces simples.
CH
3
OH CH
3
CH
2
CH
2
OH CH
3
CH
2
O CH
3
sp
2
: Si tiene dos enlaces simples, pero se enlaza al grupo carbonilo
formando el grupo ster, y en el anillo de furano.
H
3
C C
O
O
CH
3
Otros tomos en molculas orgnicas
O
sp
2
: Si tiene un enlace doble.
H
3
C C
N
O
H
H
O
Furano
Representar los orbitales t de esta molcula
O
t(C-C) t(C-C) t(C-O)
Cuando los sistemas insaturados estn directamente
enlazados, los orbitales p se colocan paralelos para favorecer
la conjugacin y aumentar la estabilidad de la molcula.
O N
H
t(C-C) t(C-O) t(C-C)
Cuando un tomo con pares de electrones libres se enlaza a un
sistema insaturado el par de electrones se deslocaliza en el
sistema t y ocurre la conjugacin.
Representar los orbitales t de esta molcula
Carbocatin alilo
t(C-C)
Los carbonos con carga positiva son
planos y se llaman carbocationes
La hibridacin del
carbono es sp
2
Si un carbocatin o cualquier tomo con un orbital p vaco est enlazado a
un sistema insaturado, entonces el orbital p y el t se colocan paralelos
para aumentar la conjugacin y favorecer la estabilizacin.
Representar los orbitales t de esta molcula
C C C
H
H H
H
x
z
p
z
p
z
p
x
p
x
x
z
El carbono central tiene
hibridacin sp, los otros dos
tienen hibridacin sp
2
Carbono central con dos orbitales
p (se representan p
x
y p
z
).
Carbonos sp
2
con un
solo orbital p.
Enlace t
p
z
p
z
Enlace t
p
x
p
x
Representar los orbitales t de esta molcula
C C C
H
H H
H
x
z
p
z
p
z
p
x
p
x
x
z
Enlace t
p
z
p
z
Enlace t
p
x
p
x
Cuando aparecen dos dobles enlaces sobre un mismo
carbono, los enlaces t son necesariamente perpendiculares
debido a la geometra de los orbitales que los forman. Esto
implica que ellos no pueden solaparse entre s.
Es la Qumica de los compuestos del Carbono
Qu es la Qumica Orgnica?
Grupo IVA o XIV Periodo 2
C (Z=6) 1s
2
2s
2
2p
x
1
2p
y
1
Tetravalente: Su valencia siempre es 4.
Distintos tipos de geometra en las molculas.
Metano
CH
4
Diversidad de compuestos orgnicos
Etano
C
2
H
6
cido actico
CH
3
COOH
Acetileno
C
2
H
2
O
O
O
O
O
O
CH
2
CH
CH
2
Triestearina
H
2
N
O
O
Benzocana
OH
O
Ibuprofeno
HO
OH
H
N
OH
Adrenalina
H
2
N COOH
CH
3
H
L-Alanina
O
HO
HO OH
HOH
2
C
OH
D-Glucosa
O
HO
HO OH
HOH
2
C
OH
D-Manosa
N
N
N
N
NH
2
O
OH OH
H H
H H
HO
Adenosina
N
NH
2
O N
O
OH OH
H H
H H
HO
Citosina
Diversidad de compuestos orgnicos
Formas de representar los compuestos orgnicos
Frmula molecular
C
4
H
10
Frmula desarrollada
H C
H
H
C
H
H
C
H
H
C
H
H
H
H C
H
H
C
H
C
C
H
H
H
H
H H
Frmula semidesarrollada
CH
3
- CH
2
- CH
2
- CH
3
CH
3
- CH
- CH
3
CH
3
Varillas o lneas
Tipos de tomos de Carbonos
Primario: Aqul que se enlaza a un solo tomo de carbono.
Secundario: Aqul que se enlaza a dos tomos de carbono.
Terciario: Aqul que se enlaza a tres tomos de carbono.
Cuaternario: Aqul que se enlaza a cuatro tomos de carbono.
1
1
1
1
1
1
1
1
1
OH
1 1
2
2
2
2
3
4
Clasificacin vlida slo para carbonos saturados (tetradricos)
no enlazados a C=C, CC o anillos bencnicos.
Ctedra # 1: tomo de Carbono.
Orbitales atmicos e hibridacin.
Orbitales moleculares.
Energas, ngulos y longitudes de enlace.
Otros tomos en las molculas
orgnicas.
You might also like
- 05 - Estabilidad en DisolucionDocument14 pages05 - Estabilidad en DisolucionJesus Leon BarberenaNo ratings yet
- Enlace Valencia Hibridacion PDFDocument23 pagesEnlace Valencia Hibridacion PDFANNo ratings yet
- LewisDocument14 pagesLewisAlfredo GsNo ratings yet
- Potencial de IonizacionDocument10 pagesPotencial de IonizacionLuisa SierraNo ratings yet
- Práctica Enlace Iónico y CovalenteDocument2 pagesPráctica Enlace Iónico y CovalenteIsaac Cervantes33% (3)
- Enlace CovalenteDocument31 pagesEnlace Covalentehenry2392100% (5)
- Quimica Semana #9 PDFDocument10 pagesQuimica Semana #9 PDFenriqueNo ratings yet
- Ejercicios EnlaceDocument2 pagesEjercicios Enlacevictor huayhua choqueticoNo ratings yet
- Laboratorio #2 - Enlaces y Fuerzas de AtraccionDocument11 pagesLaboratorio #2 - Enlaces y Fuerzas de AtraccionMaria Paula LuboNo ratings yet
- Teorías de EECC y complejos de coordinaciónDocument2 pagesTeorías de EECC y complejos de coordinaciónJazmin StabileNo ratings yet
- Estructura de Los Materiales PDFDocument7 pagesEstructura de Los Materiales PDFEmmanuel ReyesNo ratings yet
- EXAMEN Uniones QcasDocument4 pagesEXAMEN Uniones Qcaslauraghione100% (1)
- Enlace IónicoDocument5 pagesEnlace IónicoInes Margarita Cahuaniancco TipoNo ratings yet
- Unidad3Document21 pagesUnidad3Jose Raul HolguinNo ratings yet
- Tabla PeriodicaDocument37 pagesTabla Periodicaramirez_0992No ratings yet
- Estructura atómica, sistema periódico y enlace químicoDocument65 pagesEstructura atómica, sistema periódico y enlace químicoPedro AntonNo ratings yet
- Propiedades Periodicas PracticaDocument4 pagesPropiedades Periodicas PracticaClareth TencioNo ratings yet
- Regla Del OctetoDocument7 pagesRegla Del OctetoRosa RiveroNo ratings yet
- Parte A, Práctica 1Document12 pagesParte A, Práctica 1delia donisNo ratings yet
- Estructura MolecularDocument36 pagesEstructura MolecularleasturbaNo ratings yet
- Formato de Entrega Tarea 1Document5 pagesFormato de Entrega Tarea 1DIDIER CAMACHO FLOREZNo ratings yet
- Expo Inorganica PolarizabilidadDocument13 pagesExpo Inorganica PolarizabilidadAnaNo ratings yet
- Quimica OrganicaDocument2 pagesQuimica OrganicaSarahi Alvarez MartinezNo ratings yet
- TALLER DE Enlaces QuimicosDocument4 pagesTALLER DE Enlaces QuimicosCarlos MojicaNo ratings yet
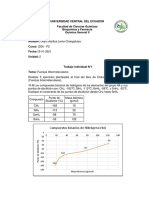
- T1 - Tarea Individual - Ejercicios Fuerza IntermolecularDocument3 pagesT1 - Tarea Individual - Ejercicios Fuerza IntermolecularDeysi LemaNo ratings yet
- Taller de QquimnDocument2 pagesTaller de QquimnAnonymous WJRL9INo ratings yet
- Examen de Admisón Unac 2010 - IiDocument2 pagesExamen de Admisón Unac 2010 - IiCarlos Alfonso Jara Benites100% (1)
- INFORME DE 5 QUIMICA BorradorDocument10 pagesINFORME DE 5 QUIMICA Borradorsamuel reynero fernandez velaNo ratings yet
- Examen Preca Quimica 12 PreguntasDocument3 pagesExamen Preca Quimica 12 PreguntasMecing A MichaelNo ratings yet